Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Novembre 2000 - Volume III - numero 9
M&B Pagine Elettroniche
Il punto su
Il
sistema immune
(Parte
seconda)
- 1° parte: la risposta immune
- 2° parte: i recettori per l'antigene e la selezione clonale
- 3° parte: risposte immuni acquisite B e T
- 4° parte: linfociti e tessuto linfoide
- 5° parte: i linfociti T e la regolazione della risposta immune
Lo
sviluppo dei linfociti e della linea mieloide dalla cellula
primordiale staminale, a livello prima del fegato fetale e poi del
midollo osseo è guidato dall'interazione con le cellule
stromali (fra le quali i fibroblasti) e dalle citochine, che
includono il fattore delle cellule staminali e i vari fattori
stimolanti le colonie.
Gli stadi
iniziali dello sviluppo dei linfociti non richiedono la presenza di
un antigene, ma, siccome queste cellule esprimono un recettore maturo
per l'antigene, la loro sopravvivenza e la loro ulteriore
differenziazione sono antigene-dipendenti.
La
struttura delle molecole antigene-specifiche
Di
seguito verranno esposte le caratteristiche dei recettori delle
cellule B e delle cellule T e le diversità che caratterizzano
questi recettori.
Recettore
della cellula B e anticorpi solubili
Dai
classici lavori di Edelman (Edelman GM, 1973) sappiamo che un
anticorpo è costituito da due catene pesanti e da duecatene leggere, legate fra loro da ponti disolfuro. Il
terminale N di ciascuna molecola possiede una parte variabile che si
lega all'antigene, attraverso 3 regioni ipervariabili ad esso
complementari. Le parti terminali C sia delle catene pesanti che
della catene leggere formano le regioni costanti, grossolanamente
uguali in tutti gli anticorpi, sulla base della cui struttura si
riconoscono la classe e la sottoclasse dell'anticorpo e le catene
leggere che caratterizzano il tipo k o l.
La
sequenza degli aminoacidi della regione costante delle catene pesanti
permette il riconoscimento di 5 classi di immunoglobuline: la
classe IgG, la IgA, la IgM, la IgD e la IgE. La classe IgG si
suddivide a sua volta in 4 sottoclassi: IgG1, IgG2, IgG3 e IgG4,
mentre le IgA si suddividono in 2 sottoclassi.
Queste
classi e sottoclassi hanno, come si sa, una diversa funzione.
Ogni tipo
di anticorpo può essere prodotto secondo due modalità:
a)come anticorpo circolante
b)
come anticorpo fisso. Questo tipo di molecola possiede una
sequenza idrofobica transmembrana, che ancora la molecola alla
superficie della cellula B, dove funziona come recettore della stessa
cellula B
L'unità
monomerica basale dell'anticorpo è bivalente (e quindi può
essere considerata come un tetramero, in questo simile alla molecola
dell'emoglobina), con due bracci per legarsi all'antigene di
identica specificità. Ognuno di questi bracci può
essere rotto in laboratorio attraverso un processo proteolitico, per
dar luogo a singoli frammenti (Fab) monovalenti, leganti
l'antigene (Vedi Figura n.4).
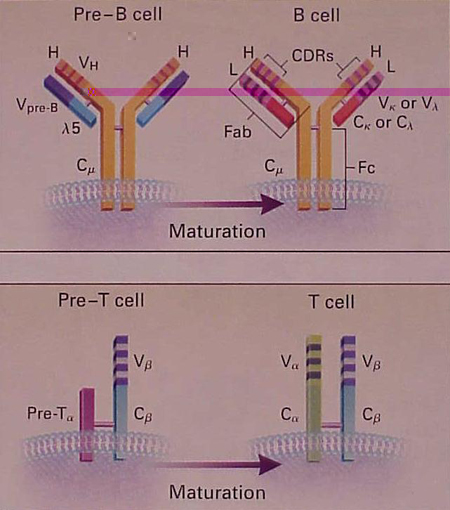
Figura
n.4 – Struttura della cellula B immatura e matura e dei recettori
per l'antigene della cellula T
Le
cellule immature pre-B e pre-T esprimono le versioni preliminari del
recettore per l'antigene.
A questo stadio i recettori della cellula B sono formati da un paio di catene pesanti (H), ognuna con una porzione variabile (V) e una porzione costante (Cm), identiche a quelle che si trovano nel recettore maturo, e un paio di catene leggere abbozzate, chiamate Vpre-B e l5. Quando la cellula B si sviluppa, le catene leggere abbozzate sono rimpiazzate da catene leggere regolari (L), del tipo k o l, ognuna di esse con una regione variabile e una regione costante.
Queste molecole mature della classe IgM agiscono come recettori della cellula B per l'antigene, usualmente insieme con i recettori IgD della cellula B con la stessa specificità antigenica. Le regioni variabili delle catene pesanti e leggere contengono ognuna 3 regioni ipervariabili (CDRs). Queste regioni ipervariabili entrano in contatto con l'antigene.
A questo stadio i recettori della cellula B sono formati da un paio di catene pesanti (H), ognuna con una porzione variabile (V) e una porzione costante (Cm), identiche a quelle che si trovano nel recettore maturo, e un paio di catene leggere abbozzate, chiamate Vpre-B e l5. Quando la cellula B si sviluppa, le catene leggere abbozzate sono rimpiazzate da catene leggere regolari (L), del tipo k o l, ognuna di esse con una regione variabile e una regione costante.
Queste molecole mature della classe IgM agiscono come recettori della cellula B per l'antigene, usualmente insieme con i recettori IgD della cellula B con la stessa specificità antigenica. Le regioni variabili delle catene pesanti e leggere contengono ognuna 3 regioni ipervariabili (CDRs). Queste regioni ipervariabili entrano in contatto con l'antigene.
La
versione circolante dell'anticorpo è formata dalle stesse 4
catene, ma manca la sequenza transmembrana che ancora la molecola,
funzionante come recettore, sulla superficie della cellula B.
Un'altra
parte della molecola delle immunoglobuline, la regione Fc,
contiene la maggior parte della regione costante delle catene
pesanti.
Le IgA
secretorie, a livello delle superficie mucose, sono un dimero
tetravalente, mentre le IgM circolanti sono un pentamero decavalente.
I polimeri IgA e IgM sono stabilizzati dalla catene J. Le IgA
secretorie contengono una molecola, detta componente secretorio, che
protegge le IgA secretorie dalla rottura proteolitica all'interno
dell'apparato gastro-intestinale.
Recettore
della cellula T
A
differenza degli anticorpi, i recettori della cellula T sono
rappresentati solo dalle molecole transmembrana. Essi consistono di
eterodimeri a/b o g/d: ogni catena a, b, g e d contiene una parte
variabile e una parte costante.
Come
nella molecola di anticorpo, la parte variabile contiene 3 regioni
complementari (Vedi Figura 4), che nel caso del recettore
della cellula T a/b riconosce un complesso formato da un peptide
sistemato nella “fessura” di una molecola MHC.
La maggior parte delle cellule T g/d non riconoscono l'antigene nella forma di complessi peptide-MHC, sebbene le molecole MHC-simili (MHC non classico) come il CD1 possano presentare alcuni antigeni (particolarmente lipidi e glicolipidi) ad alcune cellule T g/d. Altre cellule T g/d riconoscono l'antigene direttamente, proprio come una molecola di anticorpo.
La maggior parte delle cellule T g/d non riconoscono l'antigene nella forma di complessi peptide-MHC, sebbene le molecole MHC-simili (MHC non classico) come il CD1 possano presentare alcuni antigeni (particolarmente lipidi e glicolipidi) ad alcune cellule T g/d. Altre cellule T g/d riconoscono l'antigene direttamente, proprio come una molecola di anticorpo.
La
diversità dei recettori dell'antigene
E'
stato calcolato che i linfociti B siano teoricamente capaci di
produrre circa 10 alla quindicesima (un milione di miliardi)
divresità nelle regioni variabili degli anticorpi e i
linfociti T un numero analogo di regioni variabili dei recettori. E'
da sottolineare che la grandissima diversità del repertorio
immune origina da meno di 400 geni. Questa straordinaria opera deriva
da un unico processo di ricombinazione, che taglia, aggiunta e
modifica i geni della regione variabile.
I
componenti genetici che codificano le immunoglobuline si trovano in 3
cromosomi:
- il raggruppamento IGH delle catene pesanti si trova sul cromosoma 14
- il raggruppamento IGK delle catene leggere k, localizzato sul cromosoma 2
- e il raggruppamento IGL delle catene leggere l, localizzato sul cromosoma 22.
Entro il
raggruppamento IGH vi sono 4 tipi di segmenti genici: V (variabile),
D (diverso), J (congiunto) e C (costante). I raggruppamenti IGK e IGL
mancano dei segmenti D. Tutti questi segmenti contengono molti geni;
nel raggruppamento IGH, per esempio, vi sono almeno 50 segmenti V
funzionali.
I geni
dei recettori delle cellule T hanno un'organizzazione simile: anche
essi contengono i segmenti V, D, J e C. I 3 loci TCRA/D (sul
cromosoma 14), TCRB (sul cromosoma 7) e TCRG (sempre sul cromosoma 7)
corrispondono alle catene a e d, la catena b e la catena g dei
recettori della cellula T. Al contrario dei loci TCRB e TCRD, i loci
TCRA e TCRG non contengono i segmenti D. Come per i geni delle
immunoglobuline, ogni locus contiene molti geni V, D e J. Sul TCRA,
per esempio, vi sono da 70 a 80 geni V e circa 60 geni J.
Il
processo di ricombinazione collega un segmento di gene di ogni tipo
(per esempio VDJC nel caso della catena pesante delle
immunoglobuline) per formare un'unità codificante lineare
per ogni catena di recettori. Ogni linfocita ha una differente
combinazione di questi segmenti genici per formare il codice genetico
del suo recettore per gli antigeni (Vedi figura 5). Le
sequenze dei recettori delle cellule T generalmente rimangono
inalterate durante la divisione cellulare; questo non avviene invece
per le cellule B, che nei centri germinali degli organi linfoidi
secondari (linfoghiandole) possono mostrare un ulteriore
riarragiamento dei geni V, per mezzo di un processo chiamato
“receptor editing”.
Selezione
clonale
Per ogni
antigene specifico non ci sono più di poche migliaia di
linfociti. Poiché ogni cellula B è programmata per
esprimere solo uno di un gran numero di potenziali anticorpi, tutte
le molecole del recettore per gli antigeni su un dato linfocita,
hanno la stessa specificità. Tra questi cloni di linfociti,
quelli che producono un recettore che si lega con un antigene vengono
selezionati per partecipare a una risposta immune: questo processo
viene detto di selezione clonale. La cellula selezionata
dall'antigene prolifera, in modo tale da portare a un rapido
aumento nel numero delle cellule B e T, che possano riconoscere
l'antigene. La maggior parte delle risposte interessa molti diversi
cloni (esse sono cioè policlonali) perché anche un
relativamente semplice antigene porta molti differenti epitopi,
ognuno dei quali ha la capacità di legarsi a un unico clone.
A
differenza dei geni delle cellule T, i geni che codificano i
recettori delle cellule B sottostanno a un processo di ipermutazione
somatica. Il processo avviene durante la proliferazione cellulare
all'interno del centro germinale nel tessuto linfoide secondario.
Le modificazioni degli aminoacidi dell'anticorpo, che risultano da
questo processo, rinforzano il riconoscimento dell'antigene da
parte dei recettori delle cellule B e determinano la forza del legame
(affinità) dell'anticorpo. Più forte è
il legame con l'antigene e maggiore è la possibilità
che la cellula B ha di sopravvivere e moltiplicarsi: un classico
meccanismo darwiniano di selezione cellulare naturale che porta alla
produzione di anticorpi ad alta affinità. Il risultato della
selezione clonale è una popolazione di cellule B con alta
affinità e squisita specificità antigenica per
l'antigene immunizzante, insieme a una memoria dell'incontro.
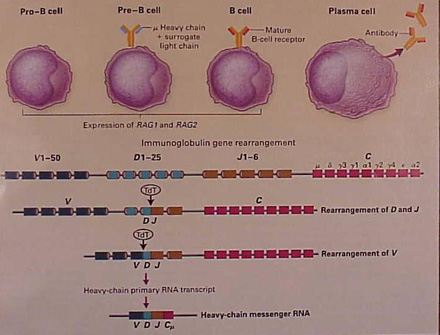
Figura
n. 5 – Diversità dei recettori degli antigeni
La enorme
diversa specificità dei recettori per gli antigeni è
dovuta al riarrangiamento dei geni durante gli stadi di sviluppo
precoce dei linfociti. Sono illustrati nella figura gli eventi
interessati alla produzione di una sequenza codificante di una catena
pesante di immunoglobuline. Precocemente nello sviluppo della cellula
B, dalla pro-cellula B alla pre-cellula B, essi esprimono i geni
attivanti la ricombinazione RAG1 e RAG2. La ricombinasi, codificata
da questi geni, media il riarrangiamento a caso di uno dei 25 diversi
segmenti genici (D) con ognuno dei sei segmenti genici J. Questa fase
è seguita dal riarrangiamento di ognuno dei 50 segmenti genici
variabili (V) vicino al segmento DJ, già riarrangiato.
Differenti cellule B riarrangiano un differente segmento in ogni
pool, creando un nuovo livello di diversità. Un'ulteriore
diversità deriva dall'inaccuratezza del congiungimento
e dalla incorporazione di nucleotidi, mediata da un enzima
deossi-ribo-nucleotidil-transferasi terminale (TdT). La trascrizione
della catena pesante primaria RNA è processata nell'RNA
messaggero (mRNA) con la congiunzione del segmento riarrangiato VDJ,
vicino al gene della regione costante C. Questo mRNA codificherà
una catena pesante, che appare sulla superficie delle cellule pre-B
insieme con il surrogato della catena leggera, che è
codificata dai geni che non sono stati sottoposti a riarrangiamento.
Quando la cellula pre-B continua a maturare, i geni delle catene
leggere delle immunoglobuline sono sottoposti a riarrangiamento; la
risultante catena leggera si sostituisce alla catena leggera
surrogato e dà luogo a un recettore maturo della cellula B
sulla superficie della cellula.
I
recettori della cellula B a questo stadio includono anche anticorpo
IgD con la stessa specificità delle molecole IgM, prodotte da
un congiungimento alternativo di VDJ riarrangiato al gene Cm o Cd.
Dopo avere incontrato l'antigene e in presenza di segnali
costimolatori, la cellula B di differenzia ulteriormente in
plasmacellula, che secerne alti livelli di anticorpi specifici o
diviene una cellula B della memoria.
Gli stessi principi generali riguardano il processo di riarrangiamento applicato alla produzione di recettori a/b e g/d delle cellule T.
Gli stessi principi generali riguardano il processo di riarrangiamento applicato alla produzione di recettori a/b e g/d delle cellule T.
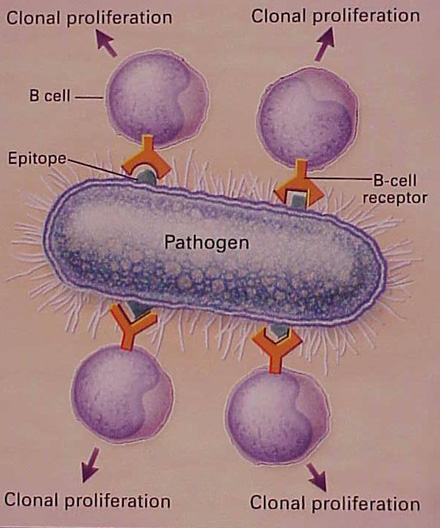
Figura
n.6 – Riconoscimento degli epitopi da parte delle cellule B
Usando le
molecole di anticorpi come i suoi recettori, la cellula B riconosce
gli epitopi sulla superficie dell'antigene. Se la cellula viene
stimolata da questo contatto, essa prolifera e i cloni risultanti
possono secernere anticorpi la cui specificità è la
stessa di quella del recettore sulla superficie della cellula, che ha
legato l'epitopo. Le risposte usualmente interessano molti
differenti cloni di linfociti e sono quindi indicate con il nome di
“policlonali”. Per ogni epitopo ci possono essere molti
differenti cloni linfocitari in un modo leggermente differente e
d'altra parte con differenti recettori delle cellule B, ognuno dei
quali riconosce l'epitopo con una differente forza di affinità.
La
proliferazione dei nuovi linfociti durante il loro primo incontro con
l'antigene (la risposta immune primaria), genera sia le cellule
effettrici T che B (cellule T citotossiche e T helper e plasmacellule
secernenti anticorpi). Le cellule della memoria preparano una
risposta immune, quantitivamente e qualitativamente secondaria, che
si manifesta dopo un successivo incontro con lo stesso antigene
(richiamo). Le nuove cellule e le cellule T della memoria possono,
per una certa parte essere distinte, perché esse spesso
esprimono differenti versioni della molecola CD45 (una tirosin
fosfatasi che regola l'attivazione cellulare) sulla loro
superficie; il CD45RA si esprime sulla nuove cellule, mentre il
CD45RO si esprime sulle cellule della memoria. Poiché le
cellule della memoria sono aumentate di numero in confronto alle
cellule nuove e poiché le cellule della memoria sono anche più
facilmente stimolate, la risposta secondaria è più
rapida della risposta immune primitiva. Ciò produce un gran
numero di linfociti e, nel caso delle cellule B, un maggior livello
di anticorpi, che hanno una maggiore affinità con l'antigene,
rispetto all'anticorpo della risposta primitiva.
Il
concetto di vaccinazione si basa proprio sul fatto che
un'esposizione volontaria a una versione, non pericolosa, di un
patogeno, permette la formazione di cellule della memoria, senza
avere le sequele patologiche dell'agente infettivo stesso. In
questo modo il sistema immune è preparato a montare una
risposta immune secondaria con una protezione forte e immediata in
risposta a un microrganismo che potrà essere incontrato nel
futuro.
Bibliografia
Delves
PJ, Roitt IM – The immune system (First of two parts) – N Engl J
Med 343, 37-49, 2000
Edelman
GM – Antibody structure and molecular immunology – Science 180,
830-40, 1973
Vuoi citare questo contributo?
