Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Maggio 2002 - Volume V - numero 5
M&B Pagine Elettroniche
Contributi Originali - Ricerca
Lo
screening uditivo neonatale: un'esperienza a misura di Nido
U.
O. Pediatria, Ospedale Civile Castelfranco Veneto
* Unità
Operativa di Otochirurgia e Centro multidisciplinare per l'ipoacusia
infantile, Azienda Ospedaliera di Padova
Introduzione
Un udito
normale è necessario per sviluppare delle ottimali capacità
comunicative verbali. In caso contrario e cioè quando un
bambino presenta un difetto di entrata sonora e un'alterazione
delle normali capacità di autoascolto, vengono compromessi in
modo particolare lo sviluppo della percezione del parlato e lo
sviluppo della produzione verbale, e con il tempo si svilupperanno
anche numerose altre disabilità di tipo linguistico,
scolastico e psicosociale.
Le
conseguenze comunicative di una ipoacusia bilaterale congenita di
grado severo o profondo sono note e da molti anni ben documentate
(ref. 1-2): deprivano un bambino dell'essenziale esposizione al
parlato e si manifestano con un mancato sviluppo della comunicazione
orale. I bambini con ipoacusie di questa gravità hanno, in
media, dei risultati scolastici molto inferiori ed uno sviluppo
sociale ed emotivo più povero rispetto ai loro corrispondenti
normoudenti.
Diversamente
dal deficit profondo, una perdita uditiva di grado moderato non
preclude totalmente lo sviluppo linguistico ma, a seconda del grado
di compromissione e della configurazione del danno, potrà
essere responsabile di difficoltà di ascolto in ambienti
rumorosi, di ritardato sviluppo linguistico e di difetti della
produzione orale, oltre che di possibili disabilità
psicologiche e relazionali di entità minore (3-4).
Perdite
di udito significative, capaci di rallentare o di impedire
l'acquisizione di un linguaggio corretto, non sono rare: si
manifestano in 1-2 neonati/1000 che nascono al Nido (5) ed in
1,5-15,3 neonati/100 ricoverati in Terapia Intensiva Neonatale (6-7).
La prevalenza dell'ipoacusia congenita è dunque più
alta di quella della fenilchetonuria ( 1/10.000 nati) e
dell'ipotiroidismo congenito ( 1/3000 nati), malattie per le quali la
legislazione italiana prevede uno screening neonatale.
Le
ipoacusie congenite
Purtroppo,
in assenza di uno screening specifico, l'età media di
identificazione delle ipoacusie congenite si colloca a circa uno-due
anni di età per le ipoacusie congenite severe e profonde e
sopra i 3 anni per quelle moderate e gravi, età che
corrispondono al periodo in cui diventano evidenti gli esiti
linguistici di una perdita uditiva, caratterizzati dalla mancanza,
ritardo o difetto di produzione verbale. Il periodo compreso prima
dei dodici mesi di vita è probabilmente il più critico
per lo sviluppo uditivo: enormi sono i progressi che vengono
realizzati in aree fondamentali come la percezione del parlato, la
produzione di suoni e l'integrazione linguistica senza i quali la
prima parola di un bambino non potrebbe essere pronunciata. In questo
senso sono sempre maggiori le evidenze che, dopo tale fase, lo
sviluppo della via uditiva, se non stimolato, potrebbe risultare
inefficace ed incompleto ( 8).
Associata
alla difficoltà di riconoscere un'ipoacusia alla nascita
risulta tuttora radicata l'erronea convinzione che non sia
possibile verificare con certezza, e senza errori, una perdita
uditiva fin dai primi giorni di vita e soprattutto avviare una
terapia protesica molto prima dell'anno di età.
I
potenziali evocati uditivi del tronco e le otoemissioni acustiche
sono metodiche oggi in grado di evidenziare una probabile perdita
uditiva fin dal periodo perinatale, in modo oggettivo, con
elevatissima sensibilità (>98%) e buona specificità
(>90%) se condotte nell'ambito di protocolli controllati (9-10).
Non solo,
un'adeguata amplificazione nei bambini affetti da ipoacusia può
essere avviata già verso i primissimi mesi di vita, a patto
che ciò avvenga presso centri di audiologia infantile
qualificati e secondo protocolli precisi. In seguito all'istituzione
presso diversi paesi di screening uditivi neonatali e protesizzazioni
acustiche precoci, stanno emergendo, negli ultimi anni, anche
le evidenze che una precoce abilitazione uditiva induca un normale
sviluppo linguistico (11).
In Italia
purtroppo non esiste una specifica legislazione che promuova lo
screening uditivo neonatale, anche se la Conferenza Europea sullo
Stato dello Screening Uditivo Neonatale tenutasi nel maggio 1998 a
Milano (12) promuove ed auspica l'applicazione dello stesso in tutti
i Paesi della Comunità Europea; negli Stati Uniti la
situazione è più avanzata, poiché numerosi Stati
(13) possiedono una legislazione che obbliga i punti nascita
all'esecuzione dello screening uditivo neonatale.
Agli
inizi del 1999 l'Accademia Americana di Pediatria ha prodotto una
"Task Force on Newborn and Infant Hearing" attraverso la
quale ha riconosciuto la necessità di uno screening uditivo
neonatale ed ha definito delle linee guida per l'applicazione dello
stesso (14).
Gli
strumenti per lo screening uditivo neonatale
In
Italia, fino a qualche anno fa e forse ancora in qualche punto
nascita, il neonato, prima della dimissione dal Nido veniva
sottoposto alla reattometria, che consiste nel presentare uno stimolo
uditivo al bambino e osservarne le reazioni o i cambiamenti di
comportamento. Nel caso di neonati questo tipo di osservazione
audiometrica cerca di determinare se il bambino reagisce ad un suono
abbastanza intenso (60 dB SPL o più) prodotto da uno strumento
portatile con risposte come il riflesso palpebrale, il risveglio, lo
startle reflex. Metodiche comportamentali come queste utilizzate
negli screening uditivi presentano numerose limitazioni.
Richiedono ad esempio stimoli di elevata intensità che
impediscono l'identificazione di deficit uditivi lievi o moderati.
I risultati si sono dimostrati poco affidabili, con un alto numero di
falsi positivi e di falsi negativi e cioè bambini dall'udito
normale che devono essere sottoposti ad inutili accertamenti
diagnostici e bambini con reale deficit uditivo per i quali la
diagnosi verrà per lo meno di molto ritardata per una falsa
tranquillità di risultato. Infine l'erogazione sonora da un
altoparlante non rende possibile la distinzione di una riposta legata
all'udito da un solo lato o entrambi. Questo esame, che
possiede una sensibilità e specificità bassissime,
viene pertanto fortemente sconsigliato come metodica di screening
(15).
Un
secondo approccio all'identificazione mira a determinare se il
bambino possiede uno dei numerosi fattori di rischio associati alla
perdita uditiva. La lista dei rischi o degli indicatori di danno
audiologico infantile si è sviluppata ed è
cresciuta negli anni: quelli attualmente in uso sono raccomandati dal
Joint Commitee on Infant Screening del 1994 e sono costituiti da:
- storia familiare di ipoacusia neurosensoriale,
- storia di infezioni congenite associate a danno uditivo neurosensoriale,
- anomalie cranio-facciali,
- peso alla nascita inferiore a 1550 g,
- iperbilirubinemia eccedente l'indicazione all'exanguinotrasfusione,
- uso di farmaci ototossici,
- storia di meningiti batteriche,
- Apgar da 0 a 3,
- prolungata ventilazione meccanica,
- stigmate che si associano a ipoacusia neurosensoriale.
I bambini
identificati attraverso un registro di rischio audiologico vengono
esaminati da personale audiologico e seguiti longitudinalmente.
Il
vantaggio delle categorie di rischio è quello di circoscrivere
una popolazione in cui l'ipoacusia ha una prevalenza molto
maggiore, stimata tra il 2-3 per cento rispetto all'1,5-2,5 per
mille della popolazione universale.
Lo
svantaggio di un registro di questo genere è invece legato al
fatto che circa il 50% delle ipoacusie non ha alcun fattore di
rischio nell'anamnesi e si presenta in modo isolato e sporadico,
non identificabile alla nascita o nei primi mesi di vita, se non
misurando direttamente le capacità uditive.
Lo
screening uditivo mediante l'uso dei potenziali evocati uditivi
dimostra ottima validità e affidabilità anche se
diversi Autori manifestano una certa perplessità del loro uso
negli screening universali per l'elevata quota di REFER (vero
positivo + falso positivo) dopo un primo test, la lunghezza
dell'esame e l'elevato impegno in termini di tempo e costo. Il
recente sviluppo di algoritmi che consentono di eseguire una
detezione automatica dell'onda V ha ridotto in modo sostanziale la
spesa legata al personale tecnico. In Italia i potenziali evocati
uditivi sono riservati quasi esclusivamente ai neonati che
presentano fattori di rischio o ai bambini presenti nelle NICU,
considerando comunque che in tale maniera vengono identificati solo
il 50% degli affetti da ipoacusia significativa (16).
Le
emissioni otoacustiche sono suoni generati dalla coclea normale in
risposta a stimoli sonori inviati nel condotto uditivo esterno.
Possono essere misurate con microfoni piccoli e sensibili
direttamente nel condotto uditivo esterno e riflettono
presumibilmente la funzionalità delle cellule cigliate
esterne. La loro mancata evocazione è un buon predittore di
presenza di ipoacusia neurosensoriale > 35dB HL16. Il test è
veloce, non invasivo, non richiede applicazione di elettrodi. Due
sono i tipi di otoemissioni utilizzate nei programmi di screening: le
otoemissioni evocate da click (transient evoked otoacoustic
emissions, TEOAE) e le otoemissioni evocate prodotti di distorsione
(Distortion Product Otoacoustic Emissions).
Gli
svantaggi della metodica sono in parte legati ad uno scarso consenso
per quanto riguarda i criteri numerici che dividerebbero i “PASS”
dai “REFER”, alla probabile minor elicitazione delle otoemissioni
nelle prime 48 di vita, alla mancata elicitazione in caso di ostacolo
alla conduzione meccanica (cerume, versamento endotimpanico). I refer
sono maggiori rispetto ai potenziali evovati uditivi del tronco (ABR
auditory brainstem response) (circa 10-15% rispetto ai 5-10%) ma
questo svantaggio può essere probabilmente ovviato ripetendo
il test una seconda volta.
Norton e
coll. hanno sottoposto alle TEOAE circa 7000 neonati provenienti
dalla Terapia Intensiva Neonatale o dal Nido, con fattori di
rischio e senza fattori di rischio; la conclusione del loro lavoro è
che le otoemissioni acustiche sono facilmente misurabili in tutti
questi soggetti (17).
Gorga e
al. hanno comparato la capacità delle TEOAE, delle DPOAE e
delle ABR nell'identificazione dei deficit uditivi neonatali,
giungendo alla conclusione che tutti e tre i test danno una bassa
frequenza di REFER e possiedono un'alta sensibilità
nell'identificazione di perdite uditive importanti per le quali è
fortemente raccomandato un intervento precoce (18).
L'Accademia
Americana di Pediatria ritiene le TEOAE una valida metodica per lo
screening uditivo neonatale (14) per la loro non invasività,
affidabilità e semplicità di esecuzione.
La
nostra esperienza
Dal mese
di ottobre 2000, presso il Nido dell'U.O. della Pediatria di
Castelfranco Veneto, tutti i neonati, vengono sottoposti allo
screening uditivo con TEOAE (tabella 1); mediamente nascono
circa 1200 bambini/anno in un territorio con una popolazione di circa
100.000 abitanti; al nostro Nido afferiscono i nati con un'età
gestazionale superiore alla 33°esima settimana. Il tempo medio di
degenza è di circa 72 ore, poiché la dimissione viene
fatta in III° giornata di vita; i neonati che necessitano di
supporto ventilatorio meccanico o di interventi chirurgici o
cardiochirurgici vengono inviati alle Terapie Intensive Neonatali di
Treviso e Padova, mentre i neonati che necessitano di terapia
sub-intensiva sono ricoverati nella Sezione di Patologia Neonatale di
Castelfranco.
Il Nido è
gestito con la tecnica del “rooming-in”. Le madri, quando lo
desiderano, possono attaccare al seno il neonato o accudirlo;
vigilatrici d'infanzia, puericultrici o infermiere professionali
accompagnano le neo-madri nel cammino di conoscenza e gestione del
loro bambino. Lo screening uditivo viene somministrato, dopo la
24esima ora di vita, durante il periodo di sonno spontaneo del
neonato, mentre riposa nella culla accanto alla madre, dal personale
paramedico operante nel Nido. Il test viene somministrato con un
apparecchiatura portatile automatica, Echoscreen, prodotta dalla
ditta Madsen, facilmente trasportabile in una valigetta 24 ore,
costituita da un apparato di registrazione “pocket” e da una
sonda munita di tips riutilizzabili dopo disinfezione, che
viene applicata nel condotto uditivo esterno del neonato.
La durata
dell'esame è, per entrambe le orecchie, di circa tre minuti,
e la risposta è costituita da due semplici possibilità:
PASS, che indica una risposta TOAE normale e dunque l'assenza di
deficit uditivi cocleari importanti; REFER, che indica invece
l'assenza o l'anormalità dell'emissione otoacustica, che
a sua volta potrebbe avere diversi significati. Le cause potrebbero
essere rappresentate dal collabimento del condotto uditivo esterno, o
dalla presenza di liquido amniotico nel condotto, dal mascheramento
da parte di rumori prodotti dal neonato oppure da un sospetto deficit
uditivo. In caso di risposta ‘REFER' il neonato viene
ulteriormente sottoposto allo screening dal personale paramedico
nelle ore successive, fino al momento della dimissione dal Nido; in
genere si rende necessario effettuare una seconda applicazione del
test delle TOAE in un neonato su tredici (7,6%).
Nel caso
di riconferma del dato REFER il neonato verrà avviato nei
giorni successivi, con un appuntamento fissato al momento della
dimissione e comunicato ai genitori attraverso il Libretto Sanitario
Regionale, ad un "II° livello" nel quale un
medico della U.O. di Pediatria di Castelfranco eseguirà
la visita ORL, il timpanogramma e le TEOAE con lo stesso apparecchio
utilizzato al Nido.
Un
decisivo sospetto determinerà l'invio del neonato al Centro di
Audiologia Infantile di Padova per l'esecuzione di una visita
audiologica completa associata all'esecuzione dei potenziali
evocati uditivi del tronco. La presenza di perdita uditiva permanente
fa sì che il bambino riceva nella stessa sede anche una
valutazione eziopatogenetica (comprensiva di analisi
genetico-molecolare), le indicazioni per la protesizzazione acustica
e che sia pronto per la riabilitazione uditiva e l'appoggio alla
famiglia presso il territorio di appartenenza entro i primi
cinque-sei mesi di vita.
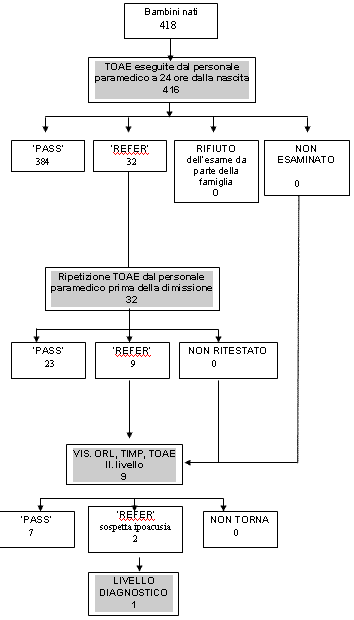
Fino ad
ora presso il nostro Nido sono stati sottoposti a screening uditivo
416 neonati, il 99,5 % dei nati da ottobre 2000. Gli unici 2 neonati
non testati erano stati trasferiti in Centri di Terapia Intensiva
Neonatale. La quota dei REFERindagine di II° Livello è
stata del 2,16% (9/416) se si considera i REFER sia
monolaterali che bilaterali, mentre è risultata uguale allo
0,72% (3/416) se si considera un REFER bilaterale.
Degli
afferenti al II° livello 2 neonati dei 9 inviati hanno
riconfermato la risposta REFER, uno di essi aveva un' otite media
con effusione e ad un successivo controllo è risultato PASS,
mentre l'altro neonato è stato inviato alla valutazione
audiologica infantile dove è stata confermata la presenza di
un deficit uditivo bilaterale neurosensoriale severo tramite la
valutazione audiologica comprensiva di potenziali evocati uditivi del
tronco. In seguito a indagine anche genetica molecolare,
quest'ultimo neonato ha evidenziato la presenza della
mutazione del gene codificante per la Connessina 26, uno dei geni
ritenuti responsabili della maggior parte delle ipoacusie genetiche
preverbali (17). La tabella 2 riassume i dati.
Le
informazioni sulle caratteristiche e la metodica dello screening
uditivo vengono fornite ai genitori dei neonati attraverso un
foglietto illustrativo nel quale viene altresì raccomandato di
seguire lo sviluppo linguistico del bambino tramite la valutazione di
abilità definite nel Libretto Sanitario della Regione Veneto.
I
costi
L'apparecchio
TEOAE ha un costo di circa € 5.000. Lo screening è condotto
da personale paramedico già operante nel Nido nei tempi morti
che sono presenti in un qualsiasi reparto ospedaliero. Il II°
livello è realizzato da un medico che, all'interno
dell'ambulatorio ORL pediatrico già strutturato, controlla i
REFER, esegue il timpanogramma e ripete le emissioni
otoacustiche dopo una visita ed un'otoscopia e la prestazione è
considerata come proseguo di ricovero. Lo strumento e la necessità
di un sistema di raccolta dati con possibilità di analisi
statistiche (€ 1.500), entrambi valutati per un periodo di
ammortamento di tre anni, determinano un costo del test di circa €
1,8 per bambino, se si considera un'attesa di 1200 nascite annue.
Volendo
aggiungere anche le spese del foglio informativo alla famiglia, le
spese di segreteria e il rinnovo del set dei tip auricolari, si
arriva ad un massimo di € 2 per bambino con un costo annuo del
progetto di circa € 2.400. E' immediatamente percettibile il
fatto che, in assenza di costi del personale, lo screening neonatale
risulti particolarmente economico. Con una prevalenza di ipoacusia
attesa uguale a 1-2 bambini su mille, ogni bambino identificato costa
da 1.200 a 2.400 euro.
Conclusioni
Uno
screening sanitario è giustificato in caso di patologie che
provochino gravi disabilità nelle persone affette ma che, se
identificate in tempi precoci, possano essere curate o trattate in
modo da eliminarne o mitigarne le conseguenze. La patologia deve
inoltre avere una prevalenza non trascurabile e la possibilità
di essere identificata attraverso un test veloce, affidabile,
accettabile da coloro che lo ricevono e riproducibile da operatori
diversi.
Gli
obiettivi di uno screening sono dunque quelli di identificare
precocemente i soggetti affetti al fine di avviare immediatamente un
trattamento in grado di eliminare o limitare i danni conseguenti alla
patologia.
Mentre è
ormai ubiquitariamente accettata l'importanza di attivare programmi
di prevenzione dell'ipoacusia infantile, molti ospedali mantengono
delle perplessità sulla necessità e la fattibilità
di uno screening universale ai nidi. Tali perplessità sono
principalmente dovute ai costi, all'elevato numero di ‘REFER'
citato da certi Autori che sovraccaricherebbe un secondo livello
diagnostico, favorendo la perdita dei bambini sospetti e aumentando
l'ansia delle famiglie.
Una delle
caratteristiche dello screening uditivo universale dev'essere
dunque quello di minimizzare il numero dei bambini REFER, i falsi
positivi, la grande maggioranza dei quali risulterebbe comunque
normoudente, mantenendo però elevata la sensibilità
dello screening. Un elevato numero di falsi allarmi infatti aumenta
il costo dello screening e provoca notevole stress nella
famiglia, in particolar modo se viene ad essa richiesto di spostarsi
presso altre strutture. Nel caso della nostra organizzazione la
possibilità di fare un re-screen prima della dimissione e di
seguire i bambini fino all'eventuale valutazione diagnostica
favorisce l'adesione alla situazione da parte della famiglia.
Siamo
convinti che lo screening uditivo neonatale universale, eseguito con
le emissioni otoacustiche possa essere ormai inteso come strumento
importante, valido, efficace in termini di costi e prossimo a
diventare procedura standard del ‘care' neonatologico, con
l'obiettivo di una diagnosi precocissima, ed un'impostazione
terapeutica di sviluppo anziché di terapia degli esiti della
sordità (20).
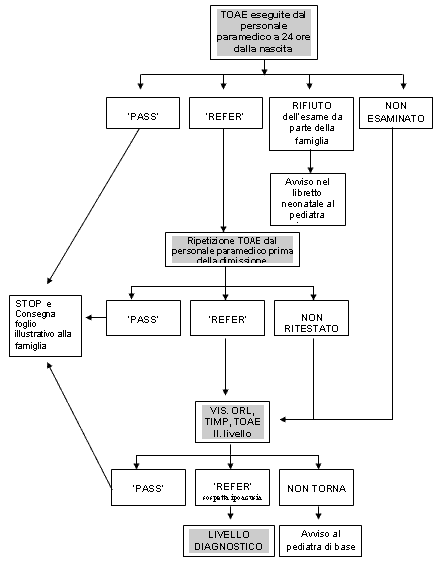 Figura
1 Figura
1Diagramma
di flusso del protocollo di screening uditivo neonatale adottato
presso il Nido dell'Ospedale di Castelfranco Veneto.
|
Stesso
diagramma di flusso della figura precedente con il percorso dei
primi 416 neonati esaminati. L'esclusione dei 2 neonati
iniziali e dovuta al trasferimento presso un reparto di terapia
neonatale intensiva di due bambini. L'esecuzione dello
screening uditivo è in questo caso a carico della
struttura di terapia intensiva.
Dei
finali due neonati refer anche al secondo livello, uno aveva
un'otite media con effusione poi guarita senza il bisogno di
invio ad un centro specialistico mentre uno è stato
inviato a Padova, al Centro multidisciplinare per l'ipoacusia
infantile con successiva diagnosi di ipoacusia neurosensoriale di
grado severo.
|
Bibliografia
1.Norhern
J, Downs M. 1991, Hearing in children 4th ed, Thieme Med Publishers.
2.Williams
& Wilkins, Baltimore, R Roesers 1995, Auditory disorders in
school children, 3rd ed, Thieme Med Publishers.
3.Blair
JC, Peterson MD, Viehweg SH. The effect of mild hearing loss on
academic performance of young children. Volta Rev 1985;87:87-93.
4.Teele
DW, Klein JO, Rosner BA, The Greater Boston otitis media Study Group.
Otitis with effusion during the first three years of life and
development of speech and language.Pediatrics 1984;74:282-287.
5.Fortnum
H, Davis A. Epidemiology of permanent childhood hearing imasirment in
the Trent region 1985-1993. Br J Audiol 1997,31: 409-46.
6.NIH
Joint committee on Infant Hearing,1994, Position Statement.
Pediatrics 1994;95:152-156.
7.Vohr
BR, Wright LL, Kaplan MD. Neurodevelopmental and Functional Outcomes
of Extremely Low Birth Weight Infants in the National Institute of
Child Health and Human Development Neonatal Research Network,
1993-1994. Pediatrics 2000;105:1216-1226.
8.Ruben
RJ, Rapin I. Plasticity of the developing auditory system. Ann Otol
Rhinol Laryngol 1980;89:303-11
9.Mason
JA, Hermann KR. Universal infant hearing screening by automated
auditory brainstem response measurement. Pediatrics 1998;101:221-228.
10.Norton
SJ, Gorga MP, Widen JE et al. Identification of Neonatal Hearing
Impairment: Evaluation of Transient Evoked Ototacustic Emission
Distortion Product, Otoacustic Emission and Auditory Brainstem
Response Test Performance during the Perinatal Period. Ear and
Hearing 2000;21(5):508-528.
11.Yoshinaga
Itano C, Sedey AL, Coulter DK. Mehl AI. Language of early and later
identified children with hearing loss. Pediatrics 1998:102;1161-1171.
13.Newborn
Infants Hearing Screening. Pediatrics 1998;101:p. elet. 4.
14.Task
Force on Newborn and Infant Hearing. Pediatrics 1999;103:527-529.
15.Jacobson
JT, Moorehouse CR. A comparison of auditory brainstem response and
behavioural screening in high risk and normal newborn infants. Ear
Hear 1984;5:247-53
16.Watkin
PM, Bladwin M. Neonatal at risk screening and the identification of
deafness. Arch Dis Child. 1991;66:1130-1135.
17.Smyth
V. Otoacustic emission criteria for neonatal hearing screening. Int.
J Pediatric Otor. 1999;48:9-15.
18.Norton
SJ, Gorga MP, Fletcher KA et al. Identification of Neonatal Hearing
Impairment: Transient Evoked Otoacustic Emissions during the
Perinatal Period. Ear& Hearing 2000;21:425-442.
19.Orzan
E, Polli R, Martella M, Vinanzi C, Leonardi M, Murgia A. Molecular
genetics applied to clinical practice: the Cx26 hearing impairment.
Br J Audiol, 1999;33:291-95
20.Orzan
E, Bonaconsa A, Giacomelli C, Turato R, De Benedittis M,
De Santi R, Turrini M, Babighian G. La protesizzazione
acustica delle ipoacusie infantili severe e profonde. Acta
Pediatrica, 2001, in press
Vuoi citare questo contributo?

 #I#Figura
2#/I
#I#Figura
2#/I