Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Ottobre 2009 - Volume XII - numero 8
M&B Pagine Elettroniche
Pediatria per l'ospedale
La
sclerodermia (seconda parte)
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza: bartolozzi@unifi.it
La
sclerodermia fa parte delle malattie reumatologiche, insieme
all'artrite reumatoide, al lupus eritematoso sistemico, alla
dermatomiosite e a tante altre. È relativamente rara in età
pediatrica, nella quale predomina la forma limitata alla cute. La
malattia presenta spesso notevoli difficoltà diagnostiche,
anche perché è poco conosciuta nei suoi aspetti
fondamentali.
Di
recente sul NEJM ne è comparsa una revisione completa,
eseguita da due Autori italiani (dell'Università di
Ancona il primo e dell'Università di Napoli il secondo),
e da un tedesco dell'Università di Colonia, (Gabrielli
A, Avvedimento EV, Krieg T. Sclerodermia. N Engl J Med
2009;360:1989-2003): un clinico medico, un ricercatore e un
dermatologo, a testimonianza dei diversi aspetti della malattia e
della sua multidiscipinarietà. Vengono affrontati i meccanismi
che sono alla base della sclerodermia.
Vai alla
prima
parte.
Ossigeno
reattivo
Alti
livelli di ossigeno reattivo e di stress ossidativo sono stati
direttamente o indirettamente implicati nella sclerodermia. In quasi
tutte le malattie infiammatorie l'aumento dei livelli di
ossigeno reattivo cellulare è una diretta conseguenza
dell'attivazione delle cellule ematiche mononucleate. Nella
sclerodermia gli alti livelli di ossigeno reattivo nelle cellule
mesenchimali sono relativamente indipendenti dallo stato
infiammatorio; essi persistono in vitro in assenza di fattori di
crescita e di citochine, rendono le cellule sensibili allo stress e
inducono il danno del DNA. La sorgente dell'ossigeno reattivo è
il sistema NADPH ossidasi della membrana, che è stimolato in
tutti i tipi cellulari entro o intorno alla parete dei vasi, in
risposta al danno. D'altra parte i radicali liberi hanno un
diretto effetto fibrogenetico sui fibroblasti e contribuiscono alla
liberazione dei mediatori, implicati nella fibrosi.
Il
sistema immune, lo stress ossidativo e la fibrosi
Non sono
chiare la gerarchia e la rilevanza delle cellule e dei mediatori
solubil nella patogenesi della sclerodermia.
Non
conosciamo l'evento primitivo scatenante. È
probabilmente un processo autoimmune diretto verso le cellule
mesenchimali. Qualunque sia lo scatenamento primario, a livello
cellulare, un leggero aumento dello stress ossidativo determina nella
malattia un precoce stress ossidativo che coincide con le alterazioni
delle cellule endoteliali e con un'iniziale infiammazione
perivascolare. Queste alterazioni sono di lieve entità e sono
responsabili di una fine disfunzione vascolare che non è
clinicamente manifesta (vedi Figura 4A).
Livelli bassi e persistenti di superossido, convertito in acqua
ossigenata, possono superare le membrane lipidiche. Alti livelli di
perossido in una singola cellula sono inoltre sufficienti per
attivare le vicine cellule normali e per generare un focolaio
infiammatorio che libera un gran numero di mediatori (Figura
4). Bassi livelli di ossigeno reattivo sono responsabili
dell'abbassamento dell'attività dei proteosomi
nelle cellule primitive, simulando il lento declino dell'attività
dei proteosomi nelle cellule senescenti.
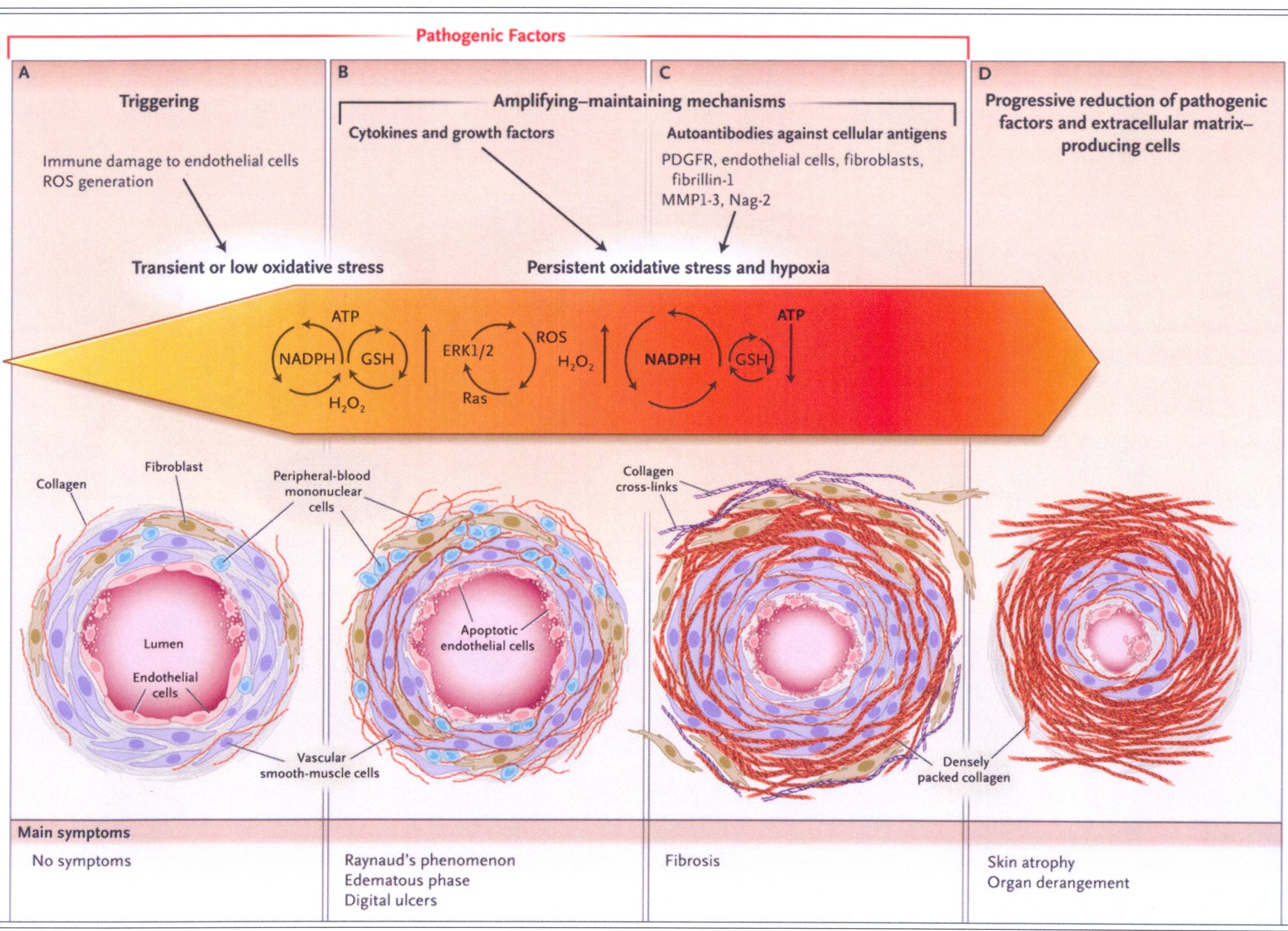
Come
si vede nella parte A (a sinistra nella figura) la lesione
microvascolare è un evento precoce nella patogenesi della
sclerodermia ed è caratterizzata dal danno della cellula
endoteliale, dalla proliferazione degli strati della lamina basale,
dall'intrappolamento delle cellule mononucleate del sangue
periferico nella parete dei vasi e dagli infiltrati iniziali
perivascolari da parte di cellule mononucleate. Le cellule
endoteliali mostrano i segni dell'aumento della morte
programmata. Uno o più agenti generanti ossigeno reattivo
possono essere responsabili di questo stadio.
Come
si vede nella parte B, la produzione non controllata di ROS (Reactive
Oxygen Species) attiva le cellule mesenchimali locali, inducendo la
chemiotassi, la proliferazione, la produzione di matrice
extracellulare e la liberazione di citochine e fattori di crescita,
che amplificano il focolaio infiammatorio. Un circuito autocrino
mantiene i ROS a livelli alti per il ridotto turnover dei recettori
delle citochine. Insorgono infine alterazioni strutturali e
funzionali dei vasi sanguigni e intravascolari, che si accompagnano a
evidenti sintomi clinici.
Come
si vede nella parte C della figura, lo stadio successivo è
dominato dalla fibrosi, alterazioni della struttura dei visceri,
rarefazione dei vasi sanguigni con conseguente ipossia, che
contribuisce al mantenimento della fibrosi. Come si vede nella parte
D, i meccanismi singoli o multipli, responsabili dell'attivazione
delle cellule mesenchimali, si attenuano o scompaiono o le cellule
mesenmchimasli stesse sottostanno alla senescenza o all'apoptosi:
a questo punto la malattia si attenua. Il quadro clinico è
dominato dall'insufficienza degli organi interni. La
stimolazione, l'amplificazione e i fattori di mantenimento non
necessariamente sono confinati a un singolo stadio. L'ambiente
e i fattori genetici possono influenzare la progressione della
malattia.
Molte
proteine vengono stabilizzate dall'alterata funzione dei
proteosomi e dall'aumento dei livelli di Ras ERK 1 e ERK 2
(proteinchinasi importanti nella proliferazione cellulare) nello
stato attivo. Anche l'ossidasi NADPH stimola la produzione di
ossigeno reattivo. Questi eventi determinano un'autoamplificazione
delle citochine e dei fattori di crescita: essi sono stati dimostrati
nei fibroblasti della sclerodermia. In condizioni normali
l'iperstimolazione dei recettori è prevenuta dalla
regolazione verso il basso dei recettori e dalla desensibilizzazione.
Nella sclerodermia il segnale iniziale è persistente e non è
soggetto a regolazione verso il basso perché è meno
intenso di quello presente in condizioni normali e perché è
continuo.
In vivo,
l'ossigeno reattivo può essere indotto e mantenuto nelle
cellule muscolari lisce dei vasi e nei fibroblasti dalla diffusione
del perossido d'idrogeno dai fibroblasti, dalla migrazione dei
monociti attraverso gli spazi fra le cellule endoteliali e
dall'esposizione degli anticorpi legati alla membrana dei
linfociti dagli specifici antigeni cellulari (vedi Figura
4 A). In questo contesto le cellule endoteliali possono
soccombere allo stress, indotto dall'ossigeno reattivo prodotto
dall'interazione dei linfociti e delle cellule mesenchimali,
mentre nella stessa area periciti, fibroblasti e cellule muscolari
lisce proliferano in maniera Ras dipendente portando a ispessimento
della parete dei vasi. Queste evento fondamentale determina ipossia
in condizioni di stress (per esempio il freddo) e di povertà
di ATP. In queste condizioni l'ossigeno reattivo non può
essere tamponato e può causare ulteriore danno alle cellule
endoteliali e ad attivazione delle cellule della muscolatura liscia
dei vasi, dei periciti e dei fibroblasti. Il processo è
ulteriormente amplificato dalla stabilizzazione non specifica di
molti recettori delle citochine da parte dell'ossigeno
reattivo.
Questo
passo probabilmente corrisponde al primo sintomo della sclerodermia.
Il fenomeno di Reynaud ricorrente può essere la diretta
conseguenza delle modificazioni strutturali dei vasi e dell'alterato
controllo del tono vascolare, dovuto dallo sbilanciamento fra
mediatori della vasodilatazione e della vasocostrizione. A questo
stadio il paziente può avere i primi segni di fibrosi cutanea
e viscerale (Figura
2 B).
Le
cellule mesenchimali divengono progressivamente ipersensibili alle
citochine, indotte dell'ossigeno reattivo locale. Le citochine
attivano i precursori delle cellule mesenchimali e portano alla
trasformazione dei fibroblasti in miofibroblasti.
La
continua sintesi del collageno e di altri componenti della matrice
extracellulare causa fibrosi della cute e dei visceri. Le profonde
alterazioni dell'architettura degli organi interni e le
importanti alterazioni microvascolari sono responsabili dell'ipossia
tissutale, che diviene il meccanismo principale del mantenimento
della produzione di ossigeno reattivo e dei processi fibrotici, che
avvengano attraverso alcuni meccanismi, indipendenti l'uno
dall'altro e indipendenti dal fattore isoforme 1α,
indotto dall'ipossia (Figura 4C).
Quando la
reazione infiammatoria si attenua, la malattia scompare. A questo
punto l'atrofia rimane l'aspetto dermatologico
principale, mentre l'estensione della sofferenza degli organi
interni determina la prognosi finale (Figura 4D).
Il rimodellamento di lungo periodo, che modifica i profili delle
metalloproteinasi della matrice e stimola i linfociti T, può
risolvere la fibrosi tissutale.
Conclusioni
Molti
aspetti della patogenesi della sclerodemia devono essere ancora
chiariti. I profili di trascrizione hanno messo in evidenza aspetti
tipici della malattia, che sono gli stessi sia delle aree colpite che
delle aree non colpite. La maggioranza dei geni può essere
indotta dalla TGF-β, dai Ras, dall'ossigeno reattivo; è
stata trovata un'ansa che lega i recettori della
tirosin-chinasi (Ras, ossigeno reattivo ed ERK1/2) con i recettori
del TGF-β e del CTGF. Questi circuiti attivano i fibroblasti.
L'inibizione
specifica delle vie di segnalazione da parte degli inibitori della
tirosin chinasi, come il PDGFR, gli inibitori della treonin chinasi,
come i recettori del TGF-β, e gli inibitori della farnesil
transferasi, come il Ras, possono interferire con la malattia. Se gli
autoanticorpi cessano di essere di rilevanza funzionale in alcuni
pazienti, può essere possibile intraprendere prove con
anticorpi contro le cellule B. L'identificazione di indicatori
della gravità della malattia, come gli aspetti di
trascrizione, l'ossigeno reattivo cellulare, le indicazioni del
danno del DNA e i livelli di collageno e l'actina del muscolo
liscio nei monociti periferici o nei fibroblasti, saranno basilari
per lo sviluppo di terapie specifiche, a seconda degli aspetti della
malattia e del loro stadio e per l'identificazione degli
obiettivi finali ben definiti per intraprendere delle prove cliniche.
Il lavoro
è corredato di 103 voci bibliografiche.
Vuoi citare questo contributo?
