Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Settembre 2009 - Volume XII - numero 7
M&B Pagine Elettroniche
Pediatria per l'ospedale
La
sclerodermia (prima parte)
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza: bartolozzi@unifi.it
La
sclerodermia fa parte delle malattie reumatologiche,
insieme all’artrite reumatoide, al lupus eritematoso sistemico,
alla dermatomiosite e a tante altre. E’ relativamente rara in
età pediatrica, nella quale predomina la forma limitata alla
cute. La malattia presenta spesso notevoli difficoltà
diagnostiche, anche perché è poco conosciuta nei suoi
aspetti fondamentali.
Di
recente sul NEJM ne è comparsa una revisione completa,
eseguita da due autori Italiani (dell’Università di
Ancona il primo e dell’Università di Napoli il secondo),
e da un autore tedesco dell’Università di Colonia,
(Gabrielli A, Avvedimento EV, Krieg T. Sclerodermia. N Engl J Med
2009;360:1989-2003) : un clinico medico, un ricercatore e un
dermatologo, a testimonianza dei diversi aspetti della malattia e
della sua multidiscipinarietà. Penso possa essere utile
percorrere insieme i vari aspetti della malattia, con riferimento
particolare ai meccanismi che ne sono alla base.
La
sclerodermia (“scleroderma” per gli anglosassoni) è
una malattia complessa, caratterizzata da 3 componenti essenziali:
- Estesa fibrosi
- Alterazioni vascolari
- Autoanticorpi verso numerosi antigeni cellulari (vedi Figura 1 e Figura 2).
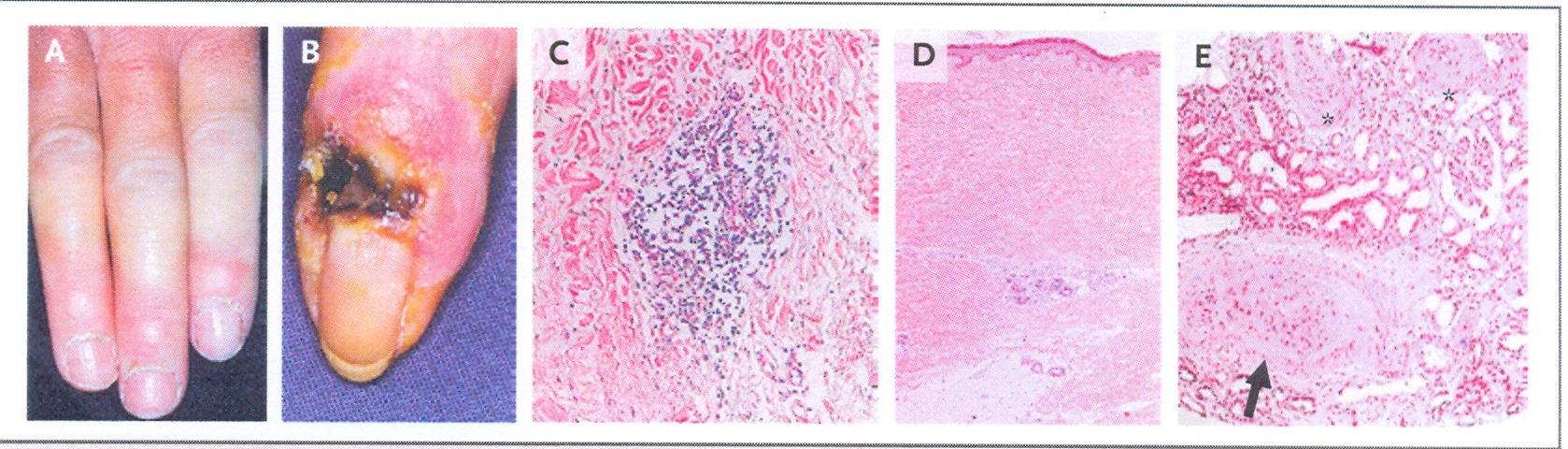
Nella
figura A si nota l’ipercheratosi delle pieghe ungueali di un
paziente in fase edematosa di una sclerodermia cutanea limitata. La
figura B mostra un’ulcerazione sulla punta di un dito in un
paziente con una limitata sclerodermia cutanea. La figura C mostra
un’infiltrato linfo-istiocitario intorno a un vaso sanguigno in
un frammento di cute (colorazione ematossilina eosina). Nella figura
D una biopsia cutanea di un paziente, con una forma diffusa iniziale
di sclerodermia, mostra un’intensa deposizione di matrice
collagena nel derma, che si estende fino al grasso sottocutaneo
(colorazione ematossilina cosina). La figura E mostra un ispessimento
dell’intima e della media di un’arteria interlobare
(freccia) e di due arterie arcuate (asterisco) nel rene di un
paziente con sclerodermia. Il glomerulo è parzialmente
collassato e l’epitelio tubulare è atrofico. E’
presente fibrosi con infiltrazione di cellule mononucleate
nell’interstizio (colorazione ematossilina cosina).
Nella
sclerodermia sono riconosciuti due fondamentali sottogruppi:
- Sclerodermia cutanea limitata, nella quale la fibrosi è limitata essenzialmente alle mani, alle braccia e alla faccia; il fenomeno di Raynaud è presente da molti anni, prima della fibrosi; è frequente un’ipertensione polmonare e si ritrovano anticorpi anticentromero nel 50-90% dei pazienti;
- Sclerodermia cutanea diffusa, un’affezione rapidamente progressiva che colpisce larghe aree della cute e comprende uno o più organi interni.
Gli
Autori pensano che l’acronimo CREST (calcinosi + Reynaud
fenomeno + esofagea alterata motilità + sclerodattilia +
teleangectasia) sia da abbandonare, perché non indica il
complesso dell’interessamento cutaneo e degli organi interni:
rare volte i pazienti con sclerodermia non hanno interessamento
cutaneo.
A volte è
presente una sindrome da sovrammissione di sclerodermia, lupus
eritematoso sistemico, artrite reumatoide, polimiosite e sindrome di
Sjogren.
Nessuna
delle classificazioni proposte riflette a sufficienza l’eterogeicità
delle manifestazioni cliniche della sclerodermia.
E’
questa la ragione principale delle riconosciute difficoltà
diagnostiche, e della multidisciplinarietà.
A.
Autoanticorpi
classici |
Aspetti
clinici |
Nuovi
autoanticorpi |
Ruolo |
Anti-topoisomerasi
I |
Sclerodermia
cutanea diffusa |
Cellula
endoteliale |
Induce
apoptosi delle cellule endoteliali |
Proteine
anticentromero |
Sclerodermia
cutanea limitata |
Anti-FBN
1 |
Attivazione
dei fibroblasti umani normali |
Polimerasi
I/II anti-RNA |
Sclerodermia
cutanea diffusa, interessamento renale |
Anti-MMP
1 e 3 |
Previene
la degradazione delle proteine ECM |
Antipolimiosite,
sclerosi |
Poliomiosite,
calcinosi |
Anti-PDGFR |
Stimola
i fibroblasti umani normali, attraverso Ha-Ras-ERK 1/2-ROS |
Antifibrillarina
(U3RNP) |
Sclerodermia
cutanea diffusa, interessamento degli organi interni |
Anti-Nag-2 |
Induce
apoptosi delle cellule endoteliali |
Anti-Th/To |
Sclerodermia
cutanea limitata, fibrosi polmonare |
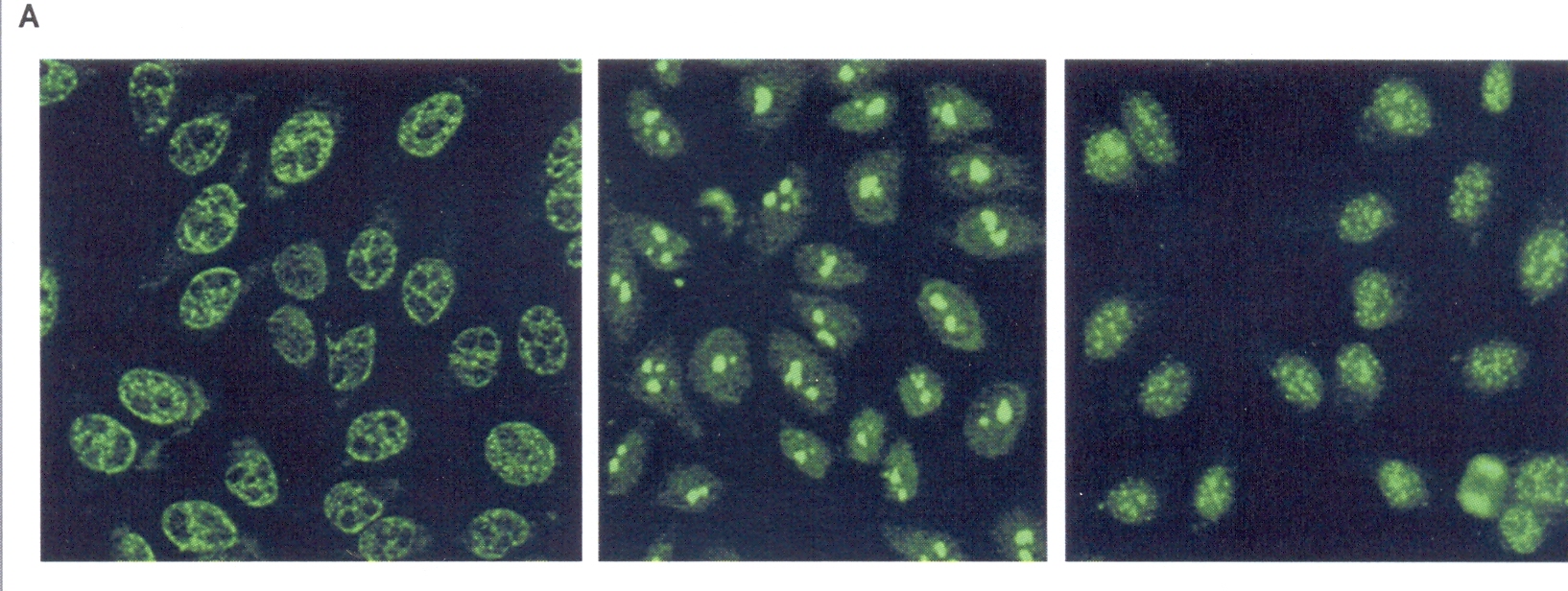
La figura
2 (parte A) a sinistra mostra la colorazione degli anticorpi
antinucleo. Questo quadro di colorazione nucleare punteggiata si
ritrova nel 30% dei pazienti con sclerodermia diffusa e suggerisce la
presenza di anticorpi anti-topoisomerasi I. La colorazione omogenea
del nucleo si ritrova nella figura al centro nel 25-50% dei pazienti
con sindrome sovrapposta miosite-sclerodermia. Una colorazione
omogenea che interessi il nucleolo (non presente nelle figure) si
ritrova in modo specifico nella sclerodermia diffusa (5% dei
pazienti). Gli antigeni nucleolari sono l’RNA polimerasi, la
fibrillina, Th/TO o pm-scl. Il quadro di colorazione
anticorpo-anticentromero (parte destra) può essere associato a
ipertensione polmonare: 70-80% dei pazienti con sclerodermia cutanea
limitata. Gli antigeni sono proteine cinetocore delle regione dei
centromeri dei cromosomi. La parte B della
Figura 2 mostra gli autoanticorpi classici e scoperti da poco della
sclerodermia. ECM indica la matrice proteica extracellulare. ERK ½
indica la chinasi 1, regolatrice del segnale extracellulare: FBN-1
indica la fibrillino 1. MMP 1 e 3 della matrice sono delle
metalloproteinasi 1 e 3. Nag-2 indica il gene attivato dai farmaci
non-steroidei anti-infiammatiri. PDGFR indica il recettore del
fattore di crescita delle piastrine; ROS = specie reattive
all’ossigeno.
La
sclerodermia può portare a gravi disfunzioni e ad
insufficienze di quasi tutti gli organi interni. Esiste comunque una
grande eterogeinicità, come si vede nella Tabella
1. L’interessamento dei visceri è il fattore
principale nel determinare la prognosi. I reni, l’esofago, il
cuore e i polmoni sono i più colpiti. L’interessamento
renale può essere controllato con l’uso degli inibitori
dell’enzima convertente. La disfunzione esofagea, fortemente
debilitante, è la complicazione viscerale più comune e
l’interessamento polmonare è la causa principale di
morte.
I
meccanismi che stanno alla base dell’interessamento viscerale
non sono chiari, nonostante i progressi ottenuti nel trattamento di
queste complicazioni.
Reperto |
Sclerodermia
cutanea diffusa |
Sclerodermia
cutanea limitata | ||||||
Stati
Uniti
(n.
119) |
Francia
(n.
30) |
Germania
(n.
484) |
Italia
(n.
177) |
Stati
Uniti
(n.
128) |
Francia
(n.
97) |
Germania
(n.
674) |
Italia
(n.
565) | |
Percentuale
di pazienti |
Percentuale
di pazienti | |||||||
Calcinosi |
23 |
16 |
Non
rilevato |
20 |
42 |
36 |
Non
rilevato |
22 |
Fenomeno
di Raynaud |
97 |
100 |
94,2 |
94 |
99 |
99 |
96,3 |
96 |
Interessamento
articolare |
98 |
70 |
56,6++ |
22 |
78 |
65 |
44,9++ |
16 |
Dismotilità
esofagea |
67 |
79 |
69,3 |
69 |
67 |
63 |
59,2 |
55 |
Fibrosi
polmonare |
30 |
57 |
56,1 |
71+++ |
37 |
30 |
20,8 |
53+++ |
Ipertensione
art. polmonare
isolata |
2 |
12 |
27,7 |
Non
rilevata |
31 |
9 |
60 |
Non
rilevata |
Interessamento
cardiaco |
11§ |
10§ |
23§§ |
32§§§ |
19§ |
14§ |
12§§ |
23§§§ |
Ridotto
LVEF# |
20° |
15° |
Non
rilevato |
Non
rilevato |
6° |
12°° |
Non
rilevato |
Non
rilevato |
Crisi
renali |
17 |
7 |
15,9 |
12 |
2 |
0 |
9,1 |
6 |
+Lo
studio italiano comprende un terzo gruppo di pazienti che avrebbero
una forma intermedia di sclerodermia cutanea: questi dati non sono
riportati in tabella
++Questo
gruppo include pazienti con interessamento muscolare e articolare
+++Questo
valore include pazienti che hanno ipertensione polmonare isolata
§
In questo gruppo l’interessamento cardiaco viene definito come
la presenza di aritmia, che richiede trattamento
§§
Questo valore include pazienti con uno dei seguenti quadri:
palpitazione, disturbi della conduzione, disfunzione della diastole
§§§
Questo valore include pazienti con uno dei seguenti quadri:
pericardite, insufficienza cardiaca congestizia, grave aritmia o
disturbi della conduzione
°
Il LVEF (frazione di eiezione del ventricolo sinistro) è
inferiore al 50% all’ecocardiografia o è presente una
disfunzione diastolica
Epidemiologia
e predisposizione genetica
Gli studi
di prevalenza e d’incidenza della sclerodermia sono
contraddittori, sia per le variazioni metodologiche sia per le
differenze geografiche.
I dati
disponibili indicano una prevalenza da 50 a 300 casi/1 milione di
persone e un’incidenza da 2,3 a 22,8 casi per milione di
persone per anno. Le donne sono a rischio di sclerodermia più
degli uomini, con un rapporto da 3:1 a 14:1. Fra i neri c’è
un lieve aumento della suscettibilità. La concentrazione nelle
famiglie, l’alta frequenza di altre malattie autoimmunitarie
(nel nucleo familiare), la differenza dei fenotipi a seconda dei
gruppi etnici, tutto suggerisce che fattori genetici contribuiscano
alla sclerodermia. C’è una forte evidenza di un legame
fra alcune molecole HLA di classe II con fenotipi clinici e
particolari autoanticorpi. Tutto concorre a far ritenere che la
sclerodermia non sia una malattia ben definita, ma una sindrome che
comprende vari fenotipi.
Componenti
ambientali (come virus, farmaci, cloruro di vinile e silicio) possono
indurre fenotipi clinici, che sono simili o identici alla
sclerodermia. Molte descrizioni indicano che, durante la gravidanza,
i linfociti fetali e materni possono attraversare la placenta e
iniziare una reazione trapianto contro ospite che culmina nella
sclerodermia. Ci sono somiglianze cliniche, sierologiche e
isto-patologiche fra sclerodermia e malattia trapianto contro ospite:
cellule allogeniche sono state trovate nel sangue periferico e in
biopsie cutanee, ottenute da pazienti con sclerodermia. Mancano
tuttavia prove certe che queste cellule partecipino alla patogenesi
della sclerodermia.
Lesioni
precoci e tardive
Lesioni
vascolari sono un evento precoce nella sclerodermia.
Alterazioni
precoci vascolari e infiammatorie
Esse
precedono la fibrosi e interessano i piccoli vasi, particolarmente le
arteriole. Le lesioni vascolari, che interessano virtualmente tutti
gli organi, consistono di ampie aperture fra le cellule endoteliali,
perdita d’integrità del rivestimento endoteliale e
vacuolizzazione del citoplasma delle cellule endoteliali. Ci sono
inoltre molti strati laminari, infiltrati perivascolari di cellule
immunitarie mononucleate (con rari linfociti) nella parete dei vasi,
lesioni ostruttive microvascolari e rarefazione dei capillari. Una
notevole povertà dei piccoli vasi è un aspetto
caratteristico degli ultimi stadi della sclerodermia.
Esiste un
difetto nella vasculogenesi, nonostante la perdita progressiva dei
vasi sanguigni e gli alti livelli del fattore di crescita degli
endoteli vascolari, causati dalla risposta adattiva all’iposia.
Il perché di questo paradosso non è chiaro. Citochine
infiammatorie, come il tumor necrosis factor α, possono
stimolare e inibire l’angiogenesi, a seconda della durata dello
stimolo.
Fibrosi
La
fibrosi gradualmente rimpiazza la fase infiammatoria della
sclerodermia e rompe l’architettura del tessuto colpito. Essa è
la causa dei principali sintomi della malattia. La fibrosi cutanea
inizia dagli strati più profondi del derma e più
superficiali del sottocutaneo; essa avviene contemporaneamente alle
lesioni dei microvasi, alla riduzione delle appendici e alla perdita
delle strutture reticolari della rete. La composizione della matrice
accumulata varia con lo stadio della malattia. Una mescolanza di
diversi tipi di collagene, proteoglicani e fibre elastiche, compresa
la fibrillina, sono tipici dei primi stadi, mentre il collagene tipo
I si accumula negli stadi tardivi.
Tipi
cellulari nelle lesioni
Cellule
endoteliali
Le
cellule endoteliali sono colpite per prime nella sclerodermia. Nelle
lesioni precoci c’è una apoptosi delle cellule
endoteliali o cambiamenti del fenotipo endoteliale in assenza di
proliferazione endoteliale o di differenziazione dei precursori. La
mobilitazione dei precursori endoteliali dal midollo osseo è
in relazione alla gravità della malattia. L’interazione
dei progenitori delle cellule endoteliali con le piastrine e con il
fattore di crescita, derivato-dalle piastrine (PDGF) è
essenziale per la maturazione e il reclutamento dei precursori
endoteliali. Lo spazio perivascolare è una sede preferita per
le lesioni precoci della sclerodermia. L’ispessimento
progressivo della parete e gli infiltrati perivascolari sono aspetti
delle lesioni vascolari in questo compartimento, indicando
l’interessamento delle cellule vascolari del muscolo liscio e
dei periciti.
Periciti
e cellule del muscolo liscio
I piccoli
vasi contengono cellule muscolari lisce e periciti. I periciti hanno
la potenzialità di differenziarsi in cellule della muscolatura
liscia dei vasi, fibroblasti, e miofibroblasti (cellule contrattili
specializzate, esprimenti α-actina del muscolo liscio e la
variante ED-A di aggancio della fibronectina) e d’influenzare
la proliferazione delle cellule endoteliali.
L’aumentato
spessore della parete vascolare, causato dalla proliferazione delle
cellule muscolari lisce dei vasi, indica che queste cellule stanno
rispondendo all’insulto che porta alla sclerodermia. I periciti
nelle lesioni iperesprimono numerosi recettori delle citochine,
incluso il recettore per il fattore di crescita, derivato-dalle
piastrine (PDGF), ma questo avviene solo nelle lesioni precoci e in
pazienti con fenomeno di Reynaud e anticorpi antinucleo. Queste
cellule proliferano e contribuiscono ad aumentare lo spessore della
parete. Complessivamente le modificazioni cellulari delle lesioni
precoci sono a danno delle cellule endoteliali, dei periciti
proliferanti, delle cellule muscolari lisce e delle cellule immuni
dello spazio perivascolare. Le cellule endoteliali sono il solo tipo
di cellule mesenchimali che è sottoposto alla apoptosi nella
sclerodermia precoce, mentre le cellule muscolari lisce e i periciti
proliferano vigorosamente.
Fibroblasti
I
fibroblasti concorrono alla produzione, deposizione e rimodellamento
del collageno e degli altri componenti della matrice extracellulare.
I fibroblasti nella sclerodermia sono eterogenei per quanto riguarda
la sintesi del collageno: l’iperproduzione del collageno è
dovuta all’aumentata trascrizione o alla aumentata stabilità
dell’RNA messaggero specifico del collageno. L’aumentata
trascrizione dei geni del collageno nelle cellule della sclerodermia
è autonoma e mantenuta in vitro da molti passaggi. I
fibroblasti nella sclerodermia possono convertirsi in miofibroblasti
e possono iperesprimere numerose citochine (cioè fattore di
crescita β trasformante (TGF-β), proteina 1 chemioattraente
i monociti) e recettori del fattore di crescita β trasformante
(TGF-β). Questi reperti sottolineano il ruolo delle anse
autocrine nel sostenere la reazione fibrotica. Inoltre i fibroblasti
in pazienti con sclerodermia contengono un eccesso di ossigeno
reattivo. L’origine dei fibroblasti attivati nella cute e negli
organi interni dei pazienti con sclerodermia è ancora oggetto
di dibattito. I fibroblasti possono essere sottoposti a
un’attivazione locale od originare dai periciti locali, dalle
cellule staminali mesenchimali o dalle cellule progenitrici (cioè
dai fibrociti), reclutati dalla circolazione.
Cellule
mononucleate
Gli
infiltrati cellulari nelle lesioni precoci della sclerodermia
consistono principalmente di cellule T, macrofagi, cellule B e
mastcellen. Le cellule T nelle lesioni cutanee sono soprattutto
cellule TCD4+: esse mostrano indicatori di attivazione ed espansione
monoclonale e sono soprattutto cellule T2 helper (Th2). Queste
caratteristiche sono parallele all’aumento dei livelli serici
delle citochine, derivate dalle cellule Th2. Nella cute si trovano
anche cellule CD20+, che possono contribuire alla patogenesi della
fibrosi, attraverso la secrezione d’interleuchina 6 e di TGF-β,
e la produzione di autoanticorpi.
Mediatori
solubili
Citochine
e fattori di crescita
Lo studio
dei profili di trascrizione del genoma dei campioni di cute, ottenuti
da pazienti con sclerodermia, hanno fornito delle prove dirette
sull’azione delle citochine nell’attivazione dei
fibroblasti.
TGF-β
La TGF-β
è una potente citochina profibrotica. Un gruppo di geni
TGF-β-dipendenti sono iperespressi nei campioni bioptici,
prelevati dalle lesioni della sclerodermia. Il TGF-β è
anche il più forte induttore dei miofibroblasti: esso modula
l’espressione dei recettori di diverse citochine, inclusi i
recettori per il TGF-β e il PDGR. Nei fibroblasti della
sclerodermia, il TGF-β stimola inoltre il fattore di crescita
del tessuto connettivo (CTGF), una proteina ricca di cisteina,
appartenente alla famiglia CCN del fattore di crescita della matrice
cellulare (CYR61, CTGF e NOV (nefroblastoma iperespresso)) che ha
attività biologiche simili a quelle del TGF-β. Il TGF-β
ha altre importanti caratteristiche, essenziali per la genesi della
sclerodermia.
PDGF
Il
fattore di crescita delle piastrine (PDGF), legato alla guarigione e
alla fibrosi delle piastrine, può avere un ruolo nella
sclerodermia. La presenza di anticorpi stimolatori il PDGF nel siero
di pazienti con sclerodermia, il forte stimolo del PDGF sul passaggio
da pericito a fibroblasti, la presenza di alti livelli di PDGF e del
suo recettore β nelle lesioni dei pazienti con sclerodermia, e i
benefici effetti degli inibitori selettivi del PDGF, tutto indica
l’importanza del PDGF nella sclerodermia. Infatti gli inibitori
del PDGF possono avere un effetto favorevole nella sclerodermia.
Altre
citochine e sostanze attive biologicamente
L’endotelina-1
agisce insieme al TGF-β nel convertire i fibroblasti in
miofibroblasti. L’effetto benefico degli inibitori del
recettore dell’endotelina-1 in pazienti con sclerodermia indica
che l’endotelina-1 è un importante molecola in questa
malattia. L’inibizione dell’endotelina può
attenuare l’iperstimolazione del TGF-β nella sclerodermia.
Molte altre citochine sono state implicate nella angiogenesi,
angiostasi, fibrosi e infiammazione localizzata nella sclerodermia. A
oggi non ci sono prove convincenti che colleghino i livelli e
l’attività di queste citochine con uno o più
eventi patologici in questa malattia (vedi Tabella
2).
Componenti
della matrice extracellulare e loro recettori
La
caratteristica della sclerodermia è l’eccessiva
deposizione dei componenti della matrice extracellulare, causata
dall’iperproduzione di collagene e di altre glicoproteine
(fibronectina e fibrillina). La disposizione macromolecolare del
collageno è alterata dai legami che si vedono normalmente
nelle ossa, ma non nella matrice del collageno della cute; questi
legami sono formati da lisil-idrossilasi 2, aumentata nella
sclerodermia.
Le
molecole della matrice extracellulare modulano le risposte cellulari
regolando l’attività delle citochine e dei fattori di
crescita. Ci sono molte prove che l’interferenza fra diverse
integrine e la molecole della matrice extracellulare determini
l’attivazione della maggior parte delle citochine e dei fattori
di crescita che interagiscono direttamente con le cellule bersaglio.
Complessivamente la matrice extracellulare alterata nella
sclerodermia determina un ambiente che amplifica l’attivazione
di cellule mediata dai recettori.
Autoanticorpi
La
sclerodermia è associata a molti anticorpi, alcuni dei quali
sono importanti come indicatori diagnostici. Le prove per gli
anticorpi contro la topoisomerasi I (Scl-70), le proteine associate
ai centromeri e gli antigeni nucleari possono essere utili nella
diagnosi e nel formulare la prognosi. Sebbene gli anticorpi si
correlino con la gravità della malattia e il rischio di
complicazioni organo-specifiche, la loro rilevanza patogenetica non è
chiara. Recentemente sono stati descritti autoanticorpi diretti verso
antigeni non nucleari (vedi Figura 2), inclusi
gli anticorpi contro antigeni della superficie cellulare. Gli
anticorpi con i recettori PDGF sembrano essere agonisti, perché
essi stimolano una specifica cascata di segnalazione. tuttavia la
specificità di questi autoanticorpi stimolatori rimane ancora
da essere stabilita. Lo stesso tipo di autoanticorpi diretti contro
il PDGF è stata trovata nelle immunoglobuline, ottenute dal
siero di pazienti con malattia trapianto contro ospite di tipo
sclerodermatoso; un significativo benefico effetto degli inibitori
del recettore PDGF è stato riportato in casi di malattia
trapianto contro ospite di tipo sclerodermatoso.
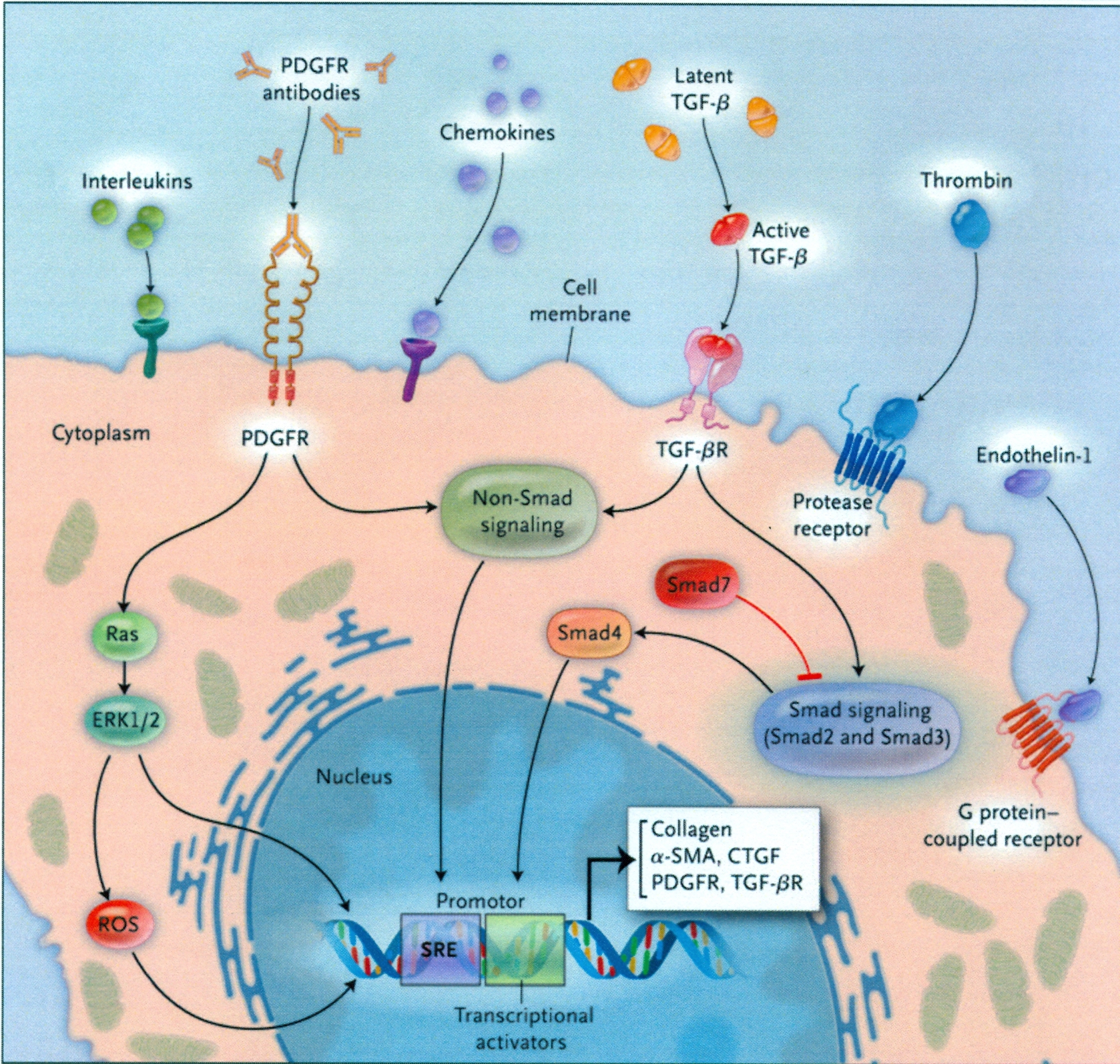
Figura
3. Attivazione dei fibroblasti nella sclerodermia.
Fattori
esterni, come le interleuchine, le chemochine, la trombina,
l’endotelina-1, i fattori di crescita, l’ossigeno
reattivo (ROS), e gli anticorpi attivanti provocano la cascata dei
fibroblasti. Per esempio, la fosforilazione dello Smad2 provoca la
cascata da Smag-3 a Smag-1, che interagisce con lo Smag 4 e regola la
trascrizione del gene nel nucleo. L’attivazione dei recettori
del fattore di crescita β trasformante (TGF- βR) porta
all’attivazione di vie che non interessano gli Smad e che
modulano i fattori di trascrizione. Queste vie s’intersecano
con le vie indotte dall’attivazione dei recettori del fattore
di crescita derivato dalle piastrine (PDGFR), che portano a una
complessa rete di segnalazione intracellulare. E’ stimolata la
produzione di proteina della matrice extracellulare, citoscheletro,
citochine e recettori delle citochine, che partecipano in molte anse
regolatorie all’attivazione prolungata dei fibroblasti. CTGF =
fattore di crescita del tessuto connettivo. ERK1/2 = chinasi 1 e 2
regolanti il segnale extracellulare, α-SMA, α-attina del
muscolo liscio ed elemento sierico SRE di risposta.
Tabella
2. Citochine, fattori di crescita e sostanze biologicamente
attive, interessate nella patogenesi della sclerodermia
Fattori |
Cellule
interessate |
Importanza
patogenetica |
Effetti
nella sclerodermia |
Interleuchina-1 |
Macrofagi,
monociti |
Ha
un ruolo nella produzione d’interleuchina 6 e di PDGF-α
da parte dei fibroblasti |
Soprattutto
espressa nei fibroblasti della cute |
Interleuchina
4 |
Linfociti
Th2 |
Stimola
la proliferazione di fibroblasti, la chemiotassi e la sintesi del
collageno; stimola la produzione di TGF-β, CTGF e TIMP-1<,
aumenta l’espressione delle molecole di adesione delle
cellule endoteliali |
Aumentati
livelli nel siero; aumento delle proteine e dell’espressione
dei geni nella cute e nei fibroblasti in
Cultura;
aumenta il numero dei linfociti T che producono interleuchina 4 |
Interleuchina
6 |
Fibroblasti,
macrofagi, cellule endoteliali, cellule B, cellule T |
Stimola
il collagene e la sintesi di TIMP-1; promuove una risposta immune
polarizzata sui Th2 |
Livelli
aumentati nei tessuti e nel siero; > produzione in vitro da
parte dei PBMC e dei fibroblasti in coltura |
Interleuchina
8 |
Macrofagi
alveolari, fibroblasti polmonari, fibroblasti della cute |
Serve
come potente chemoattrattivo e attivatore dei neutrofili; promuove
la chemiotassi dei fibroblasti |
Elevati
livelli nel siero, nella cute e nel liquido di lavaggio
bronco-alveolare |
Interleuchina
10 |
Cellule
B attivate, monociti |
Promuove
una risposta immune predominante Th2, che induce sintesi del
collageno |
Livelli
aumentati nel siero |
Interleuchina
13 |
Linfociti
Th2 |
Induce
fibrosi attraverso un meccanismo TGF-β-dipendente e
TGF-β-indipendente |
Livelli
aumentati nel siero |
Interleuchina
17 |
Linfociti
Th1 e Th2 |
Induce
proliferazione di fibroblasti; stimola i fibroblasti a produrre
collageno, interleuchina 6 e PDGF, stimolando i macrofagi a
produrre TNF-α e interleuchina 1; induce la produzione da
parte delle cellule endoteliali di interleuchina 1 e aumenta
l’espressione dell’interleuchina 6, ICAM-1 e VICAM-1 |
Livelli
aumentati nel siero; iperespressione nella cute |
TGF-β |
Macrofagi,
fibroblasti, cellule T, cellule B, piastrine, cellule endoteliali |
Induce
proliferazioni di fibroblasti e produzione di CTGF ed
endotelina-1; stimola la sintesi del collageno, fibronectina,
proteoglicani; inibisce la degradazione della matrice
extracellulare per la ricorra sintesi di MMP e l’induzione
di TIMP-1; stimola l’espressione dei recettori di TGF-β
e di PDGF |
Elevati
livelli di TβRI in vivo; elevati livelli di TGF-β nella
cute in alcuni sedi; elevata espressione ed elevati livelli di
fosforilazione di effettori Smad2 i Smad3 della via di
segnalazione TGF-β |
CTGF
(CCN2) |
Fibroblasti,
cellule endoteliali, cellule muscolari lisce |
Indotto
dal TGF-β, interleuchina 4 e VEGF; induce proliferazione
chemiotassi dei fibroblasti e stimola la produzione di matrice
extracellulare |
Livelli
elevati nel siero; aumentata espressione del gene nella cute e nei
fibroblasti in vitro |
TNF-α |
Macrofagi,
cellule T, cellule B, cellule endoteliali, fibroblasti, cellule
muscolari lisce dei vasi |
Stimola
risposte fibrotiche o antifibrotiche, dipendendo da condizioni
sperimentali |
Prognosi
contraddittoria in pazienti con sclerodermia trattati con
antagonista del TNF-α |
MPC-1 |
Macrofagi,
fibroblasti, cellule endoteliali |
Stimola
la produzione di collagene in parte attraverso il TGF-β;
regola la migrazione dei monociti e delle cellule Th2 |
Elevati
livelli nel siero; aumenta spontaneamente la produzione di PBMC;
aumenta l’espressione nelle lesioni cutanee. |
MCP-3 |
Cellule
mononucleate, fibroblasti cutanei |
Promuove
i movimenti dei leucociti; attiva il promotore del collageno
proa2(I)-gene reporter |
Aumenta
l’espressione nelle biopsie cutanee di pazienti con
sclerodermia iniziale e nelle culture di fibroblasti, ottenuti da
biopsie cutanee |
PDGF |
Piastrine,
macrofagi, cellule endoteliali, fibroblasti |
Serve
come mitogeno e chemioattraente per i fibroblasti; induce la
sintesi di collageno, fibronectina, proteoglicani; stimola la
secrezione di TGF-β tipo I, MCP-1, interleuchina-6 |
Eleva
l’espressione del PDGF e del PDGF nella cute; aumento i
livelli nei liquidi biologici con il lavaggio bronco alveolare |
Endotelina-1 |
Cellule
endoteliali, fibroblasti, cellule muscolari lisce. |
Attiva
le cellule muscolari lisce; induce la proliferazione e la
chemiotassi dei macrofagi e delle cellule muscolari lisce dei
vasi; differenzia i fibroblasti in mio fibroblasti; aumenta la
produzione della matrice extracellulare da parte dei fibroblasti |
Aumenta
i livelli nel siero e nei liquidi di lavaggio bronco alveolari;
aumenta l’espressione nei tessuti |
IGF-II |
Cellule
fetali |
Stimola
in vitro la produzione di collageno tipo I e fibronectina nei
fibroblasti polmonari di soggetti con sclerodermia |
Aumenta
il gene e l’espressione delle proteine nei fibroblasti
polmonari; aumenta l’immunocolorazione nella malattia
polmonare, legata alla sclerodermia |
Angiotensina
II |
Fibroblasti
cutanei |
Aumenta
la produzione di collageno tipo I |
Aumenta
i livelli nel siero, aumenta l’espressione del gene nelle
colture di fibroblasti; aumenta l’espressione nelle biopsie
cutanee di pazienti con sclerodermia cutanea limitata |
CCL2
= indica la chemochina legante 2; CTGF = fattore di crescita del
tessuto connettivo (conosciuto anche come CCN2); ICAM-1 = molecola 1
di adesione intracellulare; IGF-II = fattore II di crescita,
insulino-simile; MCP ! = proteina I chemoattraente mi monociti; MCP-3
= proteina 3 attraente i monociti; MMP = metallo proteinasi della
matrice; PBMC = cellule mononucleate del sangue periferico; PDGF =
fattore di crescita, derivato dalle piastrine; TβRI = fattore β
di crescita di trasformazione del recettore tipo I; Th1 = cellule T
helper, tipo I; Th2 = cellule T helper tipo 2; TIMP-1 = inibitore
tissutale dell’MMP 1; TNF-α = tumor necrosis factor α;
VCAM-1 = molecola 1 di adesione cellulare dei casi; VEGF = fattore di
crescita endoteliale dei casi.
Vuoi citare questo contributo?
