Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Novembre 2025 - Volume XXVIII - numero 9
M&B Pagine Elettroniche
Il punto su
Una piattaforma mRNA oltre il vaccino Covid-19 anche in Pediatria
Lo stato di avanzamento delle conoscenze
UO Materno-Infantile ASL di Benevento
Indirizzo per corrispondenza: roccorusso@tin.it
English title
Key words: Group A Streptococcus, Invasive infection, Complications, Spread
Abstract
The use of the mRNA platform, through the development of specific vaccines, is an innovation in the fields of Immunology and Public Health. Messenger RNA (mRNA), the cornerstone of the current vaccination strategy against SARS-CoV-2, is also at the basis of clinical trials in paediatric and adolescent populations aimed to create vaccines designed to prevent and counter the spread of a range of pathogens, such as: Epstein-Barr Virus, Respiratory Syncytial Virus, Human Metapneumovirus, Parainfluenza Virus Type 3, Cytomegalovirus, HIV, Zika Virus, Rabies, Varicella Zoster, Herpes Simplex Virus, Tuberculosis and Malaria. The development of more powerful and versatile vaccine platforms proves to be crucial and the results of preclinical studies encourage confidence in the value of mRNA vaccines that can meet the requirements of an ideal preventive tool, with a favourable safety profile, versatility and speed in design and large-scale production.
Riassunto
L'utilizzo della piattaforma a mRNA, attraverso la realizzazione di specifici vaccini, rappresenta una grande innovazione in ambito immunologico e di Sanità Pubblica. L'RNA messaggero (mRNA), protagonista della strategia vaccinale usata per combattere SARS-CoV-2, è alla base di trials clinici in età pediatrica/adolescenziale per mettere in atto vaccini finalizzati a prevenire e contrastare la diffusione di una serie di agenti patogeni, quali: virus di Epstein-Barr, virus respiratorio sinciziale, metapneumovirus umano, virus parainfluenzale di tipo 3, citomegalovirus, HIV, virus zika, rabbia, varicella zoster, virus dell'herpes simplex, tubercolosi e malaria. Lo sviluppo di piattaforme vaccinali più potenti e versatili risulta essere cruciale e gli stessi risultati degli studi preclinici ci inducono a confidare che i vaccini a mRNA, con la loro versatilità e rapidità nella progettazione e produzione su larga scala, possano soddisfare i requisiti di un ideale strumento di prevenzione con un profilo di sicurezza favorevole.
Introduzione
L'introduzione della tecnologia di vaccini a base di acido ribonucleico messaggero (mRNA) ha rappresentato una svolta significativa nell'Immunologia e nella Salute Pubblica, offrendo un nuovo approccio per contrastare la diffusione del SARS-CoV-2, anche nelletà pediatrica.
Come ben noto, questa innovativa piattaforma mRNA, rispetto alla classica metodologia di produzione vaccinale, presenta una serie di vantaggi, quali:
- un rapido sviluppo, e conseguente produzione, che non richiede ad esempio la coltivazione di agenti patogeni su uova o cellule, dispendiosa in termini di tempo e risorse;
- unadeguata precisione nel mettere in atto un prodotto mirato verso lo specifico antigene del patogeno, con un conseguente efficace miglioramento della risposta immunitaria, cosi come un adeguato profilo di sicurezza, confermato dalla esperienza dello stesso vaccino contro linfezione da SARS-CoV-2.
Il futuro di tale piattaforma è particolarmente legato anche alla realizzazione di vaccini a mRNA personalizzati per limmunoterapia antitumorale, che attraverso uno specifico adattamento alle caratteristiche genetiche e agli antigeni del paziente, sarebbero in grado di attivare in maniera selettiva il sistema immunitario nei confronti delle cellule tumorali.
Tra le potenzialità di tale tecnologia, ci sarebbe anche quella di mettere in atto vaccini multivalenti a mRNA, in grado di generare una risposta immunitaria attraverso la codifica di più antigeni anziché una singola proteina; tali prodotti potrebbero essere di fondamentale importanza per contrastare la diffusione di agenti patogeni con strutture superficiali variabili o mutevoli, cosi come nel suscitare contemporaneamente una specifica protezione nei confronti di più agenti patogeni.
In funzione dei vantaggi della piattaforma a mRNA, importanti aziende biotecnologiche hanno già sviluppato diverse ricerche per gli specifici vaccini nella fascia di età pediatrica/adolescenziale, alcune delle quali attualmente in fase di sperimentazione clinica (Tabella e Figura).
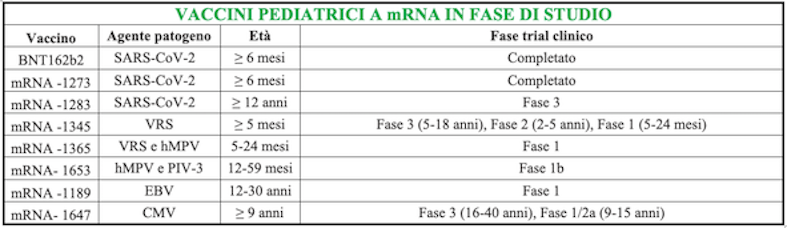

Virus di Epstein-Barr
Lo studio di fase 1 per mRNA-11891 è stato progettato per testare la sicurezza, la reattogenicità e l'immunogenicità di 4 diversi dosaggi in un gruppo di 150 adolescenti americani di età tra i 12 e 17 anni, con una schedula vaccinale a tre dosi (0, 2 e 6 mesi).
Lo studio randomizzato (RCT), in cieco controllato con placebo, ha dimostrato che mRNA-1189 è immunogenico e generalmente ben tollerato ai vari dosaggi.
Virus respiratorio sinciziale (VRS)
È stato completato e sono in corso di pubblicazione i risultati di un RCT di fase 2 in cieco, finalizzato a valutare la sicurezza, la reattogenicità e l'immunogenicità di una dose di vaccino mRNA-1345 contro il VRS, nei bambini di età compresa tra 2 e < 5 anni (coorte 1) e nei bambini ad alto rischio di malattia da VRS di età compresa tra 5 e < 18 anni (coorte 2), per poi stabilire il dosaggio ottimale per la fase successiva di sviluppo (fase 3)2.
Il vaccino mRNA-1345 è composto da una sequenza di mRNA che codifica per una glicoproteina F prefusionale stabilizzata (preF). Questa glicoproteina è espressa sulla superficie del VRS e facilita linfezione permettendo al virus di entrare nelle cellule ospiti. La conformazione prefusionale della proteina F è il bersaglio di potenti anticorpi neutralizzanti ed è altamente conservata in entrambi i sottotipi VRS-A e VRS-B.
Il vaccino utilizza le stesse nanoparticelle lipidiche impiegate nei vaccini di Moderna Inc. contro il Covid-19.
VRS e metapneumovirus umano (hMPV)
Il metapneumovirus umano è un virus RNA appartenente alla sottofamiglia Pneumoviridae della famiglia Paramyxoviridae che, insieme al VRS, risulta essere lagente eziologico delle più comuni malattie delle vie aeree inferiori nei bambini, anche se può essere causa di infezioni delle vie aeree superiori in individui di qualsiasi età.
Un RCT in cieco (numero di registrazione NCT057438813), ha valutato la sicurezza e l'immunogenicità sia del vaccino mRNA-1345 (VRS, codificante la proteina preF) sia di quello mRNA-1365 (combinazione sperimentale codificante preF e hMPV F) in tre gruppi di soggetti di età compresa tra 5 e 24 mesi, ai quali sono state somministrate per via intramuscolare, a dosaggi diversi (30 µg e 15 µg), tre dosi (1, 57 e 113 giorni) di mRNA-1345, mRNA-1365 e placebo.
Attualmente l'arruolamento e la somministrazione sono stati sospesi a seguito di 2 casi gravi di infezioni respiratorie del tratto inferiore (LRTI) causate da VRS in soggetti vaccinati con il dosaggio da 15 μg. Al 10 marzo 2025, si sono verificate infezioni gravi/ospedaliere da VRS-LRTI in 2/20 (mRNA-1345 15 µg), 3/20 (mRNA-1365 15 µg) e 1/20 (placebo). Si sono verificate infezioni gravi/ospedaliere da hMPV-LRTI in 3/20 (mRNA-1365 15 µg), 1/7 (mRNA-1365 30 µg) e 1/27 dei soggetti trattati con placebo. Un soggetto trattato con placebo ha presentato una coinfezione da VRS/hMPV.
Per i suddetti motivi la Food and Drug Administration (FDA) statunitense ha sospeso precauzionalmente tutti gli studi clinici sul vaccino contro il VRS nei bambini (di età inferiore a 2 anni) e in quelli tra 2 e 5 anni non trattati4.
hMPV e virus parainfluenzale di tipo 3 (PIV-3)
Il virus parainfluenzale di tipo 3 (PIV-3), appartenente alla famiglia dei Paramyxoviridae, è un patogeno respiratorio che colpisce principalmente i bambini piccoli e gli individui immunocompromessi, ma può causare infezioni anche negli adulti. È un virus endemico con picchi di incidenza in primavera e inizio estate, e può causare infezioni recidivanti, anche se generalmente più lievi, dopo l'infezione primaria.
È stato completato un RCT in cieco (numero di registrazione NCT041443485), che ha riportato un buon profilo di sicurezza e immunogenicità di due dosi di vaccino combinato mRNA-1653 (contro metapneumovirus umano e virus della parainfluenzale umano di tipo 3), somministrate con un intervallo di due mesi e con diversi dosaggi (10µg o 30µg) in bambini (tra i 12 ed i 59 mesi di età) con evidenza sierologica di una precedente esposizione.
Lo studio ha previsto anche la somministrazione del vaccino in una popolazione adulta (tra i 18 e i 49 anni), il cui profilo di sicurezza ha consentito il successivo arruolamento della coorte pediatrica6.
Questo vaccino risulta essere costituito da 2 distinte sequenze di mRNA, che inserite in nanoparticelle lipidiche (come per i vaccini anti SARS-CoV-2) codificano per la proteina preF stabilizzata, in grado di stimolare una risposta umorale e T mediata e impedire alla proteina di fusione, ancorata alla membrana sia dellhMPV e sia del PIV-3, l'ingresso di questi virus nelle cellule dellepitelio respiratorio.
Citomegalovirus (CMV)
È in corso di reclutamento uno studio (numero di registrazione NCT055754927) finalizzato a valutare la sicurezza e l'immunogenicità di diversi dosaggi di vaccino mRNA-1647 in soggetti sani di sesso femminile e maschile, di età compresa tra 9 e 15 anni, sieronegativi e sieropositivi al CMV. Inoltre, lo stesso vaccino sarà valutato anche in soggetti di sesso femminile di età compresa tra 16 e 25 anni come coorte di confronto.
Dati di potenziale prevenzione della trasmissione fetale del CMV nelle donne in gravidanza, preventivamente vaccinate, vengono forniti da uno studio8 che valuta la immunogenicità dello stesso vaccino mRNA-1647, il quale attraverso la sintesi di un complesso proteico costituito da cinque unità virali, impedirebbe al CMV di infettare le cellule epiteliali che rivestono il naso e la bocca, prevenendo la stessa replicazione virale, oltre a una particolare efficacia nello stimolare il sistema immunitario a distruggere le eventuali cellule infettate dal CMV.
Sappiamo benissimo che il CMV provoca raramente gravi malattie negli adulti sani, ma può causare difetti congeniti e danni cerebrali nei neonati infettati in utero e infezioni letali negli immunodepressi.
Altri vaccini
Sono in fase di sviluppo numerose ricerche per i vaccini a mRNA anche contro altri patogeni, quali: HIV, virus Zika, rabbia, varicella zoster, virus dell'herpes simplex, tubercolosi e malaria9,10 e più recentemente, anche per altri agenti patogeni batterici (ad esempio Borrelia burgdorferi - malattia di Lyme11, Pseudomonas aeruginosa12 - polmonite e Yersinia pestis13 - peste).
I vaccini a mRNA hanno dimostrato di avere unadeguata efficacia in diversi studi preclinici.
Conclusioni
Con lesperienza del vaccino per Covid-19 abbiamo acquisito la consapevolezza del netto progresso che i vaccini mRNA hanno apportato anche nella prevenzione delle malattie infettive, al punto di essere oggetto nel 2023 del riconoscimento del premio Nobel agli scienziati Katalin Karikó e Drew Weissman, che hanno scoperto la tecnologia che ne ha reso possibile il loro sviluppo.
Il maggiore punto di forza della piattaforma a mRNA resta, in ogni caso, la sua alta versatilità, caratterizzata anche dalla possibilità di progettare, produrre e modificare in tempi relativamente brevi, prodotti finalizzati a prevenire e contrastare in maniera adeguata la diffusione anche di specifiche malattie infettive.
Con il superamento di alcune criticità legate alla piattaforma stessa, quali ad esempio la fragilità della molecola di mRNA, che richiede generalmente una conservazione a bassa temperatura tramite catena del freddo con conseguenti difficoltà di carattere logistico nelle fasi di trasporto e stoccaggio del prodotto, cosi come ulteriori dati inerenti sicurezza ed efficacia, le prospettive restano incoraggianti, in quanto i risultati delle ricerche della stessa piattaforma mRNA, ugualmente in ambito pediatrico, potrebbero cambiare lo scenario anche della medicina preventiva, con vaccini personalizzati, adattati alle esigenze specifiche dei singoli individui o gruppi di pazienti, al fine di renderla la porta d'accesso a un futuro più sano.
Negli USA la fiducia degli investitori in progetti incentivanti questa piattaforma, nel giro di pochi mesi, è stata messa a dura prova da un clima politico particolarmente ostile, caratterizzato da licenziamenti di esperti, cancellazione di fondi per ricerca, ecc. Il problema non è la Scienza, ma una politica becera che attraverso un atteggiamento moralmente riprovevole, privo di etica e incentrato su tattiche scorrette, manipolazione e opportunismo, mina la fiducia senza la quale linnovazione rischia di restare senza patria.
Dispiace constatare che il clima politico attuale abbia trasformato i vaccini in simboli ideologici e si auspica che il futuro della tecnologia mRNA, simbolo della Biomedicina del XXI secolo, non venga compromesso da una visione miope dei potenziali progressi della scienza.
Bibliografia
- Moderna Inc. Moderna Advances Multiple Vaccine Programs to Late-Stage Clinical Trials. Updated May 2025.
- A Study of mRNA-1345, an mRNA Vaccine Targeting Respiratory Syncytial Virus, in Children 2 to <18 Years of Age at High Risk of Respiratory Syncytial Virus. Updated July 2025.
- A Safety, Tolerability, and Immunogenicity Study of mRNA-1345 and mRNA-1365 in Participants Aged 5 Months to <24 Months. Updated December 2024.
- US Food and Drug Administration Vaccines and Related Biological Products Advisory Committee Meeting. Considerations for Respiratory Syncytial Virus (RSV) Vaccine Safety in Pediatric Populations. FDA briefing document 2024.
- Safety and Immunogenicity of mRNA-1653, a Combined Human Metapneumovirus (hMPV) and Parainfluenza Virus Type 3 (PIV3) Vaccine, in Healthy Adults, and Children 12 to 59 Months of Age With Serologic Evidence of Prior Exposure. ID: NCT04144348. Updated February 2023.
- Schnyder Ghamloush S, Essink B, Hu B, et al. Safety and Immunogenicity of an mRNA-Based hMPV/PIV3 Combination Vaccine in Seropositive Children. Pediatrics 2024;153(6):e2023064748. DOI: 10.1542/peds.2023-064748.
- A Study of mRNA-1647 Cytomegalovirus Vaccine in Healthy Participants 9 to 15 Years of Age and Participants 16 to 25 Years of Age. Updated July 2025.
- Hu X, Karthigeyan KP, Herbek S, et al. Human Cytomegalovirus mRNA-1647 Vaccine Candidate Elicits Potent and Broad Neutralization and Higher Antibody-Dependent Cellular Cytotoxicity Responses Than the gB/MF59 Vaccine. J Infect Dis 2024;230(2):455-66. DOI: 10.1093/infdis/jiad593.
- Gote V, Bolla PK, Kommineni N, et al. A Comprehensive Review of mRNA Vaccines. Int J Mol Sci 2023;24(3):2700. DOI: 10.3390/ijms24032700.
- Zhou W, Jiang L, Liao S, et al. Vaccines' New Era-RNA Vaccine. Viruses 2023;15(8):1760. DOI: 10.3390/v15081760.
- Pine M, Arora G, Hart TM, et al. Development of an mRNA-lipid nanoparticle vaccine against Lyme disease. Mol Ther 2023;31(9):2702-14. DOI: 10.1016/j.ymthe.2023.07.022.
- Wang X, Liu C, Rcheulishvili N, et al. Strong immune responses and protection of PcrV and OprF-I mRNA vaccine candidates against Pseudomonas aeruginosa. NPJ Vaccines 2023;8(1):76. DOI: 10.1038/s41541-023-00672-4.
- Kon E, Levy Y, Elia U, et al. A single-dose F1-based mRNA-LNP vaccine provides protection against the lethal plague bacterium. Sci Adv 2023;9(10):eadg1036. DOI: 10.1126/sciadv.adg1036.
Vuoi citare questo contributo?
