Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Aprile 2008 - Volume XI - numero 4
M&B Pagine Elettroniche
Contributi Originali - Casi contributivi
E'
giustificato un diverso approccio terapeutico nel trattamento
dell'atrofia muscolare spinale di tipo 1? Insegnamenti concreti da
un caso clinico
1Clinica
Pediatrica, 2UO di Radiologia, 3UO di
Fisioterapia, Istituto per l'infanzia IRCCS “Burlo Garofolo”,
Trieste; 4UO Anestesia e Rianimazione, Istituto “G.
Gaslini”, Genova
Indirizzo
per corrispondenza: lau.bad@gmail.com
Could
a different approach to respiratory complications in type 1
spinal muscular atrophy be justified? learning by a clinical
case
Key
words
Spinal
muscular atrophy, atelectasis, Boussignac CPAP valve, Mechanical
in-exsufflator, Non- invasive ventilation
Summary
Children
affected by spinal muscular atrophy (SMA) can develop serious
respiratory complications including atelectasis, pneumonia, small
airway obstruction and acidosis, principally because of impaired
cough secondary to weakness of chest wall. Ineffective airway
clearance can be exacerbated by acute respiratory illnesses, when
secretion production increases and respiratory muscle function
acutely deteriorates. In the past the only chance to prolong
serviva for children with SMA intubated for acute respiratory
failure was often tracheotomy and long-term mechanical
ventilation. Most physicians discourage endotracheal intubation
and tracheotomy, assuming that the prognosis for survival would
not be greatly improved and the quality of life is too poor to
justify such an invasive intervention. Recent reports highlight
that tracheotomy for most SMA 1 children could be delayed by the
praecox use of non-invasive ventilation (NIV) and mechanical
in-exsufflator (MI-E), thus increasing their quality of life. We
report a case of a SMA 1 infant presenting migrating atelectasis
who was successfully treated by using Boussignac CPAP valve, MI-E
and NIV. |
Un
lattante di 6 mesi affetto da atrofia muscolare spinale di tipo 1
viene ricoverato per un episodio di broncopolmonite, resistente alla
terapia antibiotica orale avviata a domicilio e caratterizzato da
quadro di importante impegno respiratorio. All'ingresso è
febbrile, polipnoico, dispnoico con moderata desaturazione arteriosa
di ossigeno (91%), ma reattivo e con tempo di ricircolo capillare
nella norma. Il fabbisogno di ossigeno è di 3 l/min con
occhialini. Al torace si apprezzano rumori trasmessi dalle alte vie
aeree associati a ronchi, rantoli umidi ed espirio prolungato.
L'emogasanalisi capillare mostra pH 7,41, pCO2 44,2 mmHg, pO2 62
mmHg, bicarbonato 28,6 mEq/l, BE 4. La radiografia del torace
evidenzia un'atelettasia destra con spostamento del polmone
controlaterale (Figura 1).
Viene
iniziata terapia antibiotica parenterale (ceftriaxone) e, nell'ottica
di agire sulla componente atelettasica, steroide per via endovenosa e
DNAsi inalatoria.
Nelle ore
successive le condizioni del bambino peggiorano ulteriormente con
aggravamento della dispnea, pertanto si decide di eseguire una
broncoscopia in sedazione, durante la quale viene aspirato materiale
mucoso chiaro ed acellulato, con successivo lieve miglioramento
clinico e radiologico.
Nel
timore che potesse essersi trattato di una polmonite ab ingestis
viene prudenzialmente sospesa l'alimentazione e avviata nutrizione
parenterale tramite catetere venoso centrale, posizionato in corso di
intervento di broncoscopia. Dopo 24-48 ore di apparente benessere, le
condizioni del bambino peggiorano nuovamente con ricomparsa di severa
poli-dispnea e di un quadro radiografico sostanzialmente
sovrapponibile a quello d'ingresso. Ma, per la persistenza della
dispnea con progressiva compromissione della reattività, il
piccolo viene sottoposto a una seconda broncoscopia con
broncoaspirazione. L'estubazione è immediata e il bambino
viene mantenuto in respirazione spontanea appena terminata la
procedura. Dopo la seconda broncoscopia si assiste a un miglioramento
solo parziale dell'impegno respiratorio associato ad una rilevante
componente di agitazione, tale da richiedere sedazione con midazolam
in infusione continua.
Nel corso
della degenza in Rianimazione le condizioni generali del bambino
vanno progressivamente migliorando. Sono comunque presenti rumori
grossolani diffusi e persistenti su tutto l'ambito toracico.
Dopo alcuni giorni la radiografia del torace, che fino a quel momento
è progressivamente migliorata pur persistendo l'opacità
all'apice polmonare di destra (Figura 2), è
assolutamente sconfortante, ed evidenzia una nuova opacità al
campo polmonare superiore di sinistra associata a broncogramma aereo
in sede retrocardiaca sinistra con lieve deviazione mediastinica
(Figura 3).
Ci si
trova, quindi, di fronte alla difficoltà di dover gestire
delle atelettasie ricorrenti, verosimilmente generate dalla
formazione di tappi di muco endobronchiali, in un bambino con severa
compromissione della forza dei muscoli della gabbia toracica, non in
grado di gestire autonomamente un'espettorazione efficace. Nel
tentativo di superare il limite imposto dall'incapacità del
paziente a generare flussi espiratori sufficienti per mobilizzare le
secrezioni bronchiali, sono stati iniziati dei cicli di ventilazione
non invasiva con il supporto della CPAP (Continuous Positive
Airway Pressure) con valvola di Boussignac (Box 1
e Figura 4) associata al Mechanical
In-Exsufflator o “macchina della tosse” (pressione
inspiratoria 30 cmH2O, pressione espiratoria 40 cmH2O), (Box
2 e Figura 5) per il supporto della tosse
appunto, entrambe ben tollerate dal bambino. Tale approccio ha
permesso di migliorare l'ingombro respiratorio dovuto alle
secrezioni, con negativizzazione del reperto obiettivo toracico ed
eclatante normalizzazione della radiografia del torace (Figura
6).
Successivamente
viene avviata ventilazione non invasiva (NIV) notturna in modalità
pressometrica assistita controllata con maschera facciale (IPAP o
Inspiratory Positive Airway Pressure: 18 cmH2O; EPAP o
Expiratory Positive Airway Pressure: 4 cmH2O).
Il
piccolo è stato dimesso con il seguente programma di
assistenza domiciliare respiratoria (ADR): abilitazione dei genitori
nella care quotidiana, all'uso dei presidi di ventilazione non
invasiva e di sostegno della tosse e nella gestione delle urgenze ed
emergenze; coinvolgimento del pediatra di libera scelta e delle
strutture territoriali (ASL, 118, azienda fornitrice di energia
elettrica); fornitura di apparecchiature e materiali di consumo. La
prosecuzione della ventiloterapia a casa associata a programma
fisioterapico riabilitativo ha permesso una stabilizzazione delle
condizioni cliniche. A 6 mesi dalla dimissione il bambino è in
buone condizioni generali, 2 episodi di infezione delle alte vie
respiratorie sono stati gestiti a domicilio senza problemi e non ha
necessitato di ulteriori ricoveri.
L'atrofia
muscolare spinale di tipo 1 (SMA 1) evolve verso lo sviluppo
progressivo di insufficienza respiratoria secondaria a deficit di
forza muscolare. I bambini manifestano i primi segni della malattia
(fascicolazioni linguali, ipotonia agli arti inferiori con “gambe a
rana”) entro i primi 6 mesi di vita. La debolezza muscolare si
aggrava rapidamente ed i problemi respiratori successivi portano a
morte generalmente entro i 2 anni d'età1. L'interessamento
respiratorio consta di infezioni ricorrenti, atelettasie, patologia
polmonare da inalazione di materiale gastrico e di saliva,
progressivo sviluppo di insufficienza respiratoria tipo II
(ipossiemica e ipercapnica).
In
letteratura sono stati descritti alcuni casi di multiple atelettasie
migranti, secondarie a malattie neuromuscolari, tra cui anche la
SMA2.
Questa
esperienza ci permette di valorizzare come il trattamento con
metodiche non invasive di ventilazione meccanica e di supporto della
tosse (CPAP di Boussignac e macchina della tosse) sia stato decisivo
per risolvere il quadro polmonare, come e più della
broncoaspirazione eseguita ripetutamente. Avremmo potuto utilizzare
una ventilazione non invasiva convenzionale, con IPAP alte, in modo
da favorire la penetrazione dell'aria anche nelle zone con bassa
compliance polmonare. Il bambino però ha presentato una buona
risposta alla CPAP che è risultata, in questo caso, una
tecnica di più facile applicazione vista la situazione
d'urgenza. L'adattamento all'utilizzo della macchina della
tosse è stato, invece, più graduale, almeno
inizialmente. Infatti sia l'insufflazione che l'aspirazione
dell'aria spaventavano il bambino. In seguito è stato
possibile coordinare progressivamente la macchina con il pattern
respiratorio del piccolo, che ha iniziato ad abituarsi a tale
sostegno respiratorio. Bisogna sottolineare comunque che, anche in
questo caso, come del resto si verifica quasi sempre nei pazienti che
ne traggono reale beneficio, l'adattamento all'uso della
“macchina della tosse” è stato piuttosto agevole.
Nell'esperienza descritta inoltre si è mostrata risolutiva
proprio l'associazione delle due tecniche: la valvola di Boussignac
prima e la macchina della tosse poi.
Dopo
l'avvenuta stabilizzazione dall'evento acuto, è
stata avviata ventilazione non invasiva a due livelli di pressione
(ventilazione pressometrica assistita controllata) a causa della
presenza di respiro paradosso, e mantenuto l'utilizzo della
“macchina della tosse” al fine di proteggere il bambino da
successive riesacerbazioni.
In
letteratura iniziano a comparire i primi studi che sottolineano come
la prognosi dei bambini con malattie neuromuscolari possa essere
modificata dall'utilizzo di supporti di ventilazione non invasiva3.
Alcuni lavori dimostrano anche nello specifico l'efficacia del
Mechanical In-Exsufflator in pazienti con distrofia muscolare di
Duchenne4,5,6 e SMA5,7 con risultati positivi
in termini di necessità di ospedalizzazione, frequenza di
polmoniti, tempo di evoluzione in insufficienza respiratoria e
necessità di tracheostomia. Nella quasi totalità dei
casi riportati il dispositivo è risultato sicuro, ben
tollerato ed efficace nel prevenire le complicazioni polmonari.
Va
sottolineato come la ventilazione non invasiva possa offrire a questi
bambini le stesse opportunità di sopravvivenza della
ventilazione con tracheostomia, migliorando però alcuni
aspetti della qualità della vita: autonomia per alcune ore
dalla ventilazione meccanica, conservazione della fonazione, minor
rischio infettivo3. I primi 3 anni di vita sono gravati,
per i pazienti mantenuti in NIV, da una maggiore necessità di
ricorrere a ricoveri ospedalieri. Dopo questa età tale
esigenza si riduce fino ad essere inferiore a quella dei pazienti
tracheostomizzati.
Attualmente
la NIV non ha raggiunto una sufficiente diffusione nel trattamento di
questi pazienti ed è possibile che centri ospedalieri di
riferimento in varie regioni d'Italia posseggano ancora scarsa
dimestichezza con la tecnica e non siano quindi adeguatamente
preparati per supportare queste famiglie sia nella gestione
quotidiana del bambino sia nei momenti di emergenza/urgenza.
In caso
di episodi intercorrenti che compromettano l'efficacia della NIV,
il bambino potrebbe dover essere sottoposto ad intubazione tracheale
ed a ventilazione meccanica invasiva. Raggiunta la remissione da tale
recrudescenza, però, apposite tecniche di estubazione possono
essere utilizzate per riportare il paziente alla ventilazione non
invasiva7.
La
domiciliazione richiede il
consenso dei genitori, il loro adeguato addestramento, la scelta di
un trattamento ventilatorio idoneo e sicuro. L'organizzazione
dell'assistenza domiciliare prevede il coinvolgimento del pediatra
di libera scelta quale primo responsabile della salute del bambino,
ma ha come primi operatori i genitori. Questi vengono preventivamente
addestrati per diventare esperti care givers. Il monitoraggio della
saturazione arteriosa di ossigeno (SaO2) durante il respiro spontaneo
senza supporto di ossigeno rappresenta per i genitori il principale
indicatore delle condizioni del bambino. L'obiettivo è
costituito dal mantenimento di SaO2 pari o superiori al 95%, che
corrispondono solitamente ad una pressione parziale di anidride
carbonica nel sangue inferiore ai 50 mmHg. Qualora la SaO2 scenda a
valori inferiori al 95%, l'indicazione per i care givers è
di intervenire mediante metodiche di fisioterapia respiratoria,
aspirazione ed eventuale avvio di ventilazione non invasiva.
L'ossigenoterapia
è da ritenersi dannosa in questi pazienti. Infatti la
supplementazione di ossigeno permette di normalizzare i valori di
ossigenazione nel sangue senza migliorare la ventilazione, rendendo
il parametro della SaO2 inutile quale indicatore di adeguatezza
ventilatoria e di necessità di intervento. I genitori, infine,
devono essere in grado di individuare situazioni di graduale
peggioramento legato ad infezioni respiratorie, da trattare, quando
possibile, con terapia specifica e soprattutto devono saper
intervenire mediante aspirazione e ventilazione con pallone Ambu e
maschera in caso di emergenza, il più delle volte correlata a
inalazione di saliva o materiale gastrico. Nel caso si verifichi un
evento acuto legato a inalazione, sarà opportuno eseguire uno
studio della deglutizione (la debolezza muscolare bulbare può
determinare incoordinazione deglutitoria) ed escludere l'eventuale
presenza di reflusso gastroesofageo (deglutogramma, pasto baritato,
impedenzo-pHmetria esofagea), condizioni che, se presenti, andranno
trattate fino anche alla necessità di avviare un supporto
alimentare mediante posizionamento di gastrostomia per via
endoscopica (PEG).
Gli
incoraggianti dati di letteratura, associati alla concretezza di
esperienze come questa sulla possibilità di migliorare la
qualità della vita dei bambini affetti da malattie
neuromuscolari, rendono auspicabile un progetto condiviso finalizzato
a migliorare la care dei pazienti affetti da SMA 1, con un'attenta
valutazione del rapporto costi/benefici e delle sostanziali modifiche
di outcome.
L'alternativa
a tutto ciò rimane un approccio minimamente invasivo, al
limite dell'astensionismo terapeutico. In uno studio pubblicato su
Pediatrics che metteva in luce le molteplici difficoltà nella
gestione del bambino dipendente da sistemi di supporto ventilatorio,
però, nessuna delle famiglie intervistate era in grado di
pensare alla propria esistenza senza il figlio, membro a tutti gli
effetti del nucleo familiare e degno di ogni rispetto. Tutte queste
famiglie inoltre cercavano di condurre una vita quanto più
ordinaria possibile e di garantire il massimo della normalità
al bambino8.
In
conclusione, se fino a pochi anni fa la tracheostomia, quale unica
scelta terapeutica per questi pazienti, rendeva spesso i genitori
inclini alla limitazione delle cure, l'avvento di queste nuove
tecniche, capaci di ridurre l'invasività e di migliorare,
seppur limitatamente, la qualità della vita di questi bambini,
offre ai genitori una valida alternativa.
La
valvola di Boussignac permette di generare una CPAP attraverso un
dispositivo in plastica semplice e leggero (circa 10 g di peso),
privo di parti mobili. La particolare geometria di questo
dispositivo permette di creare una pressione positiva continua
senza necessità di generatori di pressione meccanici, ma
semplicemente collegando la valvola ad un flussometro tramite un
tubo connettore (Figura 5). La valvola
presenta attacchi standard per il collegamento a tutti i tipi di
maschere facciali, tubi endotracheali e cannule per tracheostomia.
Si
tratta di un sistema aperto (cioè in connessione diretta
con la pressione atmosferica) che sfrutta il principio di
Bernoulli per trasformare in pressione il flusso di gas
all'ingresso. La pressione può essere regolata aumentando
o diminuendo il flusso d'aria o di ossigeno, variando da un
minimo di 2,5 a un massimo di 10 cmH2O in base al flusso erogato,
e può essere facilmente monitorata con l'uso di un
manometro9.
Rispetto
ai sistemi tradizionali, la CPAP di Boussignac è di
semplice utilizzo; in ambiente ospedaliero è sufficiente
connetterla ad un flussometro “a muro” per utilizzarla
immediatamente. È inoltre di minimo ingombro e, essendo un
sistema aperto, permette al paziente di respirare liberamente
senza alcuna resistenza qualora il flusso venga interrotto.
Inoltre è possibile utilizzare il foro in comunicazione con
l'ambiente per praticare contemporaneamente una broncoscopia10.
È possibile infine usare un nebulizzatore per
l'areosol-terapia in corso di CPAP e si possono somministrare
alti flussi di ossigeno, anche umidificato, senza interruzioni nel
circuito.
Il
peso e l'ingombro ridotti permettono una facile applicazione del
dispositivo anche in pazienti portatori di tracheotomia o di tubo
endotracheale, riducendo le forze meccaniche applicate alla
trachea e alle strutture circostanti. Inoltre il fatto che il
sistema di Boussignac sia una valvola solo virtuale, senza parti
mobili, ne impedisce, in questi pazienti, l'ostruzione da parte
di secrezioni. Il fatto che il flusso si conserva
indipendentemente dalla lunghezza del tubo di connessione permette
di usare connettori anche molto lunghi; tale fatto non è
trascurabile nei pazienti con patologia polmonare cronica che
necessitano di pressioni di supporto per molte ore al giorno
poiché concede loro dello spazio per il movimento11.
L'ultima
e forse più importante caratteristica di questo dispositivo
è che sarà il flusso richiesto dal paziente in fase
inspiratoria a condizionare la pressione di supporto nelle vie
aeree (mentre l'eccedente uscirà dal sistema aperto),
minimizzando il rischio di barotrauma soprattutto nei bambini più
piccoli e delicati.
Gli
svantaggi del sistema di Boussignac sono il rumore che esso
produce (per un livello di CPAP di circa 5 cmH2O ad un metro di
distanza si misurano circa 55 dB) e la difficoltà a
utilizzare questo sistema a domicilio per la scarsa disponibilità
di flussometri portatili. |
La
macchina della tosse è un ventilatore a pressione
positiva/negativa intermittente per la disostruzione delle alte
vie aeree. Il dispositivo garantisce un'insufflazione di
ampiezza variabile attraverso un boccaglio, una maschera nasale (o
oro-nasale) o ancora per mezzo di un tubo endotracheale o
tracheostomico. Questa insufflazione è seguito
dall'applicazione di una pressione negativa che assicura
un'espirazione meccanica forzata. I soggetti con malattie
neuromuscolari possono beneficiare a lungo del supporto
ventilatorio tramite NIV, ma può diventare impossibile per
questi pazienti evitare la tracheotomia qualora la debolezza
muscolare sia tale da renderli incapaci di eliminare le secrezioni
in corso di episodi infettivi intercorrenti12. La
macchina della tosse permette in diversi casi di aumentare questa
chance.
Il
90% delle complicanze respiratorie nei pazienti neuromuscolari è
dovuto principalmente alla debolezza dei muscoli respiratori e/o
bulbari che rendono estremamente difficoltosa l'espulsione delle
secrezioni. È stato dimostrato che quando il picco di tosse
scende sotto i 160 l/min, l'espulsione volontaria delle
secrezioni diviene impossibile. Pertanto in tali pazienti anche
una banale infezione delle alte vie aeree complicata da
tracheo-bronchite può portare alla necessità di
intubazione e alla successiva tracheostomia. I bambini con
debolezza della muscolatura toracica da moderata a severa sono
inoltre a rischio di andare incontro ad episodi ricorrenti di
polmonite o atelettasia proprio per la loro incapacità a
drenare spontaneamente le secrezioni delle vie aeree2,5.
Sia
nei pazienti adulti che nei pazienti pediatrici affetti da
malattie neuromuscolari (distrofia muscolare di Duchenne, miopatie
congenite, atrofia muscolare spinale di tipo I e II, altre
malattie neuromuscolari non specifiche) l'utilizzo della
macchina della tosse si è confermata una promettente,
sicura, ben tollerata e valida alternativa o supporto alle
tecniche di fisiocinesiterapia respiratoria al fine di ridurre le
complicanze infettive e posticipare il ricorso alla
tacheostomia5,6. |
La
ventilazione meccanica non invasiva viene fornita collegando il
ventilatore meccanico al paziente tramite una interfaccia
(maschera nasale, oro-nasale, facciale o boccaglio). Il
ventilatore insuffla aria all'interno dei polmoni ad una data
pressione. Si differenzia dalla ventilazione a pressione positiva
continua (CPAP) perché consente di tarare la pressione di
supporto su due livelli, uno durante l'inspirazione (IPAP o
Inspiratory Positive Airway Pressure) e l'altro durante
l'espirazione (EPAP o Expiratory Positive Airway Pressure).
L'IPAP rappresenta la pressione di supporto che permette una
riduzione del lavoro muscolare, mentre l'EPAP equivale alla PEEP
(Positive End Expiratory Pressure), è minore della
pressione inspiratoria e favorisce l'espirazione del paziente,
mantenendo al contempo la pervietà delle vie aeree e
contrastando il collabimento degli alveoli. Un sensore (“trigger”)
permette alla macchina di adattarsi al paziente: il ventilatore
cicla in inpirio ed espirio sincronizzandosi con gli atti
ventilatori del paziente. In questo modo la NIV garantisce una
minore fatica respiratoria, un miglioramento degli scambi gassosi
anche senza supplementazione di ossigeno ed uno smaltimento più
efficace della CO2. Vi è una letteratura consolidata nel
suo utilizzo nelle apnee ostruttive (ad esempio paziente con
Prader-Willi ed obesità anche in sola CPAP), nella fibrosi
cistica come terapia “ponte” in attesa del trapianto di
polmone, nel trattamento in acuto di pazienti immunodepressi con
“acute lung injury” al fine di cercare di ridurre la necessità
di intubazione e le complicanze secondarie13,14.
Secondo alcuni autori il suo uso precoce in bambini con patologia
neuromuscolare, accompagnato dalla scelta di posture adeguate, può
migliorare lo sviluppo della gabbia toracica, aiutare nella
gestione delle complicanze respiratorie, garantire adeguatezza
negli scambi gassosi15. |
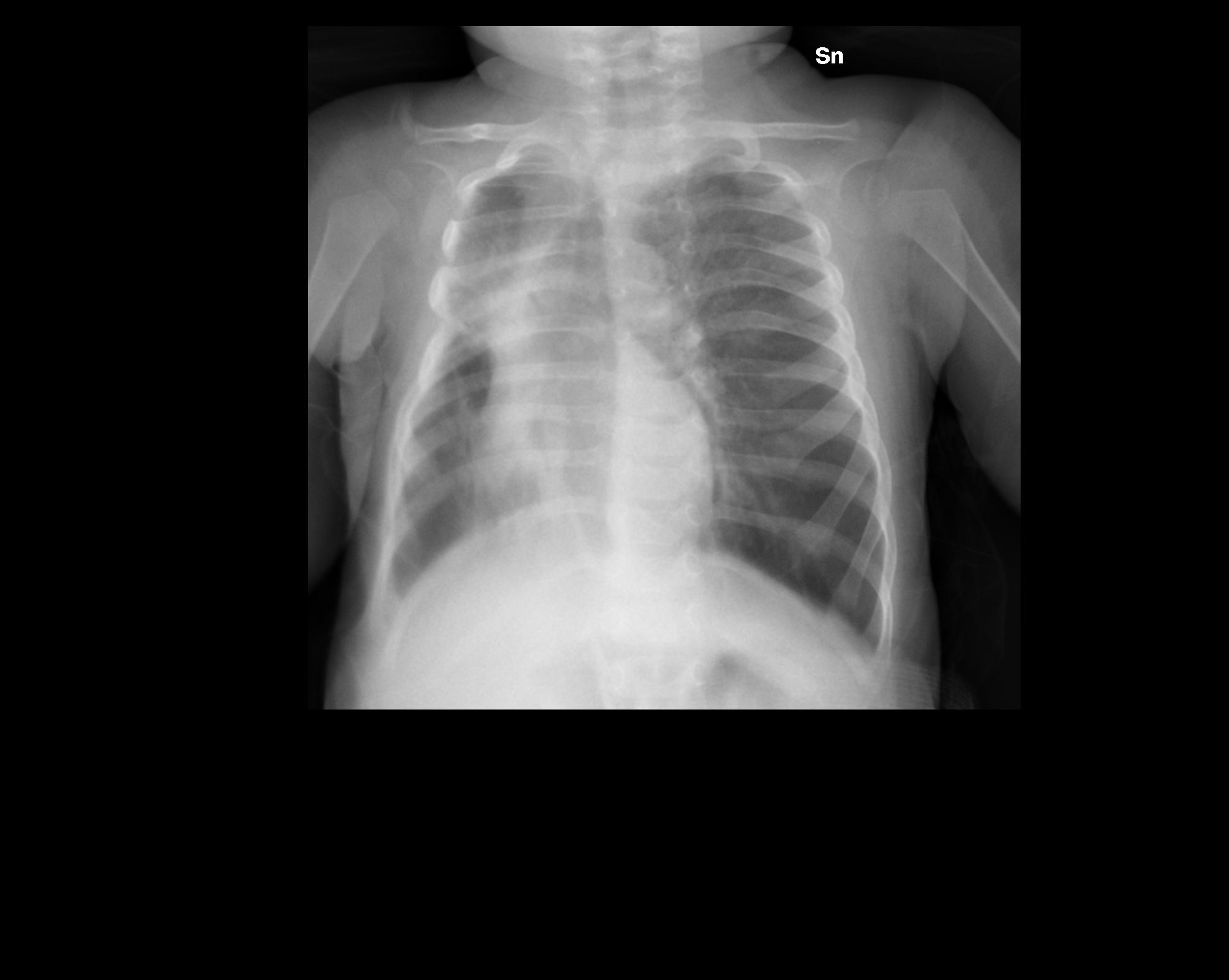
Figura
1. Radiografia del torace che evidenzia: marcato spostamento del
mediastino, deviazione dell'asse tracheale, erniazione del polmone
sinistro a destra; opacamento del campo polmonare medio e superiore
di destra con atelettasia del lobo superiore.
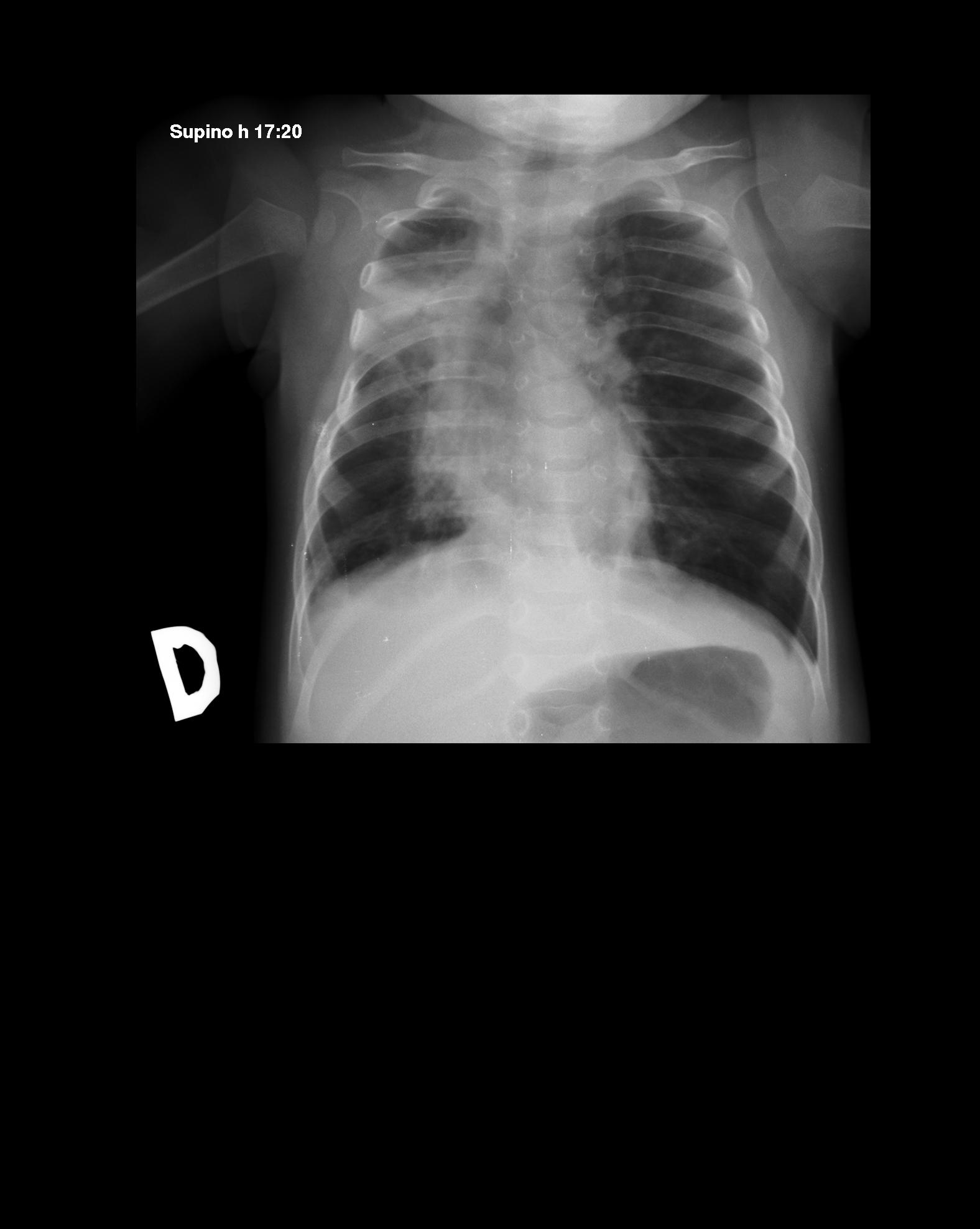
Figura
2. Banda radiopaca atelettasica contro il III e IV spazio
intercostale di destra da riferire a residua atelettasia.
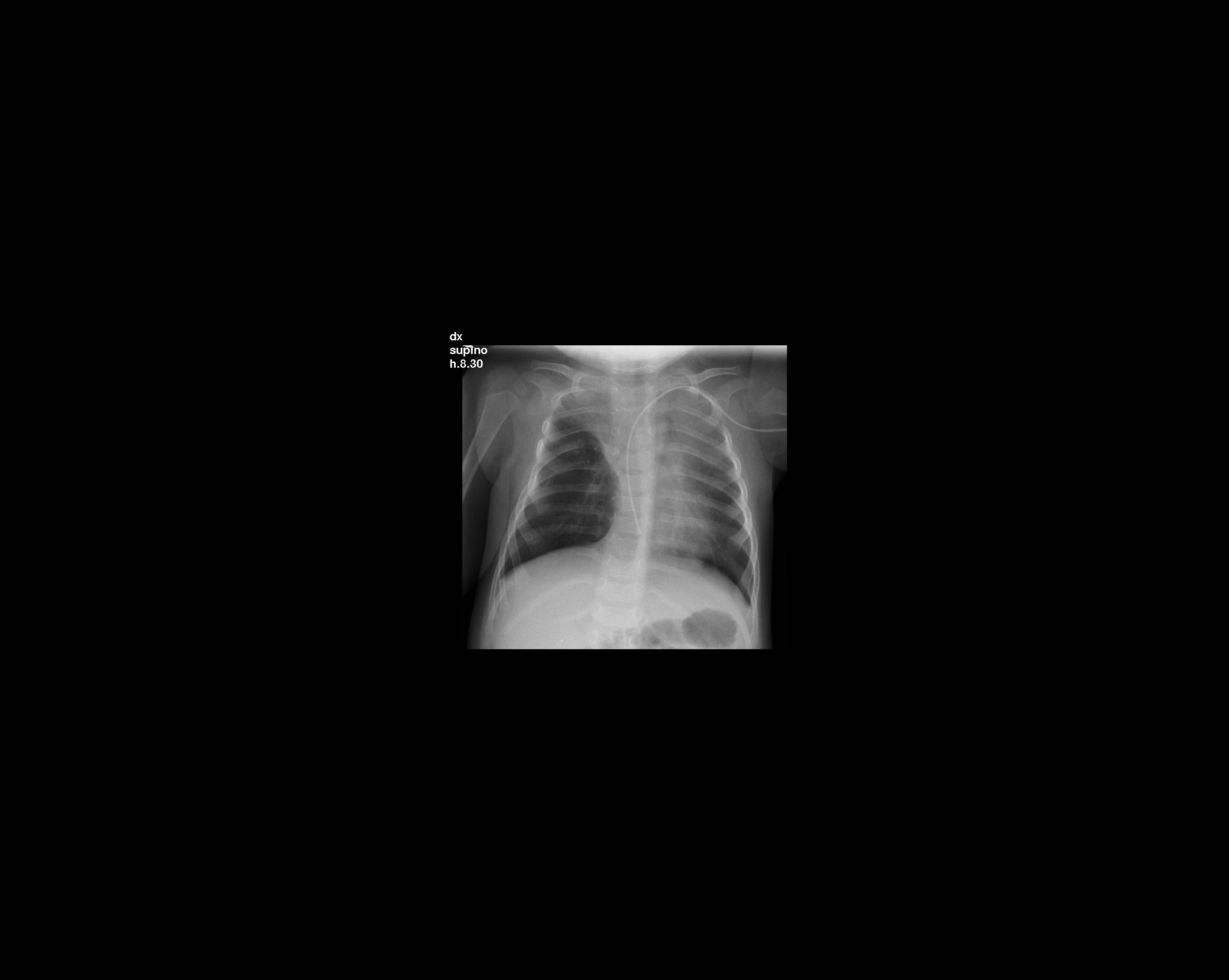
Figura
3. Opacità al campo superiore di sinistra. Presente lieve
ipoespansione dell'emitorace di destra rispetto al controlaterale,
con dimorfismo del V arco costale di destra.

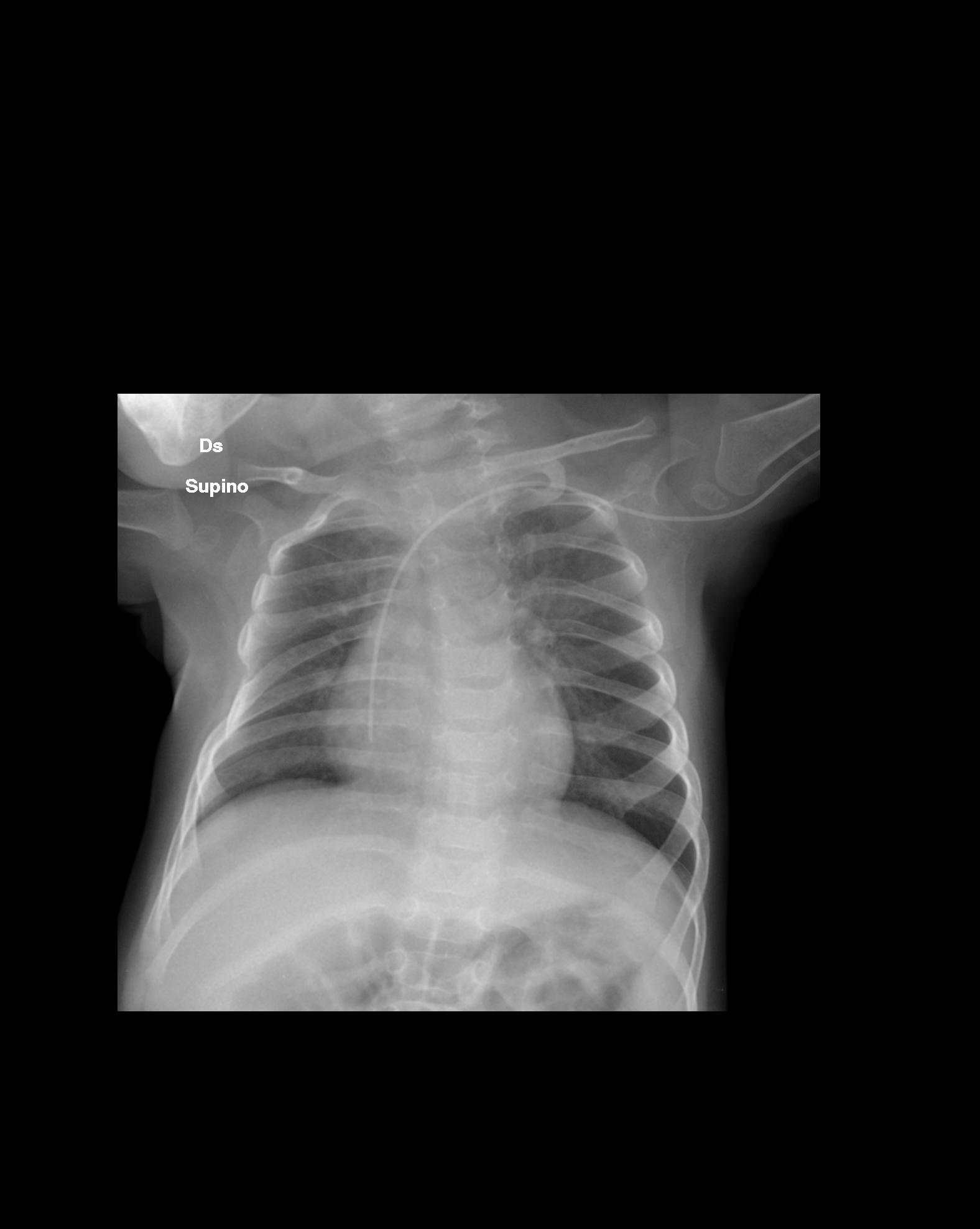
Figura
6. Non evidenti alterazioni pleuro-parenchimali in atto. L'unico
reperto da segnalare è la permanenza dell'ipoespansione
dell'emitorace di destra rispetto al controlaterale; con dimorfismo
del V arco costale di destra.
Bibliografia
1. Sarnat
HB. Neuromuscolar Disorder. In: Kliegman RM, Behrman RE, Jenson HB,
Stanton BF ed. Nelson Textbook of Pediatrics 18th edition by Saunders
Elselvier. Philadelphia;2007.
2.
Leistikow EA, Jones NE, Josephson KD et al. Migrating atelectasis in
Werdnig-Hoffmann Disease: Pulmonar manifestation in two cases of
Spinal Muscular Atrophy Type 1. Pediatric Pulmunology 1999;28:149-53.
3. Bach
JR, Saltstein K, Weaver B, Komaroff E. Long term survival in Werdnig
Hoffman Disease. Am J Phys Med Rehabil 2007;86:339-45.
4.
Panitch HB. Airway clearance in children with neuromuscular weakness.
Curr Opin Pediatr 2006;18:277-81.
5. Miske
LJ, Hockey EM, Kolb SM, Weiner DJ, Panitch HB. Use of the Mechanical
In-Exsufflator in pediatric patients with neuromuscular disease and
impaired cough. Chest 2004;125:1406-12.
6.
Chatwin M, Ross E, Hart N, et al. Cough augmentation with mechanical
insufflation/exsufflation in patients with neuromuscolar weakness.
Eur Respir J 2003;21:502-8.
7. Bach
JR, Baird JS, Plosky D, et al. Spinal muscular atrophy type 1:
management and outcomes. Pediatr Pulmonol 2002;34:16-22.
8.
Carnevale FA, Alexander E, Davis M, Rennick J, Troini R. Daily living
with distress and enrichment: the moral experience of families with
ventilator-assisted children at home. Pediatrics 2006;117:e48-60.
9. Cigada
M, Elia G, Ombrello M, et al. Novel indications for the Boussignac
CPAP valve. Intensive Care Med 2007;33:374-5.
10.
Maitre B, Jaber S, Maggiore SM, et al. Continuous positive airway
pressure during fiberoptic bronchoscoy in hypoxemic patients. A
randomized double-blind study using a new device. Am J Respir Crit
Care Med 2000;162:1063-7.
11.
Dieperink W, Goorhuis JF, de Weerd W, et al. Walking with continuous
positive airway pressure. Eur Respir J 2006;27:853-5.
12. Bach
JR. Mechanical insufflation/exsufflation: has in come of age? A
commentare. Eur Respir J 2003;21:385-6.
13.
Teague WG. Non-invasive positive pressure ventilation: current status
in paediatric patients. Pediatr Respir Rev 2005;6:52-60.
14.
Hilbert G, Gruson D, Vargas F, et al. Noninvasive ventilation in
immunosuppressed patients with pulmonary infiltrates, fever, and
acute respiratory failure. N Engl J Med. 2001;344:481-7.
15.
Vasconcelos M, Fineza I, Félix M, Estêvão MH.
Spinal muscular atrophy--noninvasive ventilatory support in
pediatrics. Rev Port Pneumol. 2005;11:443-55.
Vuoi citare questo contributo?