Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Aprile 2011 - Volume XIV - numero 4
M&B Pagine Elettroniche
Caso contributivo
Interessamento
cardiaco nella sindrome di Churg-Strauss: un caso clinico emblematico
1Clinica
Pediatrica, IRCCS “Burlo Garofolo”, Università di
Trieste
2UOC
di Pediatria, PO “Sant’Antonio”, San Daniele del
Friuli (Udine)
3Servizio
di Cardiologia, IRCCS “Burlo Garofolo”, Università
di Trieste
Indirizzo
per corrispondenza: alessandro.amaddeo@gmail.com
Cardiac
involvement in Churg-Strauss syndrome. An emblematic clinic case
Key
words Churg-Strauss
syndrome, Miocardial involvement, Clinic case
Abstract
We
report the case of a 15-year-old boy with asthenia,
hypereosinophilia, a macular-papular rash in his hands and weight
loss in the previous two months. Spirometry showed severe
bronchial obstruction and transthoracic echocardiography revealed
a peri-miocardial involvement. Churg-Strauss syndrome was
diagnosed and appropriate treatment was initiated. Cardiac
involvement it is not included in the official diagnostic
criteria of CSS despite it is common (up to 60% of cases) and
represents the major cause of mortality. |
|
Riportiamo
il caso di un ragazzo di 15 anni con astenia, ipereosinofilia rash
maculo-papulare a entrambe le mani e perdita di peso negli ultimi due
mesi. La spirometria ha dimostrato un quadro di asma severo e
l’ecocardiografia ha messo in evidenza un coinvolgimento
peri-miocardico. È stata quindi posta diagnosi di sindrome di
Churg-Strauss (CSS). Nonostante l’interessamento cardiaco non
sia incluso nei criteri ufficiali di CSS rappresenta una complicanza
frequente e potenzialmente severa.
Davide
(nome di fantasia) è un ragazzo di 15 anni giunto alla nostra
osservazione per un quadro insorto circa due mesi prima e
caratterizzato da astenia e inappetenza ingravescenti con una marcata
perdita di peso.
Lamentava
frequenti mialgie e la presenza di incostanti parestesie agli arti
inferiori soprattutto a destra. Era stata notata inoltre la comparsa
di maculo-papule pruriginose, leggermente rilevate e a scomparsa
spontanea al palmo delle mani. Per questo motivo erano stati eseguiti
esami ematici con riscontro di una leucocitosi eosinofila (GB
19.530/mm3 con il 44% di eosinofili), e aumento marcato degli
indici di flogosi: VES 63, IgG 1938.
In
anamnesi era presente un asma bronchiale, caratterizzato durante
l’infanzia, da ripetuti episodi di bronchiti asmatiformi e con
cutipositività unicamente per graminacee. In passato Davide
aveva presentato frequenti episodi di broncospasmo per il quale
utilizzava broncodilatatore a breve emivita. Al momento del ricovero
eseguiva terapia con salmeterolo/fluticasone 50/250, ma senza
regolarità (al bisogno); l’asma veniva inoltre riferito
come migliorato nell’ultimo periodo. All’ingresso in
reparto discrete condizioni generali, peso 60.200 g, apiretico, SpO2
95% in aria ambiente, FC 104, PA 133/85. Erano presenti piccole
papule violacee al palmo delle mani, al torace sparsi sibili
espiratori, marcata ipotrofia muscolare soprattutto agli arti
inferiori con riflessi osteotendineii presenti e simmetrici. Gli
esami ematici confermavano un’ipereosinofilia (Eos 12.200/mm3),
con aumento degli indici di flogosi (PCR 7,86 mg/dl, VES 86 mm/h) e
dei livelli di IgE (2478 UI/ml).
In
considerazione del quadro caratterizzato dalla presenza di
un’ipereosinofilia accompagnata da marcata astenia con calo
ponderale abbiamo ritenuto opportuno escludere in prima istanza una
malattia linfoproliferativa. All’esame obiettivo non era
presente linfomegalia e inoltre la radiografia del torace e
l’ecografia addominale hanno negato la presenza di masse
toraciche o addominali.
Per
escludere una parassitosi sono stati eseguiti una ricerca per
parassiti sulle feci e la sierologia per Toxocara, Strongyloides,
Trichinella, ascaridi risultate negative.
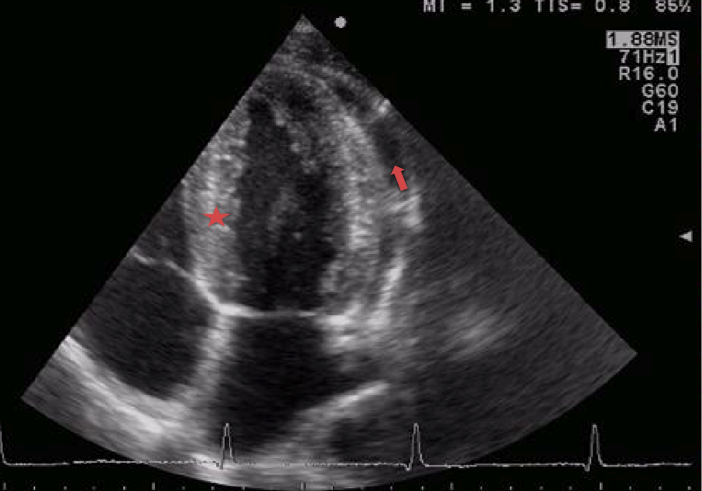
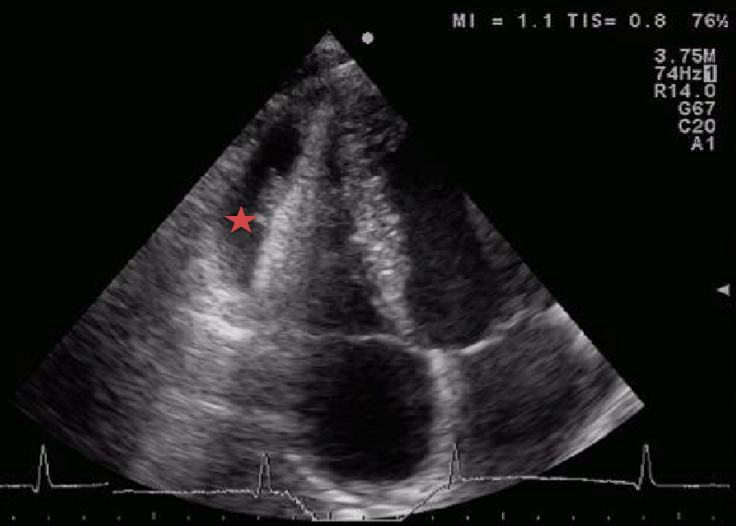
L’ecocardiografia
ha messo in evidenza un versamento pericardico non rilevante
emodinamicamente e una peri-miocardite (Figura
1 e Figura 2).
Le
spirometrie eseguite hanno dimostrato un quadro di importante
ostruzione bronchiale (FEV1 46%) solo parzialmente reversibile
con la terapia con salbutamolo (FEV1 65% del predetto post Beta2).
Vista la
necessità di escludere la presenza di un’infiltrazione
eosinofila nell’ambito di una malattia ipereosinofila
primitiva, abbiamo deciso di eseguire un aspirato midollare e una
biopsia cutanea. L’aspirato midollare non ha evidenziato
blasti né cellularità clonale. La ricerca del gene
di fusione FIP LI-PDGFRA, associato alle presenza di
ipereosinofilia primitiva, è risultata negativa. È
stata eseguita una biopsia cutanea a carico di cute integra e
a livello di una piccola papula violacea sul palmo della mano. Il
quadro istologico è risultato compatibile con una vasculite
eosinofila per la presenza di una flogosi eosinofila
perivascolare in entrambi i campioni esaminati. L’elettromiografia,
richiesta per la presenza di parestesie agli arti inferiori, ha
dimostrato un quadro di polineuropatia agli arti inferiori.
In
considerazione della presenza di un asma mal controllato e grave,
associato a ipereosinofilia con eosinofili extravascolari, di un
interessamento miocardico e vista la negatività dell’aspirato
midollare abbiamo confermato il sospetto diagnostico di sindrome di
Churg-Strauss. Per tale motivo Davide ha iniziato la terapia con
metilprednisolone ev al dosaggio di 60 mg/die e enalapril 2,5 mg/die.
Il
beneficio clinico è stato molto rapido, con normalizzazione
della pressione arteriosa e del quadro spirometrico; al controllo
degli esami ematici, eseguito dopo 3 giorni di terapia, si è
notata una normalizzazione dell’eosinofilia GB 11.450
(Eos 120/mm3).
Il
controllo cardiologico a pochi giorni dall’inizio della terapia
ha dimostrato una normalizzazione della disfunzione ventricolare
con riduzione del versamento pericardico.
La
diagnosi di sindrome di Churg-Strauss (CSS) si basa sulla presenza di
almeno 4 dei 6 criteri proposti dalla American College of
Rheumatology (ACR)1,2 (Tabella
I).
Classicamente
la diagnosi di CSS deve essere posta dopo l’esclusione di altre
cause di ipereosinofilia, sia secondarie (come la parassitosi
intestinale), sia primitive (sindromi ipereosinofiliche).
In
particolare una volte esclusa la parassitosi rimangono
sostanzialmente due importanti diagnosi differenziali: la
vasculite di Churg-Strauss o una sindrome ipereosinofila.
Entrambe si accompagnano a una marcata eosinofilia con sintomatologia
sistemica. La diagnosi differenziale tra queste due forme si basa
però su alcuni elementi caratteristici (Tabella
II).
A favore
dell’ipotesi di sindrome di Churg-Strauss vi erano al momento
del ricovero la presenza di una storia di asma e la verosimile
presenza di una mononeuropatia (parestesie e ipotrofia muscolare alle
gambe). La diagnosi è quindi stata confermata tramite
l’esecuzione dell’aspirato midollare, che ha permesso di
escludere un ipereosinofilia primitiva, e grazie al riscontro
bioptico di infiltrati eosinofili perivascolari.
Il
coinvolgimento cardiaco invece non rientra tra i criteri
internazionali per la definizione di CSS; tale manifestazione di
malattia è in realtà molto frequente (fino al 60% dei
casi in alcune casistiche4) e rappresenta la maggior causa
di mortalità (48% delle morti per CSS). Nel nostro caso il
coinvolgimento cardiaco, con pericardite e miocardite come descritto
in letteratura, ha rappresentato l’elemento fondamentale per
confermare la diagnosi. Alcuni Autori4, però,
sottolineano come non esista ancora una tecnica standardizzata per
verificare l’interessamento cardiaco e, inoltre alcune
casistiche enfatizzano la difficoltà ad attribuire un
significato prognostico preciso alle anomalie osservate5.
Un altro
aspetto importante del caso descritto è la negatività
degli anticorpi p-ANCA, associati al 40% delle forme di CSS. È
stato da tempo dimostrato che l’assenza dei p-ANCA caratterizza
un fenotipo di CSS nel quale vengono a mancare alcune caratteristiche
di malattia come gli infiltrati polmonari e l’interessamento
renale. Di contro nei casi ANCA negativi si osserva con maggior
frequenza un interessamento cardiaco e soprattutto la presenza di
sintomi sistemici all’esordio6. Alla luce
dell’esperienza di questo caso e visto i dati della letteratura
riteniamo che il coinvolgimento miocardico dovrebbe costituire uno
dei criteri per la diagnosi di CSS.
Da notare
inoltre come nel caso proposto l’asma non fosse riferito come
un sintomo importante a fronte di un rilievo di bronco-ostruzione
moderata-severa. È probabile che la sintomatologia sistemica
molto espressa (marcata astenia con ipotrofia muscolare), comportasse
una limitazione dell’attività fisica tale da mascherare
i sintomi respiratori.
La
terapia della CSS si basa sull’utilizzo di steroidi ad alto
dosaggio per almeno 3 settimane a dosaggio pieno (1 mg/kg/die) con
conseguente lento scalo1. Nei caso in cui vi sia un
interessamento grave d’organo (soprattutto a livello cardiaco)
è possibile ricorrere alla somministrazione di ciclofosfamide
per via endovenosa. Nei casi refrattari alla terapia viene suggerita
la plasmaferesi, l’utilizzo di immunoglobuline per via
endovenosa o di farmaci biologici (infliximab o rituximab). Per il
mantenimento della remissione possono essere utilizzati metotrexate,
azatioprina o ciclosporina. Nel nostro caso è stato deciso di
iniziare la terapia con azatioprina con lento scalo dello steroide.
Figura
1. Ecocardiografia a riposo. Aspetto iperlucente del miocardio
(stella), segno di miocardite, versamento pericardico (freccia).
CRITERI |
DEFINIZIONE |
|
Storia
di wheezing o sibili espiratori all’ascoltazione |
|
Valori
> 10% dei globuli bianchi totali |
|
Mononeuropatia
o polineuropatia attribuibili alla vasculite sistemica |
|
Infiltrati
migranti e non fissi alla radiografia (esclusi gli infiltrati
fissi) |
|
Storia
di dolore acuto o cronico ai seni paranasali e/o conferma
radiologica di opacità dei seni |
|
Biopsia
con evidenza di infiltrati eosinofili extravasali in
corrispondenza di arteriole, venule o arterie |
Tabella
I. Criteri ACR per la diagnosi di sindrome di Churg-Strauss. La
presenza di 4/6 criteri ha una sensibilità dell’85% e
una specificità del 99,7% per la diagnosi (da voce
bibliografica 2, modificata).
Manifestazioni
cliniche |
Sindrome
ipereosinofila |
Churg-Strauss
syndrome |
Coinvolgimento
cardiaco |
Fibrosi
endocardica e cardiomiopatia restrittiva |
Coinvolgimento
pericardico e miocardico |
Asma |
Raro |
Comune |
Sinusite |
Rara |
Comune |
Polineuropatia |
Rara |
Comune |
Coinvolgimento
cutaneo |
Orticaria |
Porpora,
orticaria |
Aumento
di VES |
Raro |
Comune |
Aumento
IgE |
Raro |
Comune |
Vasculite
confermata biopticamente |
Raro |
Presente
|
p-ANCA
|
Assenti |
Presenti
nel 40% dei casi |
Tabella
II. Elementi di diagnosi differenziale tra sindrome di
Churg-Strauss e sindrome ipereosinofila primitiva (da voce
bibliografica 3).
1. Masi
AT, Hunder GG, Lie JT et al. The American College
of Rheumatology 1990 criteria for the classification of Churg-Strauss
syndrome (allergic granulomatosis and angiitis). Arthritis Rheum
1990;33:1094-00.
2.
Jennette JC, Falk RJ, Andrassy K, et al.
Nomenclature of systemic vasculitides. Proposal of an international
consensus conference. Arthritis Rheum 1994;37:187-92.
3.
Baldini C, Talarico R, Della Rossa A.
Clinical manifestations and treatment of Churg-Strauss syndrome.
Rheum Dis Clin North Am 2010;36:527-43.
4.
Pagnoux C, Guilpain P, Guillevin L.
Churg-Strauss syndrome. Curr Opin Rheumatol 2007;19:25-32.
5.
Pelà G, Tirabassi G, Pattoneri P.
Cardiac involvement in the Churg-Strauss syndrome. Am J Cardiol
2006;97:1519-24.
6.
Pagnoux C, Guillevin L. Churg-Strauss
syndrome: evidence for disease subtypes? Curr Opin Rheumatol
2010;22:21-8.
Vuoi citare questo contributo?