Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Febbraio 2001 - Volume IV - numero 2
M&B Pagine Elettroniche
Il punto su
Il
sistema immune
(Parte
quinta)
- 1° parte: la risposta immune
- 2° parte: i recettori per l'antigene e la selezione clonale
- 3° parte: risposte immuni acquisite B e T
- 4° parte: linfociti e tessuto linfoide
- 5° parte: i linfociti T e la regolazione della risposta immune
(da
Delves PJ e Roitt IM - N Engl J Med 343, 108-17, 2000)
Funzioni
effettrici delle cellule T
Le
cellule T CD4+ sono cellule che principalmente secernono citochine,
mentre le cellule T CD8+ sono cellule principalmente di tipo
citotossico. Le cellule T CD4+ helper del tipo 1 (Th1) secernono
interleuchina-2 e interferon gamma, ma non interleuchina 4, 5 o 6. Le
cellule T CD4+ helper del tipo 2 secernono interleuchina 4, 5, 6 e
10, ma non interleuchina 2 o interferon gamma (Vedi Figura 10).
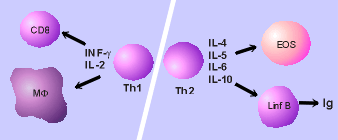
fig
10
Le
citochine hanno un ruolo centrale nell'influenzare il tipo di
risposta immune necessaria per la migliore protezione contro
particolari tipi di agenti infettivi; esse possono inoltre ridurre le
risposte allergiche e autoimmunitarie. Per esempio, la liberazione
d'interleuchina-12 da parte delle cellule presentanti l'antigene,
stimola la produzione d'interferon gamma (l'interferon immune) da
parte delle cellule Th1.Questa citochina attiva fortemente i
macrofagi, trasformandoli in organismi attivi per l'uccisione
intracellulare dei batteri. La produzione di citochine dalle cellule
Th1 facilita d'altra parte l'immunità cellulo-mediata, inclusa
l'attivazione dei macrofagi e la citotossicità, mediata dalle
cellule T, mentre le cellule Th2 aiutano le cellule B a produrre
anticorpi.
L'eliminazione
delle cellule infettate da un virus spetta alle cellule T CD8
citotossiche. La cellula infettata segnala se stessa alla cellula T
citotossica, disponendo sulla sua superficie peptidi, originati dalle
proteine virali intracellulari. Questi peptidi virali sono legati
alle regioni, leganti i peptidi, delle molecole MCH di classe I. Le
cellule T citotossiche si legano al complesso peptide virale-MHC e
uccidono le cellule infettate con due diversi meccanismi:
a) esse
possono inserire perforine nella membrana delle cellule
bersaglio: questa sostanza produce pori attraverso i quali enzimi
proteolitici (granzimi) passano dalla cellula T citotossica
alla cellula bersaglio. Almeno uno di questi enzimi proteolitici
attiva l'enzima caspase, che media l'apoptosi nella cellula bersaglio
b) le
cellule T citotossiche possono legarsi alla molecola Fas sulla
cellula bersaglio usando la ligandina Fas, un processo che attiverà
le caspasi nella cellula bersaglio e infine l'apoptosi.
Queste
strategie di uccisione non solo sottraggono al virus gli enzimi
dell'ospite, necessari per la sua moltiplicazione, ma anche
impediscono la creazione di un santuario all'interno della cellula.
D'altra parte ogni virus che si venga a liberare è
immediatamente suscettibile agli effetti degli anticorpi.
Oltre che
agire in senso killing direttamene sulle cellule infettate, le
cellule CD8+ producono numerose citochine, incluso il fattore di
necrosi tumorale a e la linfotossina. Anche l'interferon g, prodotto
dalle cellule CD8+, rinforza le difese antivirali, rendendo le
cellule adiacenti, resistenti all'infezione. In minor estensione, le
cellule CD4+, sia della popolazione Th1 che Th2, possono divenire
citotossiche riconoscendo i peptidi presentati dalle molecole MHC di
classe II.
Il
riarragiamento dei geni del recettore delle cellule T non avviene
nella maggior parte delle cellule natural killer e queste cellule non
esprimono recettori specifici per le cellule T. Esse usano recettori
ad ampio spettro, meno specifici, per identificare le cellule
bersaglio nelle risposte immuni innate citotossiche.
Protezione
immune da parte di anticorpi
Quando le
cellule B hanno subito la differenziazione finale in plasmacellule,
esse acquisiscono la capacità di secernere alti livelli di
anticorpi. Questi anticorpi possono essere direttamente protettivi,
perché inibiscono il legame di un microrganismo o di una
tossina al corrispondente recettore cellulare. Nella maggior parte
dei casi tuttavia l'anticorpo non funziona da solo, ma come uno dei
tanti componenti del sistema immune contro l'agente invasore.
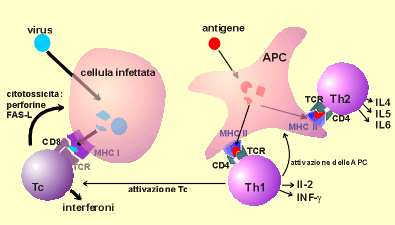
Figura
n.11 - Le risposte del linfocita
Le
cellule T posseggono i recettori (TCRs) che riconoscono l'antigene
elaborato, presentato dalle molecole del complesso maggiore
d'istocompatibilità (MHC), come si osserva sul lato sinistro
della figura. La maggior parte delle cellule T citotossiche, positive
per il CD8, riconoscono gli antigeni elaborati, presentati dalle
molecole MHC di classe I e uccidono le cellule infettate,
interrompendo in tal modo la moltiplicazione virale. Le cellule T
citotossiche attivate secernono interferon gamma, insieme a
interferon alfa e interferon beta, per conferire uno stato di
resistenza all'infezione virale. Come si osserva sul lato destro
della figura, le cellule T helper sono generalmente positive per il
CD4, riconoscono l'antigene elaborato presentato dalle molecole MHC
di classe II e possono essere suddivise in due principali
popolazioni. Le cellule T helper tipo 1 (Th1) secernono interferon
gamma e interleuchina-2, che attiva i macrofagi e le cellule T
citotossiche a uccidere gli agenti intracellulari. Le cellule T
helper tipo 2 (Th2) secernono interleuchina 4, 5 e 6, che aiutano le
cellule B a secernere anticorpi protettivi. Le cellule B riconoscono
l'antigene sia direttamente che in forma di complessi immuni sulle
cellule dendritiche dei follicoli nei centri germinali.
La via
classica di attivazione del complemento inizia con il contatto
stretto del suo primo componente, il C1q, con le regioni Fc delle IgM
e delle IgG sulla superficie di una cellula. Il legame di queste
regioni con C1q porta alla generazione del C3b e di altri componenti
biologicamente attivi del complemento. L'intensa fagocitosi in
presenza di anticorpi antibatterici IgM o IgG può avvenire
attraverso il legame del C3g, formato di nuovo, con i recettori dei
neutrofili e dei macrofagi.
In
assenza di complemento, i microrganismi, ricoperti di anticorpi IgG,
IgA o IgE, si legano ai corrispondenti recettori Fc presenti sulla
cellula fagocitica. Gli anticorpi IgG e IgE possono mediare l'effetto
citotossico cellulare anticorpo-dipendente, un processo killing
extracellulare nel quale le cellule che posseggono recettori Fc per
questa classe di anticorpi si legano alle cellule bersaglio, coperte
di anticorpi, o ai parassiti. Le cellule natural killer, i monociti,
i macrofagi e i neutrofili possono tutti avere una funzione
citotossica cellulare IgG mediata, anticorpo-dipendente. I macrofagi,
gli eosinofili e le piastrine sono interessati invece alla
citotossicità cellulare IgE mediata anticorpo dipendente. I
meccanismi citotossici, che entrano in gioco quando le cellule
bersaglio sono troppo grandi per la fagocitosi, sono le perforine, i
granenzimi e in alcuni casi gli intermediari ossidativi.
I
soggetti adulti sintetizzano ogni giorno dai 3 ai 4 grammi di IgA
secretorie, nella saliva, nel colostro, e in altri liquidi. Esse sono
sintetizzate dalle plasmacellule, che si ritrovano al di sotto della
superficie mucosa e sono trasportate, attraverso l'epitelio, dai
recettori Fc poli-immunoglubulinici. Questi anticorpi prevengono
l'adesione dei microrganismi alla superficie della cellula ospite.
Un
secondo tipo di recettori cellulari Fc, i recettori FcRn, ha numerose
altre funzioni, come il trasferimento delle IgG materne attraverso la
placenta.
Questi
meccanismi offrono un'importante protezione al feto, prima che il suo
sistema immune sia completamente sviluppato. I recettori FcRn inoltre
trasferiscono particolarmente le IgG del latte umano (che contengono
anche IgA e IgM) attraverso l'epitelio intestinale del neonato.
Regolazione
della risposta del sistema immune
Una
risposta immune efficace elimina l'antigene che l'ha prodotta e
quindi, si sbarazzata dello stimolo che l'ha indotta e torna ai
livelli quasi basali. Oltre che allontanare l'antigene, il sistema
immune impiega molti altri meccanismi per regolare la sua attività.
Le IgG stesse possono cambiare la risposta al loro corrispondente
antigene, con un processo analogo all'ansa feedback negativa,
caratteristica del sistema endocrino. Esse cioè possono
sopprimere la produzione di IgG quando il recettore FcgR e il
recettore della cellula B sulla stessa cellula, siano legati a un
complesso immune, contenente l'antigene specifico. Ne risultano
segnali inibitori sul nucleo della cellula B.
Le
citochine e la loro importanza clinica
Citochine | Origine
cellulare | Attività
principali | Importanza
clinica |
Interleuchina-1 | Macrofagi | Attivazione
delle cellule T e dei macrofagi, promozione dell'infiammazione | Implicata
nella patogenesi dello shock settico, nell'artrite reumatoide e
nell'arteriosclerosi |
Inteleuchina-2 | Cellule
T helper tipo 1 (Th1) | Attivazione
dei linfociti, delle cellule natural killer e dei macrofagi | Usata
per indurre le cellule killer attivate dalla linfochina; usata
nel trattamento del carcinoma renale metastatico, del melanoma e
di altri tumori |
Interleuchina-4 | Cellule
T helper tipo 2 (Th2), mast-cell, basofili, eosinofili | Attivazione
dei linfociti, monociti e passaggio alla classe IgE | Per
la sua capacità di stimolare la produzione di IgE . gioca
una parte nella sensibilizzazione delle mast-cell e così
nell'allergia e nella difesa contro i nematodi |
Interleuchina-5 | Cellule
T helper tipo 2 (Th2), mast-cell, basofili, eosinofili | Differenziazione
degli eosinofili | L'anticorpo
monoclonale contro l'interleuchina 5 è usato per inibire
l'eosinofilia antigene-indotta della fase latente dell'allergia
nei modelli animali |
Interleuchina-6 | Cellule
T helper tipo 2 (Th2), mast-cell, macrofagi | Attivazione
dei linfociti, differenziazione delle cellule B, stimolazione
delle proteine della fase acuta | Prodotta
in eccesso nella malattia di Castelman; agisce come un fattore di
crescita autocrino nel mieloma e nella GN proliferativa
mesangiale |
Interleuchina-8 | Cellule
T e macrofagi | Chemiotassi
dei neutrofili, basofili e cellule T | I
livelli sono aumentati nelle malattie accompagnate da
neutrofilia, tanto da farne un indicatore, potenzialmente utile
della attività della malattia |
Interleuchina-11 | Cellule
stromali del midollo osseo | Stimolazione
della produzione di proteine della fase acuta | Usata
per ridurre la trombocitopenia indotta dai chemioterapici nei
pazienti con cancro |
Interleuchina-12 | Macrofagi
e cellule B | Stimolazione
della produzione di interferon- gamma da parte delle cellule Th1
e da parte delle cellule natural killer; induzione delle cellule
Th1 | Può
essere utile come adiuvante dei vaccini |
Tumor
necrosis factor alfa | Macrofagi,
cellule natural killer, cellule T, cellule B e mast cell | Promozione
dell'infiammazione | Il
trattamento con anticorpi contro il tumor necrosis factor alfa è
utile nella artrite reumatoide |
Linfoctossina
(tumor necrosis factor beta) | Cellule
Th1 e cellule B | Promozione
dell'infiammazione | Implicata
nella patogenesi della sclerosi multipla e nel diabete mellito
insulino-dipendente |
Fattore
beta di crescita trasformante | Cellule
T, macrofagi, cellule B, mast cell | Immunosoppressione | Può
essere utile nella scelrosi multipla e nella miastenia grave |
Fattore
stimolante le colonie dei granulociti e dei macrofagi | Cellule
T, macrofagi, cellule natural killer, cellule B | Promozione
della crescita dei granulociti e dei monociti | Usato
per ridurre la neutropenia dopo chemioterapia per tumori e nei
pazienti trattati con ganciclovir con AIDS; usato per stimolare
la produzione cellulare dopo trapianto di midollo |
Interferon-alfa | Cellule
infettate da virus | Induzione
di resistenza da parte delle cellule con infezione virale | Usato
per trattare il sarconma di Kaposi, collegato all'AIDS, il
melanoma, infezione cronica da virus dell'epatite B e
l'infezione cronica da virus dell'epatite C |
Interferon-beta | Cellule
infettate da firus | Induzione
di resistenza da parte delle cellule con infezione virale | Usato
per ridurre la frequenza e la gravità delle ricadute di
sclerosi multipla |
Interferon-gamma | Cellule
Th1 e cellule natural killer | Attivazione
dei macrofagi; inibizionedelle cellule Th2 | Usato
per aumentare l'uccisione dei batteri fagocitati nella malattia
granulomatosa cronica |
Le
citochine partecipano a un altro livello del sistema regolatorio. Per
esempio la secrezione di interferon-gamma da parte delle cellule Th1
inibisce le cellule Th2, mentre la secrezione d'interleuchina-10 da
parte delle cellule Th2 inibisce al contrario le cellule Th1. Le
sfruttamento di queste interazioni regolatorie fra sottogruppi delle
cellule T può portare a nuove prospettive terapeutiche per il
trattamento di molte malattie. Per esempio la secrezione
d'interluchina-4 da parte delle cellule Th2 stimola la produzione di
IgE: ciò permette di cambiare la risposta verso il tipo Th1
per migliorare l'atopia.
L'immunoregolazione
interessa anche l'interazione del sistema immune con i sistemi
endocrino e nervoso, con un rapido scambio fra questi sistemi sulla
base di ormoni, citochine e neurotrasmettitori.
Tecnologia
immunologica
L'uso
nelle ricerche d'immunologia di topi nei quali particolari geni sono
espressi (transgenic mice) o eliminati (knockout mice)
ha permesso di chiarire molti punti oscuri. La capacità di
creare topi transgenici e topi con delezione di alcuni geni ha
portato allo sviluppo di modelli animali di malattie autoimmuni e da
immunodeficienza.
La
fortissima specificità della molecola dell'anticorpo è
stata usata nella maggior parte delle aree della biomedicina. Molti
anticorpi monoclonali, clinicamente utili, sono stati usati in
moltissime circostanze. Con l'uso di tecniche DNA ricombinanti questi
anticorpi possono essere "umanizzati" rimpiazzando la
maggior parte delle sequenze aminoacidiche, presenti nei roditori con
sequenze umane. Soltanto gli aminoacidi che vengono in contatto con
l'antigene debbono necessariamente mantenere le sequenze,
caratteristiche dei roditori.
La
tecnologia DNA ricombinante può essere usata anche per creare
una biblioteca, contenente milioni di batteriofagi, ognuno
caratterizzato da un differente anticorpo dotato di una singola
specificità sulla sua superficie e contenente i geni per la
sintesi dell''anticorpo. Quando i contenuti di questa biblioteca
saranno riversati su dischi di plastica, coperti di antigeni, i fagi
caratterizzati dal relativo anticorpo si legheranno all'antigene e
quelli che non si legheranno verranno lavati via. Questa tecnica
permette all'anticorpo, della specificità desiderata, di
essere scelto dalla biblioteca e i geni codificanti le regioni
variabili possono essere usati per produrre grandi quantità di
anticorpi ricombinanti praticamente di qualsiasi specificità
si voglia. L'uso delle biblioteche di fagi, costruite da geni degli
anticorpi umani, costituiti da una catena pesante e da una catena
leggera, porteranno a una diretta selezione degli anticorpi umani per
uso terapeutico, per esempio verso antigeni associati a tumori o
antigeni come il CD4. Se necessario, singoli aminoacidi possono
essere sostituiti nei siti leganti per aumentare l'affinità
dell'anticorpo.
Gli
anticorpi possono essere identificati con enzimi, fluorocromi o
isotopi per usarli in un ampio spettro di applicazioni cliniche,
incluse prove immunoenzimatiche, fenotipizzazioni diagnostiche,
istochimica, immagini in vivo e immunoterapia. Se l'obiettivo è
la stessa molecola di anticorpo (per esempio per misurare anticorpi
in pazienti con malattie autoimmunitarie), può essere
utilizzata un'anti-globulina marcata (anticorpo secondario). Per
applicazioni terapeutiche nei confronti di cellule tumorali, gli
anticorpi possono essere coniugati con molecole citotossiche per
produrre immunotossine.
Senza
dubbio queste diverse modalità d'impiego hanno allargato
fortemente l'armamentario di ricerca, diagnostico e terapeutico degli
immunologi e dei clinici.
Vuoi citare questo contributo?
