Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Gennaio 2021 - Volume XXIV - numero 1
M&B Pagine Elettroniche
Ricerca
OctoberFAST. Ovvero: segni e sintomi dei bambini sottoposti a tampone per SARS-CoV-2 nell’esperienza dei pediatri bergamaschi
1Pediatra di famiglia, ATS Bergamo; 2Dottore in Matematica
Indirizzo per corrispondenza: romeo.carrozzo@crs.lombardia.it
Relevance of symptoms in paediatric Primary Care to drive SARS-CoV-2 swab-test prescription: outcomes from the “OctoberFAST” survey in the Province of Bergamo, Italy
Key words: Molecular swab test, SARS-CoV-2, Symptoms, Covid-19, Paediatric Primary Care
Abstract
Background - From the beginning of the SARS-CoV-2 outbreak one major issue has been the early identification of infectious cases. It is particularly challenging to perform a symptom-based screening in the paediatric population because of the seeming overlap of early clinical manifestations between Covid-19 and other common viral infections.
Aims - This study was aimed to assess the likelihood that clinical scenarios driving to the SARS-CoV-2 molecular swab test (SMST) might be suggestive for Covid-19 in children.
Materials and methods - A survey was proposed to the family paediatricians of the Province of Bergamo (Italy). For all the patients referred for SMST due to symptoms in the period 28/Sep/2020 - 31/Oct/2020, the request was to gather the following data: symptoms, outcome of the SMST, school level, and period between onset of symptom/s and SMST. Data were centralised in anonymous format, making use of pivot-table with aggregate data for final statistical analysis.
Results - Data were exploitable for 75 family paediatricians, for a total 3,093 SMST. SMST were positive in 119 cases (3.85%). The rate of SMST positivity was: 1) higher when the interval between symptoms and SMST was shorter than 24h; 2) slightly higher at middle school vs. pre-school or elementary school. Among the observed symptoms, a robust positive association with SMST positivity was observed (OR = 7.77) with a high PPV (22.5%) only for anosmia/ageusia.
Conclusion - Although this study detected a few more suggestive signs/symptoms for Covid-19 with respect to other common viral illnesses, a symptom-based screening for SARS-CoV-2 appears less effective to flush out the virus in children. The estimation of the pre-test probability should also rely on the concurrent evaluation of the epidemiological setting.
Riassunto
Razionale - Sin dall’inizio della pandemia da SARS-CoV-2, uno dei principali problemi è stata l’identificazione precoce dei soggetti positivi. Uno screening basato sui sintomi risulta di difficile applicazione in età pediatrica, a causa della apparente sovrapposizione tra i sintomi iniziali del Covid-19 e quelli delle comuni malattie virali.
Obiettivi - Scopo di questo studio era la valutazione della probabilità che gli scenari clinici che hanno indirizzato all’esecuzione del test molecolare per SARS-CoV-2 (SMST) potessero risultare suggestivi di Covid-19 in una popolazione pediatrica.
Materiali e metodi - È stato proposto un sondaggio ai pediatri di famiglia (PdF) della Provincia di Bergamo, in cui si chiedeva di raccogliere dati relativi a tutti i pazienti sintomatici sottoposti a SMST nel periodo dal 28 settembre 2020 al 31 ottobre 2020. In particolare erano richiesti: sintomi, esito del SMST, età scolare, periodo intercorso fra esordio del/i sintomo/i e SMST. I dati sono stati centralizzati in forma anonima, facendo uso di tabelle-pivot con dati aggregati per l’analisi statistica finale.
Risultati - È stato possibile analizzare dati completi per 75 PdF, per un totale di 3093 SMST effettuati, di cui positivi 119 (3,85%). Il tasso di positività al SMST era: 1) più elevato quando il tempo intercorso fra esordio dei sintomi ed effettuazione del SMST era inferiore alle 24 ore; 2) leggermente più alto alle scuole medie rispetto alle età prescolare oppure elementare. Dei sintomi osservati, soltanto anosmia/ageusia hanno fatto rilevare un’associazione positiva robusta (OR = 7,77) con la positività del SMST, con un alto PPV (22,5%).
Conclusioni - Benché lo studio abbia identificato alcuni segni/sintomi maggiormente suggestivi per Covid-19, i nostri dati indicano i limiti di uno screening basato esclusivamente su elementi clinici e suggeriscono di considerare contestualmente il ruolo del quadro epidemiologico nella valutazione della probabilità pre-test.
Introduzione
La malattia da coronavirus-19 (Covid-19) colpisce prevalentemente gli adulti, mentre i bambini risultano in prevalenza asintomatici o affetti da quadri clinici meno gravi1,2. Le incertezze relative alla suscettibilità e alla trasmissibilità del virus nella popolazione pediatrica hanno spinto il Governo italiano, mediante il DPCM del 4 marzo 2020, a imporre la chiusura della didattica in presenza per tutte le scuole e i Servizi educativi per l’infanzia, protrattasi per tutto l’anno scolastico 2019-2020. Alla riapertura delle scuole, il DPCM del 7 settembre 2020 ha indicato delle misure operative volte alla gestione dei casi di focolai di SARS-CoV-2 in sede scolastica. L’allegato D del Decreto3 contiene una lista di sintomi suggestivi della malattia, con lo scopo di identificare i bambini da porre in isolamento e da sottoporre a valutazione medica, propedeutica all’esecuzione dei test di laboratorio. Davanti a queste indicazioni, un gruppo di pediatri di famiglia (PdF) della Provincia di Bergamo ha avvertito l’esigenza di identificare dei criteri clinici più specifici che indirizzassero all’esecuzione del test molecolare per SARS-CoV-2 (SMST), in considerazione del comune reperto di sintomi simil-influenzali nella popolazione pediatrica. Gli Autori hanno definito degli obiettivi che potessero essere facilmente raggiunti attraverso un sondaggio, cui è stato dato il nome di OctoberFAST, al fine di raccogliere e analizzare rapidamente dei dati anonimi provenienti dal lavoro dei PdF della Provincia di Bergamo. Lo studio aveva l’obiettivo di valutare la capacità di segni/sintomi di identificare soggetti affetti da Covid-19 in una popolazione pediatrica afferente alla collettività scolare.
Metodi
Gli Autori hanno invitato via e-mail 117 PdF della Provincia di Bergamo a partecipare al sondaggio OctoberFAST, informandoli circa gli obiettivi e i metodi dello studio. Ai PdF che hanno aderito (86 su 117, 73,5%) è stata inviata una griglia dati in formato elettronico, precedentemente testata da tutti gli Autori, per organizzare la raccolta dei dati richiesti. Contestualmente è stato anche inviato un tutorial per favorire la raccolta dei dati in modo omogeneo.
Il compito assegnato ai PdF era quello di compilare la propria griglia, indicando - per ogni paziente sintomatico inviato a eseguire un SMST - la presenza o meno di uno o più fra i seguenti sintomi: tosse, dispnea, rinorrea/congestione nasale, faringodinia, vomito/diarrea, congiuntivite, mialgia/cefalea, anosmia/ageusia, febbre ≥ 37,5 °C (il simbolo “/” indica “uno o entrambi”).
È stato esplicitamente chiesto ai PdF di escludere dal sondaggio i dati di tutti i SMST effettuati a pazienti asintomatici (contatti di caso, rientranti da zone a rischio, controllo in pregressa positività, ricovero ospedaliero in elezione).
Le maggiori variabili da tracciare erano l’esito del SMST (positivo o negativo) e i sintomi che hanno indirizzato alla richiesta del SMST. Altre variabili richieste erano: a) scuola frequentata: prescolare (età 1-5 anni), elementari (età 6-10 anni), medie (età 11-13 anni); b) tempo intercorso fra l’insorgenza dei sintomi e l’effettuazione del SMST (meno di 24 ore; più di 24 ore).
Inoltre, ai PdF partecipanti era richiesto di riportare il numero totale dei propri assistiti e il loro distretto di appartenenza (Bergamo-Est, Bergamo-Ovest, Bergamo-Città).
Il sondaggio prevedeva di raccogliere esclusivamente i dati dei SMST effettuati nel periodo dal 28 settembre 2020 al 31 ottobre 2020. Tutti i SMST sono stati effettuati presso i Punti tampone-scuola allestiti in Provincia di Bergamo, processati con tecnica reverse transcriptase - polymerase chain reaction (RT-PCR).
Al termine del periodo indice ogni PdF partecipante, identificabile con un codice alfanumerico, è stato istruito (attraverso un secondo tutorial e con supporto di uno fra gli Autori) a trasformare la propria griglia in una tabella-pivot di dati aggregati, per rendere anonimi i dati prima di trasferirli agli Autori. Dopo aver centralizzato tutte le 86 tabelle-pivot anonime, gli Autori hanno unanimemente deciso di non processarne 11, a causa di dati non valutabili (perché incompleti, oppure irrecuperabili o non affidabili).
Il database finale consisteva delle rimanenti 75 tabelle-pivot in aggregato, complete e affidabili. Questo database è stato quindi utilizzato per tutte le analisi statistiche.
Lo studio è stato condotto in conformità al Codice Etico della World Medical Association (Dichiarazione di Helsinki) per la sperimentazione che coinvolge esseri umani4.
Analisi statistica
Il valore predittivo positivo (PPV) è stato calcolato per ciascun sintomo e per gli scenari clinici più frequenti che hanno determinato l’indicazione al SMST (sintomi isolati o in combinazione). Se denotiamo con SP il numero dei pazienti con sintomo e SMST positivo, con SN il numero dei pazienti con sintomo e SMST negativo, con nSP il numero dei pazienti con SMST positivo ma senza il sintomo, e con nSN il numero dei pazienti con SMST negativo ma senza il sintomo, il PPV di un sintomo è definito come SP/(SP + SN): questo valore dà una stima della probabilità di essere positivi al SMST data la presenza di quel sintomo. L’intervallo di confidenza (CI) al 95% per questa probabilità è stato calcolato con metodo di Wilson per aver migliori probabilità di copertura e robustezza. Quando SP = 0 è stata utilizzata la rule of three.
Per ogni sintomo è stato eseguito il test chi quadrato di indipendenza con livello di significatività 0,05 per determinare la presenza/assenza di dipendenza statistica tra le due variabili categoriche “presenza di un dato sintomo” e “positività al SMST” sull’intera popolazione sintomatica. Il test non è stato eseguito, poiché inappropriato, ogniqualvolta il conteggio in una delle celle della tabella di contingenza per le suddette variabili era < 5.
Per i sintomi che presentavano dipendenza secondo il test sono state calcolate due metriche di associazione: l’Odds Ratio (OR) e la Risk Difference (RD). Gli stimatori da campione per questi indici sono stati calcolati come segue: a) per OR come (SP/SN)/(nSP/nSN); OR assume valore da 0 a + ∞ e le variabili sono associate positivamente se OR > 1, negativamente se OR < 1; b) per RD come SP/(SP+SN) - nSP/(nSP+nSN); RD assume valore da -1 a 1 e le variabili sono associate positivamente se RD > 0, negativamente se RD < 0. Gli CI al 95% sono stati calcolati per i valori effettivi di OR e RD.
Per ogni sintomo è stata calcolata - stratificandola anche in base all’età scolare - la percentuale SP/(SP + nSP) come stima della probabilità di presentare il sintomo data la positività del SMST. Sono stati infine calcolati gli intervalli di confidenza di Wilson al 95% per questa probabilità. Quando SP = 0 è stata utilizzata la rule of three.
Risultati
I dati derivanti dalle tabelle-pivot validate (75 PdF) si riferiscono a un totale di 70.948 assistiti (media: 946 pazienti per PdF). Sono stati globalmente effettuati 3093 SMST (media: 41,24 SMST per PdF). Ciò significa che il 4,36% degli assistiti è stato sottoposto a SMST su base sintomatica (soltanto un numero trascurabile di pazienti ha eseguito due tamponi nel periodo di osservazione).
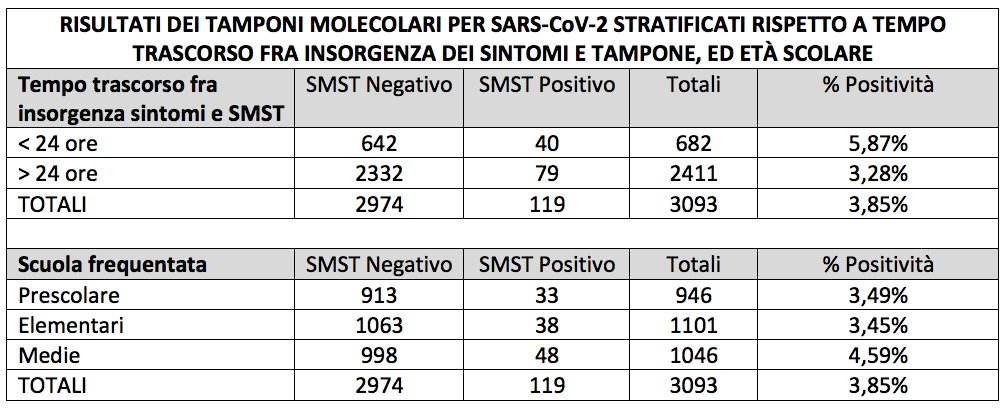
Il tasso globale di positività al SMST è stato pari a 119/3093 = 3,85%. Il tasso di positività al SMST era: 1) più elevato quando il tempo intercorso fra sintomi e SMST era inferiore alle 24 ore (40/682 = 5,87%) rispetto a tempi oltre le 24 ore (79/2411 = 3,28%); 2) confrontabile fra le età prescolare (33/946 = 3,49%) ed elementare (38/1101 = 3,45%), leggermente più alto alle scuole medie (48/1046 = 4,59%) (Tabella I). Osservando i risultati stratificati per distretto, è interessante sottolineare come sia stato rilevato un tasso di positività più elevato nel distretto Bergamo-Ovest (5,78%), il meno colpito dalla prima ondata della pandemia, rispetto a quelli dei distretti Bergamo-Est (2,14%) e Bergamo-Città (1,19%).
Per comprendere l’impatto generale dei sintomi sulla positività dei SMST, è stato calcolato il PPV di ogni sintomo (CI 95%). Ogni sintomo è stato testato per l’indipendenza (test del chi-quadro) vs negatività/positività del SMST: per tutti i sintomi negativi al test di indipendenza, è stata calcolata la potenziale associazione fra la presenza dei sintomi e la positività SMST in termini di OR e RD, entrambe con CI al 95%. La RD è stata valutata accanto alla OR per poter considerare l’entità dell’incidenza di SARS-CoV-2 nella popolazione pediatrica sintomatica. La Tabella II riporta l’esito di questa analisi effettuata su tutto il campione: l’anosmia/ageusia è stata l’unica manifestazione clinica che ha mostrato una robusta associazione positiva (OR = 7,77), con un alto PPV (22,5%). Un’associazione positiva debole è stata riscontrata per mialgia/cefalea (OR = 1,65), con un PPV pari a 5,64%. Da notare che rinorrea e tosse, comunemente motivo di accesso all’ambulatorio pediatrico del territorio, sono talmente poco sensibili (cioè presenti in molte infezioni infantili) al punto da avere un’associazione negativa anche se debole (OR = 0,56 e OR = 0,66 rispettivamente) con la positività al SMST.
Stratificando i medesimi dati per età è risultata un’associazione positiva solo per la dispnea nei bambini in età prescolare (OD = 4,46), per la febbre in quelli delle scuole elementari (OD = 2,29) e per l’anosmia/ageusia per i ragazzi delle scuole medie (OD = 8,35) (Tabella III).
Nel tentativo di identificare pattern suggestivi di infezione da SARS-CoV-2 nei bambini con malattia acuta, abbiamo calcolato il PPV per l’esito positivo del tampone negli scenari clinici più frequenti (con sintomi isolati o associati) che avessero indirizzato all’esecuzione del SMST (Tabella IV): nessuno di questi scenari ha fatto osservare PPV significativi.
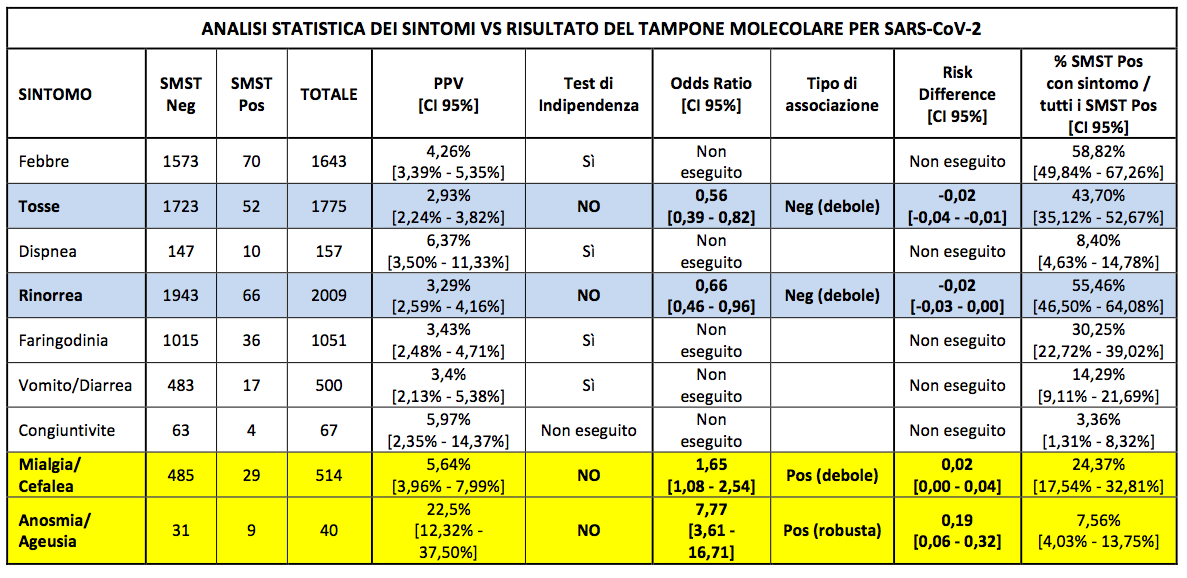
Le righe colorate rappresentano sintomi con esito negativo del test di indipendenza: in giallo le associazioni positive, in azzurro le associazioni negative.
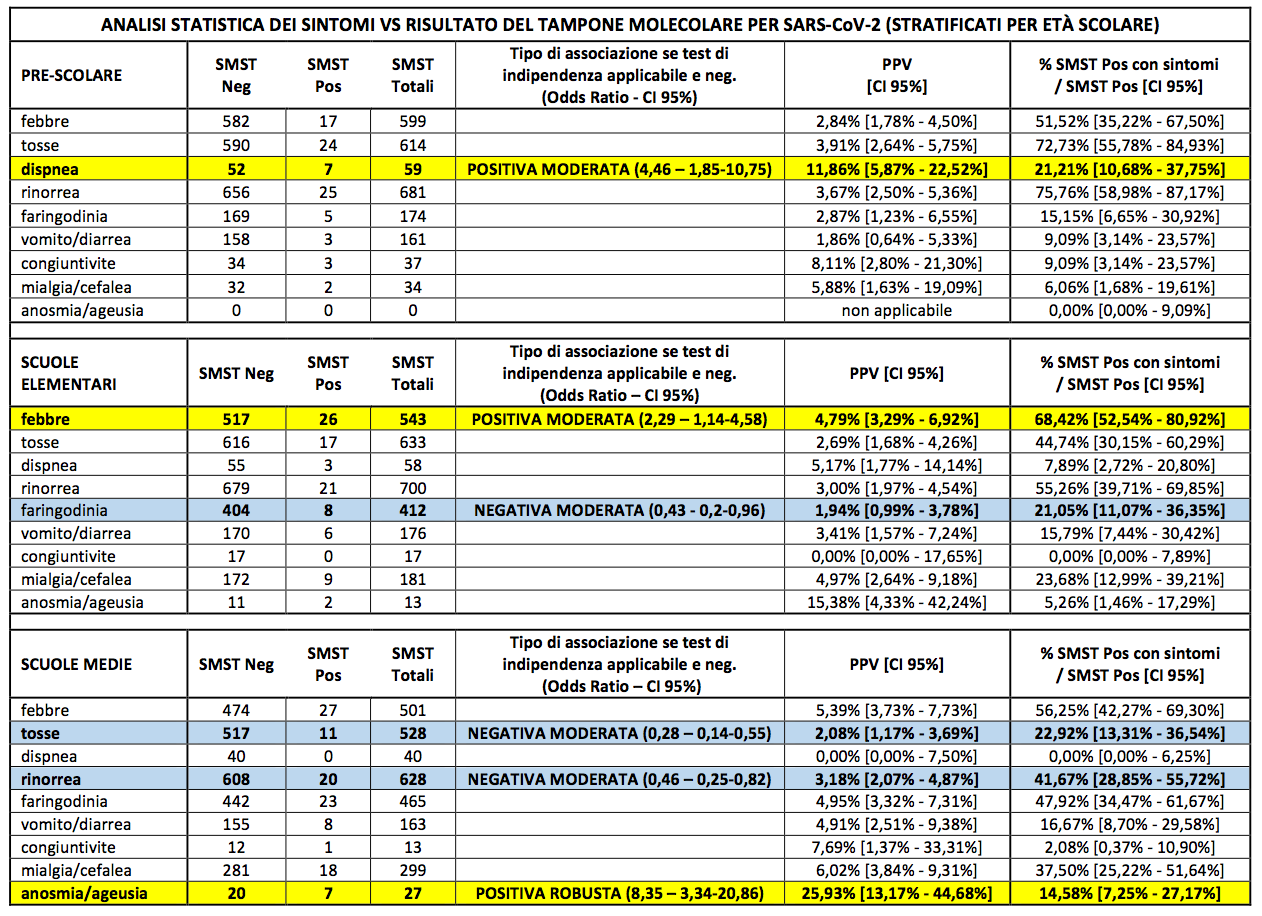
Le righe colorate rappresentano sintomi con esito negativo del test di indipendenza: in giallo le associazioni positive, in azzurro le associazioni negative.
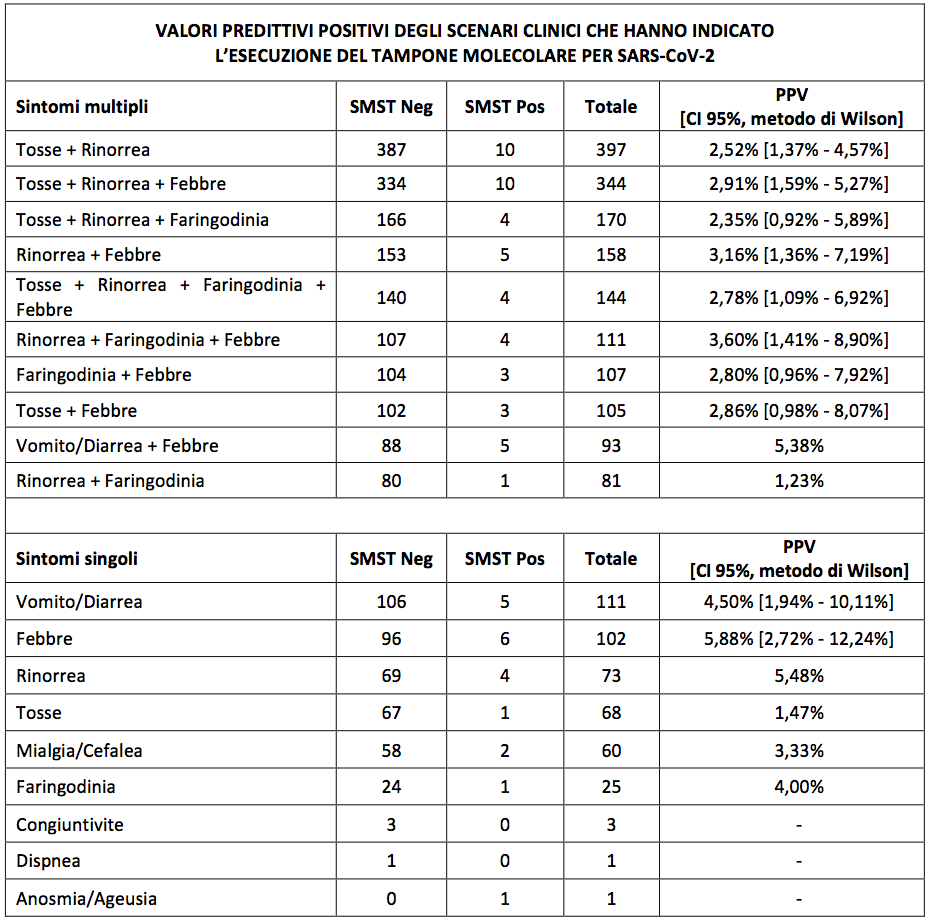
Gli intervalli di confidenza sono stati calcolati per i dieci scenari clinici più frequenti. Quanto ai sintomi multipli, sono riportati soltanto gli scenari più frequenti.
Discussione
In questo studio descriviamo l’incidenza dei sintomi in bambini frequentanti nidi, scuole dell’infanzia, scuole elementari e medie inferiori nella provincia di Bergamo che, nel mese di ottobre 2020, presentavano un’indicazione clinica all’esecuzione di un SMST. Per questi casi abbiamo confrontato la distribuzione e le manifestazioni cliniche relativamente all’esito del tampone.
Il nostro sondaggio indica che il 3,85% dei bambini che manifestavano almeno un segno clinico suggestivo di Covid-19 presentavano un tampone positivo. Questo dato fornisce un’indicazione sull’incidenza dell’infezione da SARS-CoV-2 tra i bambini sintomatici che frequentavano le scuole esaminate nel periodo della nostra osservazione. I coronavirus comunemente circolanti nella popolazione pediatrica sono stati isolati nel 4-6% dei bambini ospedalizzati per infezioni del tratto respiratorio e nell’8% dei casi valutati in contesto ambulatoriale5. Nel mese di ottobre 2020, la quota di tamponi positivi nella provincia di Bergamo ha presentato una media giornaliera di 7,3 su 100mila abitanti6. I nostri dati suggeriscono che, a fronte di una bassa circolazione virale per SARS-CoV-2 nell’area di Bergamo, il virus ha aggiunto solo una piccola quota al reservoir microbiologico nella popolazione dei bambini con infezioni acute.
Nel gruppo di bambini con tampone positivo (n = 119), la febbre è risultato il sintomo più frequente (58,8%), seguito dalla rinorrea (55,5%), dalla tosse (43,7%) e dalla faringodinia (30,2%) (Tabella II). In rapporto ai dati descritti in revisioni sistematiche della letteratura, il nostro studio riporta una percentuale sostanzialmente sovrapponibile di bambini con febbre e tosse, mentre la rinorrea e il coinvolgimento faringeo mostrano una maggiore prevalenza7-11. Questo dato può essere dovuto in parte alla ricerca attiva di questi segni da parte dei pediatri partecipanti allo studio, in parte alla differente origine del nostro campione, rappresentato unicamente da bambini con sintomi di esordio per una patologia acuta, valutati in un contesto di Cure primarie.
L’analisi della distribuzione dei sintomi in rapporto al livello scolastico (Tabella III) indica che la frequenza della dispnea risulta più alta nei bambini frequentanti gli asili/scuole dell’infanzia, mentre le frequenze di mialgia/cefalea e di anosmia/ageusia tendono ad aumentare con l’età. Questi dati suggeriscono che un coinvolgimento delle basse vie aeree può essere più comune nei bambini in età prescolare, mentre i preadolescenti presentano quadri clinici di esordio maggiormente simili a quelli osservati fra gli adulti.
L’analisi degli scenari clinici che hanno condotto all’esecuzione del SMST ha rilevato che nessuno di questi presenta un PPV elevato (Tabella IV). Questo dato suggerisce che la presentazione clinica di esordio del Covid-19 non differisce in maniera significativa da quella presente in bambini ammalati per altre comuni infezioni dell’età pediatrica. Le nostre osservazioni, anche se riferite a un contesto di assistenza territoriale, confermano i dati raccolti per bambini con malattia acuta osservati in ambiti ospedalieri12. Alcuni studi retrospettivi hanno riportato alcune differenze nelle manifestazioni cliniche del Covid-19 rispetto a specifiche infezioni respiratorie osservate in età pediatrica. Un’analisi dei sintomi di pazienti con sindrome respiratoria acuta grave 2003 (SARS) e Covid-19 ha riscontrato che i pazienti con SARS presentano più frequentemente febbre, brividi, mialgia, malessere, rinite, mal di gola, tosse produttiva, nausea, cefalea e vertigini13. In rapporto ai pazienti con Influenza A, i pazienti con Covid-19 presentano più frequentemente febbre, diarrea o vomito, cefalea, dolore muscolare e toracico, mentre non sono state riportate differenze significative nel confronto con la sintomatologia dei pazienti affetti da Influenza B14. In un ampio studio osservazionale condotto nella provincia canadese di Alberta su bambini sintomatici sottoposti a SMST, è stato riscontrato che la frequenza di anosmia/ageusia, nausea/vomito, cefalea e febbre era più alta nei bambini con test positivo a SARS-CoV-215. In quella ricerca, i soggetti inclusi nello studio sono stati selezionati sulla base della positività al tampone o in quanto contatti stretti di caso. I valori di OR calcolati per i sintomi nel nostro sondaggio appaiono comparabili con quelli riportati dal gruppo canadese. In aggiunta, l’aver reclutato i dati da una popolazione non selezionata di bambini con malattia acuta, ci ha consentito il calcolo dei PPV per la positività al test dei singoli sintomi, assente in quello studio. Il calcolo del PPV ci sembra di particolare rilevanza, soprattutto per valutare la fattibilità o il successo di un programma di screening per Covid-19 basato sui sintomi.
L’analisi degli scenari clinici che hanno condotto al test, e in particolare il confronto fra gli scenari clinici monosintomatici e quelli polisintomatici, può suggerire alcune chiavi interpretative di possibile comportamento per la pratica assistenziale. Nella nostra casistica, 444 bambini hanno praticato il test presentando un’unica manifestazione clinica (Tabella IV). Venti di questi bambini (4,5%) sono risultati affetti da Covid-19. Il PPV per la positività al tampone non è risultato sostanzialmente diverso per gli scenari clinici caratterizzati da singoli sintomi o da associazione di sintomi. Di particolare interesse ci sembra il dato che, nei casi in cui la febbre era l'unico segno suggestivo di Covid-19, la positività al tampone è stata riscontrata in 5 su 22 bambini testati entro 24 ore dall’inizio dei sintomi, e solo in 1 su 36 bambini testati dopo 24 ore (dato non riportato nelle tabelle). Nel complesso, questi dati, seppure riferiti a un ristretto numero di osservazioni, suggeriscono che l’applicazione di una vigile attesa per l’esecuzione del test volta a un allungamento del periodo febbrile o alla comparsa di altri sintomi non aumenta la probabilità di riscontrare un tampone positivo.
Dobbiamo però elencare anche dei potenziali limiti del nostro studio. Tra questi, la natura intrinseca del sondaggio, con particolare riferimento alla accuratezza nella raccolta e nell’inserimento dei dati da parte dei PdF partecipanti. Abbiamo cercato di ridurre al minimo questo errore attraverso un training dei partecipanti effettuato mediante video-tutorial e assistenza telefonica ai partecipanti da parte degli stessi autori. La griglia per la raccolta dei dati fornita ai PdF è stata disegnata secondo la lista dei sintomi indicata nel DPCM3 e in alcuni casi segni/sintomi diversi sono stati raggruppati sotto un'unica voce (mialgia/cefalea, vomito/diarrea). Per questi segni/sintomi non ci è stato possibile attribuire dei dati separati. Il sondaggio è stato limitato a un breve periodo di osservazione e ristretto a un’area di circa un milione 110mila abitanti, che non è stata interamente coinvolta per il numero incompleto di PdF partecipanti (86 su 117). Questi parametri vanno tenuti in considerazione, per una eventuale generalizzazione dei dati ad altri periodi dell’anno e ad altri territori. Da ultimo, è possibile che l’analisi dei dati non abbia consentito l’individuazione di alcune associazioni a causa del numero limitato di casi di Covid-19.
Conclusioni
Il nostro sondaggio dimostra che i segni clinici di esordio del Covid-19 non differiscono in maniera significativa da quelli di altre comuni infezioni diffuse tra i bambini in età scolare. In particolare l’atteggiamento wait and see, comune nella nostra pratica clinica, per attendere il definirsi di un quadro indirizzante alla diagnosi, non risulterebbe applicabile al Covid-19 in età pediatrica, la cui sintomatologia iniziale non sembra differire nella maggior parte dei casi da quella di una virosi rapidamente autorisolutiva. Alla luce di questi rilievi, ci sembra importante prima di tutto sottolineare l’opportunità che presso l’ambulatorio del pediatra vengano individuati i bambini con patologie acute da non inviare all’esecuzione del test, perché affetti da altre patologie, diagnosticate anche mediante l’uso degli strumenti di self-help (stick urine, tampone rapido per streptococco beta-emolitico). Appare però evidente che, nella valutazione della probabilità pre-test di malattia nei bambini con patologia acuta, il giudizio clinico del pediatra dovrà essere affiancato dalla valutazione del quadro epidemiologico (prevalenza del virus nella popolazione, valutazione della situazione sanitaria dei contatti stretti). In generale, per quanto riguarda il tracciamento del virus nella popolazione pediatrica, oltre alle difficoltà evidenziate in questo studio relative all’individuazione di quadri clinici suggestivi di infezione da SARS-CoV-2 tra i bambini con malattie acute, vanno considerate quelle legate all’identificazione dell’infezione nei bambini asintomatici, la cui prevalenza è segnalata in un numero crescente di studi16-18. L’opportunità di uno screening nella popolazione pediatrica, e in particolare nelle scuole, rimane a oggi un problema aperto e oggetto di discussione in Sanità pubblica19.
Ringraziamenti
Gli Autori desiderano ringraziare la SiMPeF (Sindacato Medici Pediatri di Famiglia) per la collaborazione.
Sono riconoscenti a tutti i pediatri di famiglia della Provincia di Bergamo che hanno partecipato alla raccolta dei dati: Chiara Allevi, Elena Allevi, Monica Altobelli, Marzia Bacchini, Anna Barabani, Giovanna Basa, Elisa Basaglia, Vittoria Bassi, Chiara Beretta, Franca Boe, Alessandra Bolis, Mariaconsolazione Bonaventura, Irene Bonicelli, Michela Bosisio, Luisa Botti, Giacomina Brevi, Giuseppa Caccamo, Chiara Caldiani, Sonia Cantù, Teresa Carapella, Romeo Carrozzo, Giovanni Caso, Monica Ciaponi, Norma Ciocca, Sergio Clarizia, Giovanna Corno, Simona Curti, Andrea D’Adda, Silvia Daldossi, Gianluigi Di Chiara, Graziella Dodesini, Nives Duzioni, Laura Enfissi, Patrizia Fiermonte, Ezio Finazzi, Cristina Ghisalberti, Manuele Gnecchi, Luigi Greco, Carla Guadagni, Gerolamo Gualini, Silvana Hattab, Isaia Lando, Fabiana Lanfranchi, Paola Lippi, Eleonora Lombardi Mistura, Paola Longaretti, Cristina Longo, Elisabetta Lorenzi, Barbara Maffeis, Rita Maffioletti, Silvia Mainardi, Danila Mariani, Lucia Menegazzo, Laura Morali, Maria Elisabetta Musitelli, Catia Osio, Valeria Otelli, Luisa Panichelli, Sara Paruta, Carolina Passera, Debora Pastori, Barbara Pazzano, Nicoletta Pellegrini, Katharina Perackis, Chiara Pezzini, Beatrice Pietrobon, Giorgio Priori, Veronica Pulcini, Elena Ravasio, Ornella Ribaud, Luigia Rottoli, Maria Grazia Salmoiraghi, Franco Salvi, Francesca Salvioni, Luigi Siccardo, Anna Sorge, Simona Strada, Silvia Tambini, Laura Tellarini, Brigitte Tschumperlin, Francesca Valerio, Luis Vargas Villazon, Umberto Verzeri, Alberto Vitali, Chiara Zanolini, Fabrizio Zelaschi.
Desiderano ringraziare inoltre: i laboratori di ASST Bergamo-Est, ASST Papa Giovanni XXIII Bergamo, ASST Bergamo-Ovest, in particolare Maria Oggionni e Maurizio Zaccanelli; Danilo Contardi per i consigli in fase di discussione dei dati e per la rilettura critica del manoscritto.
Nota. Romeo Carrozzo e Irene Bonicelli hanno contribuito in maniera equivalente alla elaborazione dello studio.
Bibliografia
- Lu X, Zhang L, Du H, et al. SARS-CoV-2 infection in children. N Engl J Med 2020;382:1663-5. DOI: 10.1056/NEJMc2005073.
- Bailey LC, Razzaghi H, Burrows EK, et al. Assessment of 135 794 pediatric patients tested for severe acute respiratory syndrome coronavirus 2 across the United States. JAMA Pediatr 2020 Nov 23;e205052 [Epub ahead of print]. DOI: 10.1001/jamapediatrics.2020.5052.
- Decreto del Presidente del Consiglio dei Ministri. Ulteriori disposizioni attuative del decreto-legge 25 marzo 2020, n. 19, recante misure urgenti per fronteggiare l'emergenza epidemiologica da COVID-19, e del decreto-legge 16 maggio 2020, n. 33, recante ulteriori misure urgenti per fronteggiare l'emergenza epidemiologica da COVID-19. GU Serie Generale n. 222 del 7 settembre 2020.
- World Medical Association. WMA Declaration of Helsinki - Ethical principles for medical research involving human subjects. 2018 July 9th.
- Zimmermann P, Curtis N. Coronavirus infections in children including Covid-19: an overview of the epidemiology, clinical features, diagnosis, treatment and prevention options in children. Pediatr Infect Dis J 2020;39:355-68. DOI: 10.1097/INF.0000000000002660.
- Regione Lombardia. Coronavirus in Lombardia. Dati di ottobre 2020.
- Shane AL, Sato AI, Kao C, et al. A pediatric infectious diseases perspective of severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2) and novel coronavirus disease 2019 (COVID-19) in children. Pediatric Infect Dis Soc 2020;9(5):596-608. DOI: 10.1093/jpids/piaa099.
- Mantovani A, Rinaldi E, Zusi C, et al. Coronavirus disease 2019 (COVID-19) in children and/or adolescents: a meta-analysis. Pediatr Res 2020 17 June [Epub ahead of print]. DOI: 10.1038/s41390-020-1015-2.
- Ludvigsson JF. Systematic review of COVID-19 in children shows milder cases and a better prognosis than adults. Acta Paediatr 2020;109(6):1088-95. DOI: 10.1111/apa.15270.
- Liguoro I, Pilotto C, Bonanni M, et al. SARS-COV-2 infection in children and newborns: a systematic review. Eur J Pediatr 2020;179:1029-46. DOI: 10.1007/s00431-020-03684-7.
- Patel NA. Pediatric COVID-19: Systematic review of the literature. Am J Otolaryngol 2020;41:102573. DOI: 10.1016/j.amjoto.2020.102573.
- Yonker LM, Neilan AM, Bartsch Y, et al. Pediatric severe acute respiratory syndrome coronavirus 2 (SARS-CoV-2): clinical presentation, infectivity, and immune responses. J Pediatr 2020;227:45-52. DOI: 10.1016/j.jpeds.2020.08.037.
- Xiong X, Chua GT, Chi S, et al. A comparison between chinese children infected with coronavirus disease-2019 and with severe acute respiratory syndrome 2003. J Pediatr 2020;224:30-36. DOI: 10.1016/j.jpeds.2020.06.041.
- Song X, Delaney M, Shah RK, et al. Comparison of clinical features of COVID-19 vs seasonal influenza A and B in US children. JAMA Netw Open 2020;3:e2020495. DOI: 10.1001/jamanetworkopen.2020.20495.
- King JA, Whitten TA, Bakal JA, McAlister FA. Symptoms associated with a positive result for a swab for SARS-CoV-2 infection among children in Alberta. CMAJ 2021;193(1):E1-E9. DOI: 10.1503/cmaj.202065.
- Sola AM, David AP, Rosbe KW, et al. Prevalence of SARS-CoV-2 infection in children without symptoms of coronavirus disease 2019. JAMA Pediatr, 2020 Aug 25. DOI: 10.1001/jamapediatrics.2020.4095 [Epub ahead of print].
- Rivera F, Safdar N, Ledeboer N, et al. Prevalence of SARS-CoV-2 asymptomatic infections in two large academic health systems in Wisconsin. Clin Infect Dis 2020 Aug 19. DOI: 10.1093/cid/ciaa1225 [Epub ahead of print].
- Pouwels KB, House T, Pritchard E, et al.; COVID-19 Infection Survey Team. Community prevalence of SARS-CoV-2 in England from April to November, 2020: results from the ONS Coronavirus Infection Survey. Lancet Public Health 2021;6(1):e30-e38. DOI: 10.1016/S2468-2667(20)30282-6.
- American Academy of Pediatrics. Covid-19 testing guidance. Last updated: 30/12/2020.
Vuoi citare questo contributo?
