Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Novembre 2009 - Volume XII - numero 9
M&B Pagine Elettroniche
Contributi Originali - Ricerca
Follow-up
a medio e lungo termine in bambini con megauretere non refluente:
valutazione critica
1Unità
Operativa TIN, Ospedale Pugliese-Ciaccio, Catanzaro
2Dipartimento
di Pediatria, Università “Magna Græcia”,
Catanzaro
Indirizzo
per corrispondenza: giusyd83@hotmail.it
MEDIUM
AND LONG TERM FOLLOW UP IN CHILDREN SUFFERING FROM NON-REFLUXING
MEGAURETER
Key
words Non
refluxing megaureter, follow up, Summary
Objectives
- The purpose of our research was to assess the natural history
of the non-refluxing, non-obstructive megaureter by means of a
medium and long term follow-up.
Methods
- From 1992 to 2003 we observed 48 infants (37 males and 11
females) with a non-refluxing megaureter. In 58.3% of the cases
it was already diagnosed through intrauterine ultrasound
screening (US) during pregnancy, in 37.3% through neonatal
ultrasound screening and in 4% because of urinary tract
infection. In 43.7% of the cases the megaureter was on the left
side, in 25% on the right side and it was bilateral in 31.3% on a
total of 63 dilated units. All patients underwent: US, mintional
cistouretrography (all negative for RVU), and renal dynamic
scintigraphy. The scintigraphy showed that 81.2% of the patients
did not have any obstruction and had a good and stable
functionality, whereas in 16.6% the scintigraphic pattern
resulted positive for obstruction but showed normal glomerular
filtrate, except for 2.2%.
Results
- 80.4% of the children showed improvement, i.e. the reduction of
1st degree hydronephrosis; they were treated without surgery for
an average period of 46.7 months (range 8-126, average 46). 19.6%
of the cases underwent surgical treatment of re-implantation and
re-modelling/refashioning: 7 patients because they had an
obstructive megaureter and 2 patients since renal ultrasound
showed a progressive dilation of the hydro-ureter-nephrosis.
Conclusion
- With our research we sustain that the treatment without surgery
of the non-refluxing megaureter diagnosed during the prenatal
period in asymptomatic newborn children is safe and effective. |
|
Le
uropatie malformative (U.M.) sono particolarmente frequenti (30% di
tutte le anomalie congenite), ma prima della diffusione della
diagnostica ecografica perinatale, il decorso oligo- asintomatico ne
consentiva la diagnosi solo tardivamente, in seguito alle
manifestazioni cliniche delle loro complicanze (infezioni delle vie
urinarie o alterazioni della funzionalità renale).
Attualmente
molte U.M. sono evidenziate già nel corso degli esami
ecografici eseguiti di routine durante la gravidanza1: i
reni e la vescica fetali, infatti, possono essere visualizzati fin
dal primo trimestre con esami endovaginali, anche se uno studio
morfologico accurato deve essere rimandato alla 18ª-
20ªsettimana2. Particolarmente frequente è la
segnalazione prenatale di dilatazione delle vie urinarie (1- 5% di
tutte le gravidanze3) che possono essere limitate alla
pelvi e ai calici (idronefrosi) o interessare l’intera via
escretrice (idroureteronefrosi); la prevalenza attesa di megauretere
è approssimativamente di 1/2000 nati4.
Il
termine megauretere o megalouretere, introdotto per la
prima volta da Caulk5 nel 1923 è un termine
generico che designa tutti gli ureteri il cui diametro supera il
valore normale di 5 mm. questa definizione non corrisponde a una
precisa diagnosi, né comporta alcuna valutazione etiologica,
perché la dilatazione ureterale si accompagna a diverse
anomalie (reflusso vescico-ureterale, valvola dell’uretra
posteriore, ectopia dello sbocco ureterale ecc); è
particolarmente importante ricordare che megauretere è
sinonimo di uretere dilatato, non di uretere ostruito.
Sono
stati utilizzati molti sistemi per classificare il megauretere.
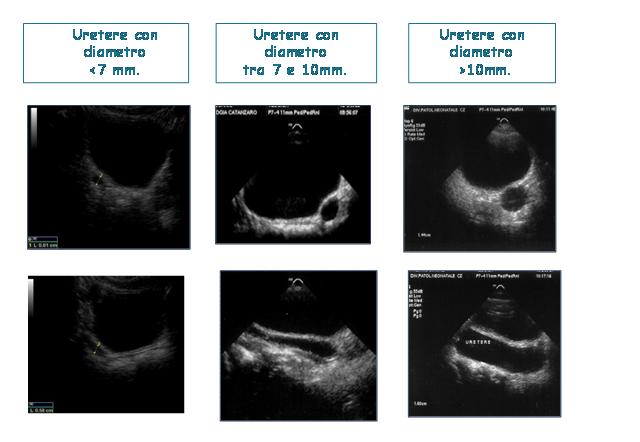
Una
Classificazione puramente morfologica, basata sulla
valutazione ecografica del calibro dell’uretere ectasico è
quella proposta dalla Society for Fetal Urology6
che distingue i megaureteri in tre gradi (Figura
1):
grado
1: diametro ureterale inferiore a 7 mm;
grado
2: diametro ureterale tra 7 e 10 mm;
grado
3: diametro ureterale superiore a 10 mm.
Poiché
questa classificazione non consente di correlare i vari gradi del
megauretere con un diverso tipo di management diagnostico, né
con una precisa prognosi o con le diverse opzioni terapeutiche, la
classificazione cui si fa più frequentemente riferimento è
quella eziologica, che prevede una suddivisione del megauretere in:
- megauretere ostruttivo, secondario a ostruzione della giunzione uretero-vescicale;
- megauretere refluente, secondario a reflusso vescico-ureterale;
- megauretere non refluente, non ostruttivo.
Le forme
ostruttive sono caratterizzate da un ostacolo al normale flusso
urinario, con conseguente ristagno di urine e dilatazione a monte, se
non adeguatamente trattate, possono provocare un progressivo
deterioramento della funzione renale.
Il
megauretere refluente non rappresenta un’entità
nosologica autonoma, ma solo una delle molteplici e complesse
manifestazioni del reflusso vescico-ureterale (RVU) e in
questa patologia deve essere inquadrato.
Le forme
non refluenti e non ostruttive, che costituiscono la maggior
parte (dal 43-83%)7 dei megaureteri asintomatici
diagnosticati attraverso le ecografie di screening, vengono
prevalentemente attribuite a un’incoordinazione del movimento
della muscolatura della pelvi e dell’uretere, cioè a
un’alterata cinetica delle normali onde peristaltiche, che
procedono in senso anterogrado verso la vescica.
Purtroppo
una netta distinzione tra i megaureteri ostruttivi e quelli non
ostruttivi è possibile soltanto dopo un periodo di
osservazione e di monitoraggio, sia dell'evoluzione ecografica della
dilatazione, sia dei tempi di wash-out e dei parametri di
funzionalità renale; infatti, l’unica definizione, non
controversa di uropatia ostruttiva “un ostacolo al flusso
urinario che, se non trattato, causa un progressivo deterioramento
funzionale”8 è retrospettiva, e la
certezza diagnostica dell’ostruzione è data solo da quel
progressivo deterioramento della funzione renale, che rappresenta
l’evento finale che i programmi di diagnosi precoce e di
follow-up devono tendere a evitare.
Tutti i
tipi di megaureteri sono poi distinti in primitivo e
secondario9, intendendo per primitivo un uretere
dilatato da un’alterazione intrinseca della giunzione
uretero-vescicale in assenza di altre anomalie anatomiche
dimostrabili, mentre è secondario il megauretere conseguente a
un’altra patologia (valvole uretrali, vescica neurologica,
ureterocele, tumori uroteliali, calcoli, sbocco ureterale ectopico,
sclerosi del collo ecc.)
Nel
percorso diagnostico del megauretere l’ecografia è
l’indagine di base, offre molti dettagli morfologici
dell’apparato urinario, consente di valutare il numero, la
forma, la posizione dei reni, la morfologia delle pelvi e dei calici,
determinare le dimensioni dell’uretere ectasico, classificarlo
in gradi secondo la SFU e monitorizzarne le dimensioni nel tempo10.
La
cistouretrografia minzionale (CUM) è una tappa
obbligata nella diagnosi del megauretere, perché costituisce
il gold standard per discriminare i megaureteri refluenti dai non
refluenti, consente anche la valutazione della morfologia e della
pervietà dell’uretra maschile e contribuisce alla
distinzione dei megaureteri primitivi dai secondari; comporta
inevitabilmente la sgradita manovra di cateterizzazione uretrale, che
rende opportuna una blanda sedazione dei pazienti più piccoli,
e infine l’impiego della cistografia tradizionale, che utilizza
radiazioni ionizzanti, implica una significativa esposizione della
regione gonadica. Esclusa con la CUM la diagnosi di RVU, nei
megaureteri non refluenti la successiva tappa diagnostica è la
scintigrafia renale dinamica, che oltre a fornire informazioni sulla
funzionalità renale totale e sul contributo separato di
ciascun rene, consente di valutare i tempi di scarico, e in caso di
ritardo nell’eliminazione del tracciante, può essere
integrata con il test al diuretico che dà un importante
contributo alla diagnosi differenziale fra megauretere ostruttivo e
non ostruttivo.
Altre
indagini come l’Uro-RM, L’Uro-TC o la vecchia l'urografia
endovenosa sono riservate ai casi eccezionali in cui sono richiesti
ulteriori dettagli morfologici rispetto a quelli già forniti
dall’ecografia e dalla scintigrafia11.
Le
indicazioni terapeutiche del megauretere primitivo non refluente
(M-nR) nei neonati e nei bambini costituiscono uno degli aspetti più
controversi. I follow-up a lungo e medio termine di questi pazienti
riportano significative percentuali di risoluzione o riduzione della
dilatazione, pertanto è attualmente condiviso un approccio,
almeno inizialmente, conservativo per tutti i tipi di megauretere,
con un management “wait and see” che si limita alla
sorveglianza della sterilità delle urine e al monitoraggio
clinico-strumentale dell’anomalia, e riserva la terapia
chirurgica a casi selezionati: quelli con evidente danno della
funzionalità renale o con un peggioramento durante il tempo di
osservazione, o con progressivo incremento della dilatazione, o nei
casi con IVU ricorrenti non controllabili con la terapia medica12-14.
Anche la profilassi antibiotica, considerata a lungo un caposaldo nel
management delle dilatazioni delle vie urinarie, è oggi messa
in discussione e la letteratura recente sottolinea la mancanza di
evidenze sui reali vantaggi di questa comune pratica12.
SCOPO
DELLO STUDIO
Lo scopo
del nostro studio è quello di analizzare i risultati di un
follow-up a medio e lungo termine del megauretere non refluente, sia
in bambini trattati conservativamente che trattati chirurgicamente,
per determinare la percentuale di risoluzione della dilatazione
ureterale, l’incidenza delle complicanze e gli esiti sulla
funzionalità renale.
Abbiamo
valutato retrospettivamente tutti i neonati a termine (nati fra
Gennaio 1992 e Dicembre 2003) con megauretere primitivo, non
refluente (M-nR), associato a diversi gradi di idronefrosi,
diagnosticato in epoca pre-natale o durante lo screening ecografico
post natale che, in quegli anni, veniva effettuato presso il nostro
punto nascita.
Sono
stati esclusi i neonati con megauretere refluente e quelli con
associate altre patologie extrarenali (malformati, sindromici ecc.) o
renali (agenesia monolaterale, ectopia, doppio distretto, stenosi del
giunto pielo-ureterale ecc.).
In undici
anni di osservazione sono stati arruolati 48 neonati con età
gestazionale di 38 +/- 2 settimane: 37 erano maschi (77.1%) e 11
femmine (22.9%).
È
stato definito il grado di dilatazione riscontrato a carico del
sistema calico-pielico secondo le linee guida della Society for
Fetal Urology6. I neonati con dilatazioni ureterali
persistenti, superiori a 5 mm. di diametro, sono stati sottoposti ad
antibiotico profilassi con amoxicilla + acido clavulanico alla dose
di 18 mg/Kg/die in unica somministrazione serale.
Il
management diagnostico comprendeva, in tutti i pazienti, una
Cistouretrografia minzionale (CUM) per escludere il reflusso
vescico-ureterale e successivamente, nei neonati con M-nR, è
stata eseguita una scintigrafia renale dinamica più test alla
furosemide per valutare la funzionalità renale totale e
separata, e i tempi di scarico. Nei pazienti con megauretere
monolaterale la funzionalità del rene affetto era considerata
normale quando superava il 40% del totale, lievemente ridotta fra il
20 e il 39%, ridotta se inferiore al 20%; in quelli con patologia
bilaterale la funzionalità differenziale non era considerata.
La velocità di drenaggio era considerata indicativa di
ostruzione quando il T ½ era maggiore di 20min, borderline fra
15min e 20min, non indicativo di ostruzione se inferiore a 15 min,
secondo le linee guida standardizzate per l’esecuzione
dell’esame “well-tempered renogram”15,16.
Tutti i
pazienti sono stati avviati a un follow-up clinico (valutazione peso,
statura, esame urine, sorveglianza IVU, misurazione P.A.) ed
ecografico, con controlli ripetuti ogni 3 mesi nel primo anno di
vita, ogni 6 mesi successivamente, sempre in caso di comparsa di
sintomatologia. L’intervallo tra i controlli è aumentato
nel momento in cui i pazienti hanno completato con successo il
“toilet training”.
Abbiamo
valutato 48 pazienti con megauretere:
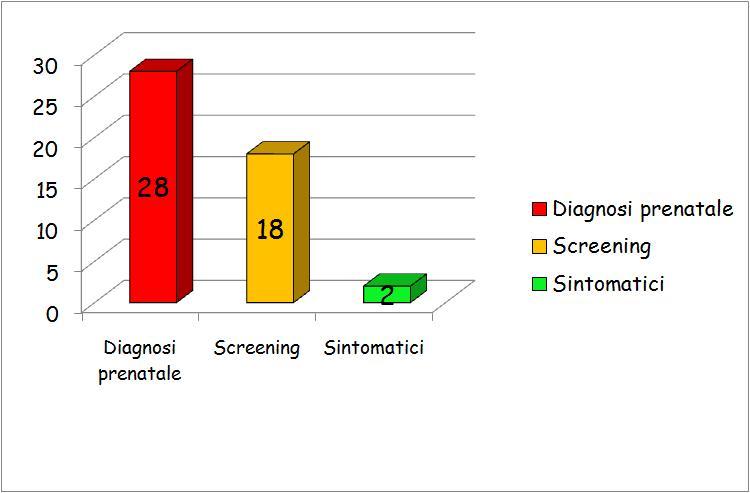
46 erano
asintomatici e il sospetto diagnostico era stato posto per 28/48
(58.3%) nel corso dei controlli ecografici prenatali e per 18/48
neonati (37.5%) allo screening ecografico post-natale.
solo 2
neonati (4,1%) erano sintomatici e l’ecografia renale era stata
richiesta per infezione delle vie urinarie (IVU) all’età
media di 18 mesi (Figura 2).
L’incidenza
di MU sulla popolazione di 23494 nati consecutivamente, sottoposti a
screening ecografico post-natale delle U.M., è stata dello 0,2
%.18
In tutti
i pazienti, all’esame ecografico, il megauretere era associato
a idronefrosi:
nel 43.7%
(21 bambini) era a sinistra
nel 33.4%
(16 bambini) era a destra
nel 22.9%
(11 bambini) era bilaterale
Abbiamo
riscontrato in 48 pazienti un totale di 63 megaureteri:
nel 43.7%
(21/48 pazienti) monolaterale sinistra;
nel 25.0%
(12/48 pazienti) monolaterale destra;
nel 31.3%
(15/48 pazienti) bilaterale.
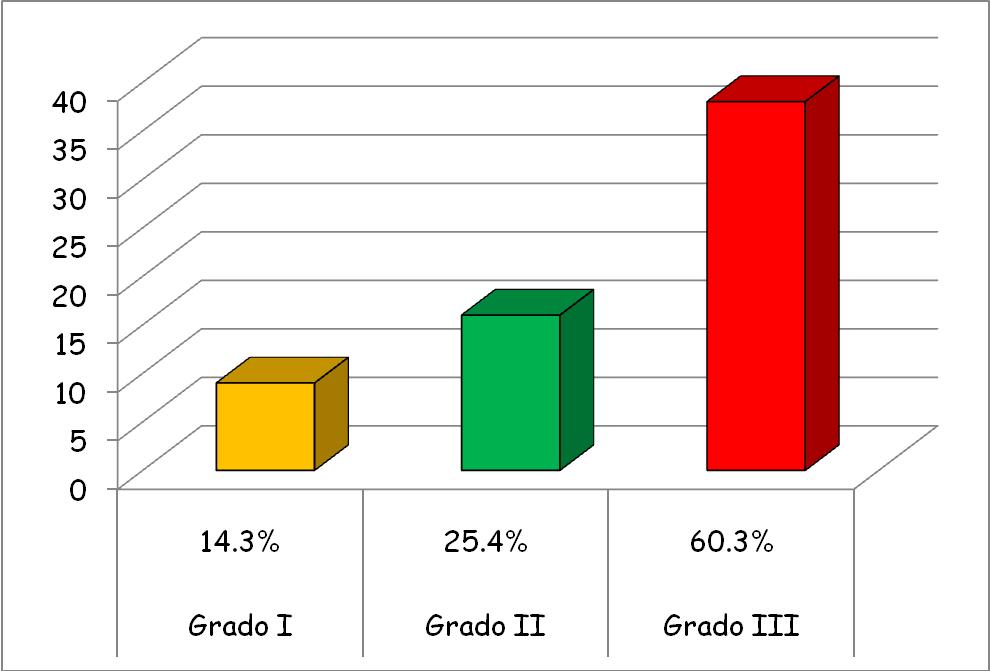
Delle 63
unità dilatate: (Figura 3)
il 14.3%
(9 megaureteri) erano di I Grado;
il 25.4%
(16 megaureteri) erano di II Grado;
il 60.3%
(38 megaureteri) erano di III Grado.
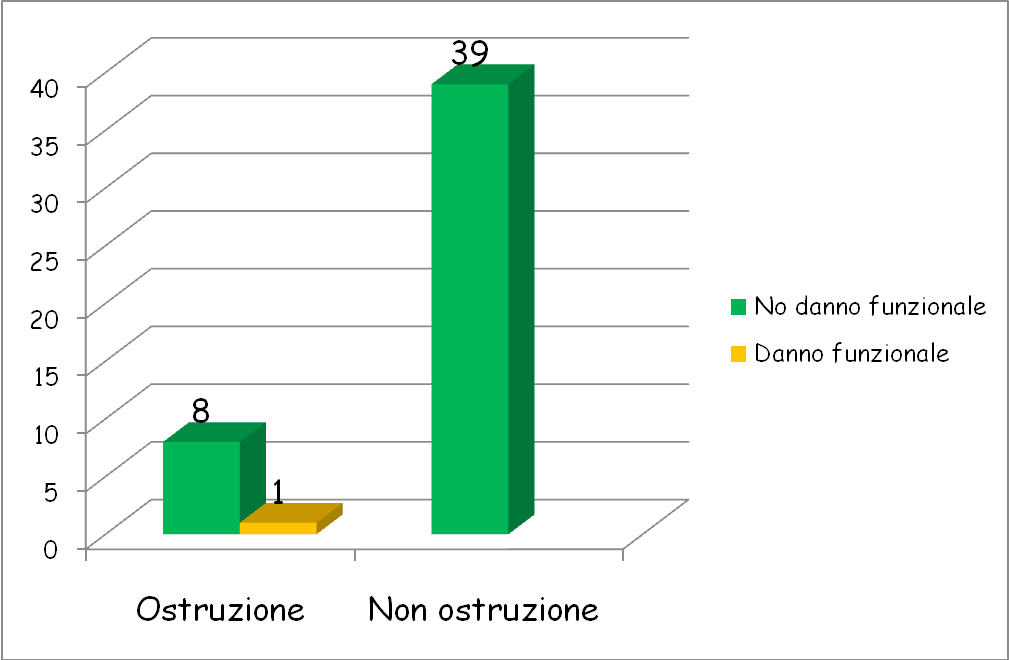
In tutti
i bambini è stata eseguita una CUM che ha escluso un RVU, e
una scintigrafia renale dinamica. L'indagine con il radionuclide e la
successiva somministrazione di furosemide ha dimostrato (Figura
4):
- nell’81.2% (39 bambini) l’assenza di ostruzione e una buona e stabile funzionalità
- nel 16.6% (8 bambini) il pattern scintigrafico era positivo per ostruzione, ma il valore del filtrato glomerulare era nella norma
- nel 2.2% dei casi (1 bambino) il pattern scintigrafico di ostruzione era associato a una riduzione del filtrato glomerulare
Nonostante
la profilassi antibiotica il 16.6% (8 bambini) ha presentato un
episodio di IVU.
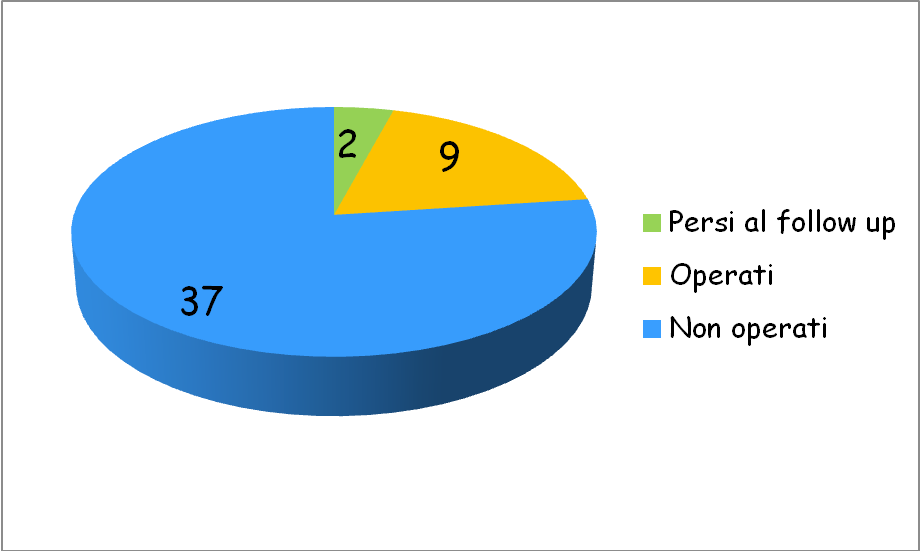
Il 4.1%
dei pazienti (2 bambini) sono stati persi dopo un follow-up medio di
18 mesi.
Dei 46
pazienti seguiti in follow-up:
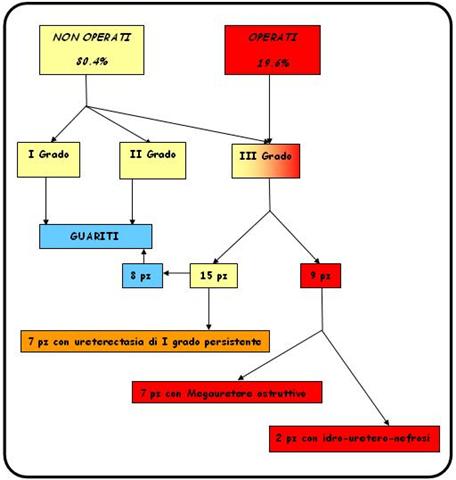
- l’80.4% (37/46 bambini) ha presentato un miglioramento, inteso come riduzione dell’idronefrosi al grado I sec. SFU; il follow-up è durato per un periodo medio di 46,7 mesi (range 8-126, mediana 46). I megaureteri di I Grado sono andati tutti incontro a risoluzione all’età media di 61 mesi (range 8-96, mediana 65.5); quelli di II Grado all’età media di 54 mesi (range 8-126, mediana 42); invece è migliorato il 40.5% (15 pazienti) di quelli di III Grado all’età media di 57.5 mesi (range 12-91, mediana 37.5). In 7 di questi bambini (17.5% dei casi), persisteva un’ureterectasia di grado I, con buona funzionalità renale e assenza di IVU, anche dopo la sospensione della profilassi antibiotica serale.
- 9 bambini (19.6% dei casi) sono stati sottoposti a trattamento chirurgico di reimpianto e rimodellamento, tutti avevano un megauretere di III grado: in 7 l'indicazione all'intervento era stata posta per la persistenza di un pattern scintigrafico di ostruzione, l’età media all’intervento era di 27 mesi (range 12-84, mediana 17); 2 pazienti (7.5%), che presentavano un aumento della dilatazione pieloureterale associata al pattern ostruttivo, sono stati operati all’età media di 48 mesi (range 8-96, mediana 42). In 8/9 la funzione del rene affetto era conservata (>40%della funzione totale), in 1/9 era diminuita, questo paziente al follow-up post operatorio ha presentato un netto miglioramento della velocità del wash out, ma nessun recupero funzionale. (Figura 5 e Figura 6).
Le nuove
tecniche di diagnostica per immagini e la loro ampia diffusione, sia
negli algoritmi diagnostici che come metodica di screening, hanno
avuto un impatto così prepotente sulle nostre conoscenze in
tema di U.M., da imporci di modificarne il management oltre che di
riscriverne l’epidemiologia e la storia naturale.
Le
dilatazioni ureterali sono un reperto relativamente frequente, in
particolare il megauretere non refluente (M-nR) ha, nella nostra
casistica, un’incidenza dello 0,2%17.
Quasi
tutti i nostri pazienti (96%) erano asintomatici al momento della
diagnosi e l’anomalia era stata evidenziata durante uno
screening ecografico pre- o post-natale. Abbiamo rilevato una
maggiore incidenza di M-nR nel sesso maschile (77.1%), sul lato
sinistro (43.7% dei casi) e una prevalenza del grado più
elevato (il 60.3% era di III Grado).
L’ecografia
si è rivelata uno strumento efficace nella diagnostica e nel
follow-up delle dilatazioni ureterali, ma non contribuisce a
discriminare le forme refluenti dalle non refluenti e quelle
ostruttive dalle non ostruttive. Per la definizione della diagnosi
abbiamo fatto ricorso alla CUM e alla scintigrafia dinamica: indagini
invasive, dolorose, rischiose e costose.
Sebbene
la dilatazione della via escretrice produca reperti ecografici
vistosamente anormali, all’alterazione della morfologia non
corrisponde un proporzionale danno funzionale, e a monte di un
uretere ectasico e dal decorso tortuoso c’è più
spesso un rene ben funzionante (47/48 nella nostra serie).
La
dilatazione ureterale non è indicativa di ostruzione: nella
nostra esperienza la maggior parte dei megaureteri non refluenti
erano anche non ostruttivi (l’81.2%), ed è importante
sottolineare che fra quelli con dilatazione lieve e moderata (I e II
grado sec SFU) nessuno era ostruttivo.
È
noto che i megaureteri non refluenti, non ostruttivi (M-nR-nO),
indipendentemente dal grado della dilatazione, nel corso del
follow-up medio e lungo termine presentano una buona tendenza alla
riduzione spontanea della dilatazione18-20 che può
essere completa (80.4% nella nostra serie, follow-up medio di 53
mesi) o parziale (17.5% nella nostra serie, follow-up medio di 64.9
mesi).uesti Il grado di presentazione del megauretere sembra un
importante fattore predittivo della probabilità di
miglioramento e della durata del follow-up: abbiamo osservato una
netta prevalenza (100%) di guarigione per i megaureteri di lieve e
media entità (I e II grado) rispetto a quelli con dilatazioni
maggiori (III grado). Né la dilatazione, né il ritardo
nel tempo di transito ureterale, che inevitabilmente la accompagna,
tendono a danneggiare la funzionalità parenchimale, anzi alla
progressiva riduzione dell’ectasia, e al rimodellamento
dell’uretere, si è associato un miglioramento del
wash-out, mentre i parametri funzionali sono restati stabili nel
tempo.
Nonostante
in tutti i pazienti sia stata avviata l’antibiotico profilassi
già al momento della diagnosi, 8 fra tutti i bambini con
megauretere (16.6%) hanno presentato almeno un episodio di IVU.
Questa elevata incidenza, se da un lato conferma la predisposizione
all’infezione nei pazienti con dilatazione ureterale,
dall’altro induce a una riflessione critica sull’efficacia
di questa pratica terapeutica.
La
conoscenza della storia naturale del M-nR-nO ne ha reso possibile un
approccio conservativo, ormai ampiamente condiviso21,22 e
la nostra esperienza ne conferma la sicurezza e l’efficacia.
Restano, a nostro parere, due punti controversi nel management di
questi pazienti:
- deve essere rivalutata l’appropriatezza di una profilassi antibiotica inevitabilmente lunga o lunghissima, dunque costosa, non priva di effetti collaterali per i singoli pazienti e gravata da inevitabili ricadute sull’intera popolazione. Questa pratica, resa comune più da una prudente consuetudine che dall’evidenza, merita di essere messa alla prova in studi clinici randomizzati e controllati sui pazienti con M-nR-nO, non diversamente da quanto Pennesi e coll. hanno fatto nei pazienti con RVU23;
- È necessario ripensare le tappe e il timing di un percorso diagnostico invasivo (almeno una CUM e una scintigrafia dinamica) in questo gruppo di pazienti, che non beneficiano di terapie chirurgiche e in cui nemmeno la profilassi antibiotica sembra costituire un vantaggio.
La CUM è
necessaria per discriminare il M-nR dal RVU: considerando che nessuna
delle due condizioni cliniche costituisce un’urgenza
chirurgica, che per entrambe l’indicazione ad attuare
l’antibioticoprofilassi non è dimostrata, e che
presentano analoga possibilità di miglioramento spontaneo, è
legittimo chiedersi se sia davvero indispensabile, in neonati
asintomatici con dilatazione delle vie escretrici di grado lieve o
moderato, senza altri marker di danno renale, effettuare questa
indagine nelle prime settimane di vita.
O, se non
sia invece proponibile, perlomeno nelle situazioni di buona
compliance familiare, in cui si possono condividere con i genitori le
strategie diagnostiche, un programma inizialmente meno aggressivo,
basato su un’attenta sorveglianza delle IVU e sul monitoraggio
ecografico della dilatazione. Il tempo gioca a favore della maggior
parte di questi pazienti, rinviare gli esami strumentali più
invasivi spesso vuol dire assistere a un miglioramento spontaneo
della dilatazione che consentirà di risparmiarli
definitivamente, limitandone l’esecuzione a quei bambini che
nel corso del follow-up non presentano un miglioramento o che
manifestano sintomi clinici.
Una
percentuale minore dei megaureteri non refluenti (il 19,6 % dei
pazienti della nostra serie) hanno presentato un pattern
scintigrafico di tipo ostruttivo; tutti questi pazienti avevano
dilatazioni gravi (III grado sec. SFU). Nel corso del follow-up la
persistenza (in 7 di 9 pazienti) o un incremento (in 2/9) della
dilatazione, associata a un wash-out stabilmente patologico alla
scintigrafia dinamica, ci hanno indotto a porre un’indicazione
chirurgica.
Al
controllo post-operatorio i tempi di wash-out, valutati
scintigraficamente, sono migliorati in tutti i pazienti, l’estetica
della giunzione uretero-vescicale è stata recuperata, la
funzione renale, normale prima dell’intervento, non si è
modificata.
Nell’unico
paziente operato, in cui il megauretere era associato al danno
renale, non si è riscontrato alcun recupero funzionale.
Studi
clinici più recenti indicano che nel neonato e nel lattante
l’alterazione della curva di drenaggio è un parametro
poco sensibile e poco specifico di ostruzione24 ed è
stato descritto che può normalizzarsi spontaneamente nel
tempo25. Alla luce di queste recenti acquisizioni, non
possiamo escludere che qualcuno dei pazienti, operati in base alla
persistenza di pattern scintigrafico ostruttivo, nel corso di
follow-up più prolungati avrebbero potuto presentare uno
spontaneo miglioramento del drenaggio. Attualmente nel porre le
indicazioni chirurgiche siamo orientati a tenere in maggior conto la
funzionalità renale differenziale e il suo andamento nel
tempo, le modificazioni della dilatazione e la comparsa di
sintomatologia, insieme ai tempi del drenaggio.
In questi
ultimi anni i nostri sforzi nella diagnosi delle uropatie
malformative sono stati concentrati sulla precocità: prima che
si complicassero, prima che si evidenziassero clinicamente, prima
ancora che i bambini portatori di dilatazione delle vie urinarie
nascessero.
Altri
sforzi abbiamo profuso per non escludere dalla diagnosi alcun
potenziale paziente, impiegando tecniche diagnostiche (soprattutto
l’ecografia) come metodiche di screening, su popolazioni di
feti e neonati sani.
Abbiamo
inseguito i progressi nelle tecniche di imaging, per raggiungere una
maggiore accuratezza nella descrizione dei dettagli morfologici e
funzionali delle vie escretrici dei nostri pazienti.
Siamo
probabilmente molto vicini alla possibilità di diagnosticare
tutto, in tutti e subito.
Ma questo
risultato rischia di farci perdere di vista il vero obiettivo finale:
preservare la funzione renale e prevenire le complicanze infettive.
La somma
delle esperienze maturate in follow-up lunghi, come quello
presentato, deve indurre a ripensare i comportamenti terapeutici
consueti (antibiotico profilassi e chirurgia), ma anche a scegliere
percorsi diagnostici che consentono di individuare le malformazioni
che possono danneggiare la funzione renale, senza accanirsi contro le
varianti morfologiche o funzionali delle vie escretrici.
- Savanelli A, Russo S, Vallone G, Esposito G. Urologia malformativa: diagnosi prenatale e follow-up postnatale. Medico e Bambino 1997;16(4):233-39 [full text]
- Peratoner L. Le uropatie diagnosticate in utero: ricerca di linee-guida condivise. Medico e Bambino 1997;16(4):233-39 [full text]
Bibliografia
- Chaviano AH, Maizels M, Yerkes EB, et al. Incidence based fetal urological counseling using the virtual pediatric urology registry: importance of insignificant fetal pyelectasis (sonographically evident renal pelvis). J Urol 2007;178(4 Pt 2):1781-5.
- Johnson CE, Elder JS, Judge NE. The accuracy of antenatal ultrasonography in identifying renal abnormalities. Am J Dis Child 1992;146(10):1181-4.
- Mure PY, Mouriquand P. Upper urinary tract dilatation: prenatal diagnosis, management and outcome. Semin Fetal Neonatal Med 2008;13(3):152-63.
- Gunn TR, Mora JD, Pease P. Antenatal diagnosis of urinary tract abnormalities by ultrasonography after 28 weeks' gestation: incidence and outcome. Am J Obstet Gynecol 1995;172(2 pt 1):479-86.
- Caulk JR Megaloureter: The importance of the ureterovescical valve. J Urol 1984;9:217.
- Fernbach SK, Maizels M, Conway JJ. Ultrasound grading of hydronephrosis: introduction to the system used by the Society for Fetal Urology. PediatricRadiol 1993;23:478–80.
- Areses Trapote R, Urbieta Garagorri MA, Ubetagoyena Arrieta M, et al. Prenatal detection of primary non-refluxing megaureter. Review of our casuistics] An Pediatr (Barc) 2007;67(2):123-32.
- Gordon I, Dhillon HK, Gatanash H, Peters AM. Antenatal diagnosis of pelvic hydronephrosis: assessment of renal function and drainage as a guide to management. J Nucl Med 1991;32(9):1649-54.
- Simoni F, Vino L, Pizzini C, Benini D, Fanos V. Megaureter: classification, pathophysiology and management. Pediatr Med Chir 2000;22(1):15-24.
- Teresa Berrocal, PedroLópez-Pereira, Antonia Arjonilla, and Julia Gutiérrez. Anomalies of the Distal Ureter, Bladder, and Urethra in Children: Embryologic, Radiologic and Pathologic Features. Radiographics 2002;22:1139-64.
- Domini M, Aquino A, Pappalepore N. Conservative treatment of neonatal primary megaureter. Eur J Pediatr Surg 1999; 9:396-99.
- Hodson, EM; Wheeler, DM; Vimalchandra, D; Smith, GH; Craig, JC. Interventions for primary vesicoureteric reflux.Cochrane Database of Systematic Reviews. 2007;3, article CD001532
- Cohen SJ. Ureterozystoneostomic. J Urol 1967;97:457
- Hendren WH. Complication of megaureter in children. J Urol 1975;113:238.
- Mandell GA, Cooper JA, Leonard JC, et al. Procedure guideline for diuretic renography in children. J Nucl Med. 1997;38:1647–1650
- Shulkin BL, Mandell GA, Cooper JA et al. Procedure guideline for diuretic renography in children 3.0. J Nucl Med Technol. 2008;36(3):162-8.
- Galiano R, Pascale V, Cataldi L. Neonatal Kidney and Urinary Tract Anomalies (UTA): A 10 Years Perspective Study in Southern Italy 2007 Pediatric Academic Societies' Annual Meeting May 5-8 • Toronto Canada Poster Session: Nephrology Board Number: 273 Course Number: 7918
- Arena F, Baldari S, Proietto F, Centorrino A, Scalfari G, Romeo G: Conservative treatment in primary neonatal megaureter. Eur J Pediatr Surg 1998;8(6):347-51.
- King LR. Megaloureter: definition, diagnosis and management. J Urol 1980;123(2):222-223.
- Dunnick NR, McCallum RW, Sandler CM: The urinary bladder. In: Textbook of Uroradiology, pp 343-344. Baltimore, Williams & Wilkins, 1991.
- McLellan DL, Retik AB, Bauer SB: Rate and predictors of spontaneous resolution of prenatally diagnosed primary nonrefluxing megaureter. J Urol 2002;168(5):2177-80.
- Oliveira EA, Diniz JS, Rabelo EA, Silva JM, Pereira AK, Filgueiras MT, Soares FM, Sansoni RF:Primary megaureter detected by prenatal ultrasonography: conservative management and prolonged follow-up. Int Urol Nephrol 2000;32(1):13.
- Pennesi M, Travan L, Peratoner L, et al. Is antibiotic prophylaxis in children with vesicoureteral reflux effective in preventing pyelonephritis and renal scars? A randomized, controlled trial. Pediatrics 2008;121(6):e1489–e1494.
- Amarante J, Anderson PJ, Gordon I. Impaired drainage on diuretic renography using half-time or pelvic excretion efficiency is not a sign of obstruction in children with a prenatal diagnosis of unilateral renal pelvic dilatation. J Urol 2003;169(5):1828-31.
- Eskild-Jensen A, Gordon I, Piepsz A, Frøkiaer J.Congenital unilateral hydronephrosis: a review of the impact of diuretic renography on clinical treatment Urol 2005;173(5):1471-6.
Vuoi citare questo contributo?
