Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Novembre 2010 - Volume XIII - numero 9
M&B Pagine Elettroniche
Protocolli di studio
Trial
controllato randomizzato multicentrico di valutazione comparativa
dell’ondansetron verso domperidone per il trattamento
sintomatico del vomito acuto da gastroenterite nel bambino:
protocollo di studio
1Dipartimento
di Pediatria, Servizio di Epidemiologia e Biostatistica, Servizio di
Sperimentazione Clinica, Istituto per l’Infanzia, IRCCS “Burlo
Garofolo”, Trieste
2Dipartimento
di Emergenza Pediatrica, PO Spedali Civili, Brescia
3Dipartimento
di Pediatria, Azienda Policlinico, Modena
4Unità
di Terapia Intensiva Pediatrica, Ospedale Civile Maggiore, Verona
5Dipartimento
di Pediatria, Ospedale di Treviso
6Divisione
di Emergenza Pediatrica, Istituto “G. Gaslini”, Genova
7Dipartimento
di Pediatria, Ospedale Castelli, Verbania
8Divisione
di Emergenza Pediatrica, Ospedale Pediatrico “A. Meyer”,
Firenze
9Dipartimento
di Emergenza Pediatrica, Istituto per la l’Infanzia, IRCCS
“Burlo Garofolo”, Trieste
10Dipartimento
di Pediatria, Ospedale di Macerata
11Dipartimento
di Emergenza Pediatrica, IRCCS Ospedale Pediatrico Bambino Gesù,
Roma
12Dipartimento
di Pediatrica, Azienda Ospedaliera - Università di Parma
13Dipartimento
di Emergenza Pediatrica, Ospedale Infantile “Regina
Margherita”, Torino
14Unità
Operativa di Pediatria, Ospedale “GB Morgagni”, Forlì
15Dipartimento
di Emergenza Pediatrica, Ospedale “Giuseppe Moscati”,
Avellino
16Dipartimento
di Emergenza Pediatrica, Azienda Ospedaliera - Università di
Padova
17Laboratorio
per la Salute Materno Infantile, Istituto Mario Negri, Milano
Indirizzo
per corrispondenza: marchetti@burlo.trieste.it
Oral
ondansetron vs domperidone for symptomatic treatment of vomiting
during acute gastroenteritis in children: multicentre randomized
controlled trial. study protocol
Key
words Vomiting,
Acute gastroenteritis (AG), Antiemetics drugs, Symptomatic
treatment Ondansetron, Domperidone Abstract
Background.
Vomiting in children with acute gastroenteritis (AG) is not only
a direct cause of fluid loss but it is also a major factor of
failure of oral rehydration therapy (ORT). Effective symptomatic
treatment of vomiting would lead to an important reduction in the
use of intravenous fluid therapy (IVT) and, consequently, of the
duration of hospital stay and of frequency of hospital admission.
Available evidence on symptomatic treatment of vomiting shows the
efficacy of the most recently registered molecule (ondansetron)
but a proper evaluation of antiemetics drugs largely used in
clinical practice, such as domperidone, is lacking.
Objectives.
Comparing the efficacy of ondansetron and domperidone for the
symptomatic treatment of vomiting in children with AG who have
failed ORT.
Methods.
Multicentre, double-blind randomized controlled trial conducted
in paediatric EDs. Children aged from 1 to 6 years presenting
with vomiting, with a presumptive clinical diagnosis of AG, and
without severe dehydration will be included. After the failure of
an initial ORS administration in ED, eligible children will be
randomized to receive: 1) ondansetron syrup (0.15 mg/kg of body
weight); 2) domperidone syrup (0.5 mg/kg of body weight); 3)
placebo. A total number of 540 children (i.e. 180 patients in
each arm) will be enrolled.
Discussion.
The trial results would provide evidence on the efficacy of
domperidone, which is largely used in clinical practice despite
the lack of proper evaluation and a controversial safety profile,
as compared to ondansetron, which is not yet authorized in Italy
despite evidence supporting its efficacy in treating vomiting.
The trial results would contribute to a reduction in the use of
IVT and, consequently, in hospital admissions in children with
AG. The design of this RCT, which closely reflect current
clinical practice in EDs, will allow immediate transferability of
results. |
La
gastroenterite acuta
La
gastroenterite acuta (AG) è la principale causa di vomito
acuto nei bambini al di sotto dei 3 anni e rappresenta una delle
principali cause di accesso in Pronto Soccorso (PS) e di ricovero
ospedaliero. È stato stimato che negli Stati Uniti circa 1.5
milioni di bambini < 5 anni è visitato annualmente per AG e
di questi il 13% viene ospedalizzato1. In Italia le
patologie “esofagite, gastroenterite e miscellanea malattie
apparato digerente” (DRG 184) risultano essere la principale
causa di ricovero ospedaliero in età pediatrica2.
La World Health Organization (WHO), l’American
Academy of Pediatrics (AAP), e la European Society for
Paediatric Gastroenterology, Hepatology, and Nutrition (ESPGHAN)
e il database della Cochrane Library raccomandano la
reidratazione orale (ORS) e la rialimentazione precoce per i casi di
AG di grado lieve-moderato3,4.
Il
vomito nella gastroenterite e il bisogno della terapia farmacologica
Nella
fase iniziale della AG, il vomito è il sintomo tipico,
presente nella maggioranza dei casi5. In particolare nella
AG causata dall’infezione da rotavirus, il vomito ripetuto è
presente nel 75% dei bambini durante i primi 3 giorni di malattia6.
Le
correnti raccomandazioni per il trattamento della AG in età
pediatrica non prevedono il trattamento farmacologico3.
Tuttavia il vomito è causa spesso di sconforto sia per il
paziente che per i genitori. Inoltre il vomito può essere non
solo una delle principali cause della stessa disidratazione, ma anche
ostacolare il successo della ORS e pertanto determinare il suo
fallimento. Molti medici ritengono che la presenza del vomito
rappresenti una controindicazione alla terapia di reidratazione orale
(ORT). Inoltre, in un contesto assistenziale come quello del PS, gli
operatori sanitari sono più propensi a utilizzare la
reidratazione per via endovenosa (IVT) nei casi di quando è
presente il vomito come sintomo7,8.
Per tali
ragioni un trattamento efficace del sintomo vomito potrebbe avere un
ruolo importante per ridurre l’utilizzo dell’IVT.
Farmaci
antiemetici e loro uso nella pratica
Diversi
classi di farmaci antiemetici sono utilizzati per prevenire o ridurre
il vomito in corso di AG9. Le fenotiazine sono
degli antagonisti della dopamina e agiscono a livello del sistema
nervoso centrale. Sono prevalentemente utilizzati per la prevenzione
o il trattamento del vomito associato all’uso di farmaci quali
gli oppioidi, gli anestetici generali e i farmaci citotossici.
Sfortunatamente il loro utilizzo può essere associato a eventi
avversi quali la distonia, in particolare in età pediatrica.
La
metoclopramide agisce in modo principale come antagonista del
recettore delle dopamina D2 e ha una azione sia centrale che
periferica. Ha una azione diretta anche a livello del tratto
gastro-intestinale e può essere più efficace delle
fenotiazine per il vomito associata a una malattia gastrointestinale.
Come le fenotiazine, la metoclopramide può causare reazioni
distoniche severe (che possono coinvolgere i muscoli facciali e
quelli scheletrici) e crisi oculogire. Le crisi diatoniche associate
all’uso della metoclopramide si verificano più
frequentemente in età pediatrica. La metoclopramide è
controindicata in Italia al di sotto dei 16 anni per l’evidenza
di gravi reazioni di tipo extra-piramidale10, derivanti da
segnalazioni spontanee e da studi di sorveglianza di tipo
caso-controllo.
Il
domperidone è un antagonista del recettore della
dopamina D2 che agisce sui chemiocettori della zona trigger. Agisce
anche favorendo lo svuotamento gastrico.
L’ondansetron
è uno specifico antagonista che blocca i recettori 5HT3 nel
tratto gastrointestinale e a livello del SNC. È risultato
essere efficace nel trattamento del vomito nei pazienti trattati con
farmaci chemioterapici.
Il
desametasone ha anche effetti antiemetici e può essere
utilizzato per prevenire il vomito causato da chemioterapici, da solo
o in associazione con la metoclopramide o gli antagonisti dei
recettori 5HT3.
Nella
pratica clinica i farmaci antiemetici sono frequentemente utilizzati
in corso di AG. Una recente sorveglianza retrospettiva evidenzia che
l’utilizzo dei farmaci antiemetici è molto variabile nei
diversi contesti osservazionali monitorati sulla base di dati di
prescrizione11. In particolare, dal 2% al 23% dei bambini
con AG ricevono una prescrizione di questa classe di farmaci. Gli
antistaminici (dimenidrato e difenidramina) sono più
frequentemente utilizzate in Germania e Canada, mentre la
prometaziona è prescritta in modo preferenziale negli Stati
Uniti. In Francia, Spagna e Italia il domperidone è il farmaco
più utilizzato come antiemetico. L’ondansetron è
utilizzato in una percentuale minore di bambini con vomito da AG. Una
recente indagine condotta in Italia evidenzia che il 79% di coloro
che hanno risposto a un questionario sull’uso dei farmaci in
corso di AG prescrive farmaci antiemetici (domperidone in primis
seguito dalla metoclopramide)12. I dati di prescrizione
italiani della banca dati ARNO, hanno evidenziato che, tra i farmaci
della classe dei gastrointestinali, vi è una prevalenza
assoluta di prescrizione di procinetici (per l’80% il
domperidone)13.
I farmaci antiemetici nel
vomito da AG: evidenze di efficacia
La
letteratura scientifica che ha valutato l’efficacia dei farmaci
sintomatici nel ridurre il vomito acuto da AG in età
pediatrica di discreta qualità metodologica è molto
esigua e riguarda prevalentemente l’ondansetron, come riportato
nelle 3 metanalisi pubblicate in letteratura14-16. Gli 11
articoli che rispondevano ai criteri di inclusione della metanalisi
hanno valutato diversi farmaci antiemetici (16): ondansetron (n=6),
domperidone (n=2), metoclopromide (N=2), trimetobenzamide (n=2),
pirilamine-pentobarbital (n=2), desametasone (n=1), prometazina
(n=1). I 6 RCT17-22 sull’ondansetron hanno reclutato
una popolazione complessiva di 745 bambini. Tutti hanno utilizzato il
farmaco verso placebo; in due studi la comparazione è stata
fatta anche verso metoclopramide e desametasone16. Tre RCT
hanno previsto l’uso dell’ondansetron per os e 3 per via
endovenosa (e.v). L’ondansetron ridurrebbe rispetto al placebo
il rischio di futuri episodi di vomito (RR: 0,45; 95% IC:, 0,33-0,62;
NNT=5), il numero di casi che hanno la necessità di eseguire
la IVT (RR: 0,41; 95% IC, 0,28-0,62; NNT=5) e il ricovero
ospedaliero, anche se in modo meno evidente rispetto alle altre
misure di esito (RR: 0,52; 95% IC, 0,27-0,95; NNT=14)16.
Il farmaco non riduce i casi che fanno di nuovo ricorso al PS14-16.
Per quanto riguarda gli eventi avversi, non sono segnalate
significative differenze del farmaco rispetto al placebo, fatta
eccezione per la maggiore incidenza di diarrea nei trattati con
ondansetron16.
Per
quanto riguarda il domperidone23,24 e la
metoclopramide21,23, i pochi studi clinici pubblicati (2
per ciascun farmaco) presentano evidenti limiti metodologici (di
numerosità del campione, di misure di esito considerate, di
popolazione inclusa) e non consentono di trarre conclusioni
affidabili sul loro profilo di beneficio/rischio16. Manca
inoltre una valutazione adeguata di confronto rispetto
all’ondansetron. Tutti gli studi analizzati sono stati
sponsorizzati da industrie farmaceutiche.
Il
bisogno di nuove evidenze e la potenziale trasferibilità nella
pratica clinica
Le
evidenze riportate documenterebbero l’efficacia per molecole di
più recente registrazione (ondansetron), ma la valutazione
eseguita riguarda popolazioni molto eterogenee e sulle quali non è
sufficientemente noto il profilo di effettivo
rischio/costo/beneficio; mentre manca qualsiasi valutazione rispetto
a farmaci antiemetici di largo utilizzo nella pratica13,
quali il domperidone.
Questa
carenza conoscitiva è di particolare rilievo se si tiene
conto, almeno in Italia, di indicazioni molto ristrette per il loro
utilizzo (in particolare per la metoclopramide), a fronte di
potenziali effetti collaterali ben documentati, riferibili
prevalentemente a manifestazioni extrapiramidali, perdita di
coscienza, convulsioni, nella maggioranza dei casi dose-dipendenti,
oggetto di un rapporto ad hoc da parte della commissione pediatrica
dell’AIFA25.
Alla luce
di queste considerazioni si ritiene utile valutare, in un contesto
multicentrico, l’efficacia comparativa dell’ondansetron e
del domperidone per il trattamento sintomatico del vomito in corso di
AG.
Lo studio
ha l’obiettivo di rispondere ai seguenti quesiti clinici: a)
gli antiemetici, nei casi che lo richiedono per gravità della
sintomatologia, sono in grado di aumentare la percentuale di bambini
che non vomitano a breve distanza dalla loro somministrazione?; b) è
possibile favorire in questo modo la reidratazione orale e di
conseguenza, ridurre la percentuale dei bambini che richiedono
l’utilizzo di una reidratazione endovena o con sondino
naso-gastrico?; c) può il trattamento ridurre
l’ospedalizzazione o il ricorso di nuovo ai servizi sanitari?
I
risultati di questo studio possono avere un significativo impatto
nella pratica corrente pediatrica. Infatti dovrebbero consentire di
definire la reale efficacia del domperidone, largamente utilizzato
nella pratica clinica (pur in assenza di una chiara evidenza di
efficacia e con un controverso profilo di sicurezza), comparata con
quella dell’ondansetron, il cui utilizzo nel trattamento del
vomito in corso di AG non è autorizzato in Italia, a fronte di
evidenze che ne potrebbero supportare l’utilizzo. Il disegno di
questo RCT, che riflette la normale pratica assistenziale del PS,
dovrebbe avere una immediata trasferibilità dei risultati
nella pratica corrente.
- Obiettivo primario: Valutare se la somministrazione di un farmaco sintomatico per via orale (ondansetron o domperidone) in corso di gastroenterite acuta previene il ricorso alla reidratazione per via endovenosa o con sondino nasogastrico.
- Obiettivi secondari: Valutare se la somministrazione di un farmaco sintomatico (ondansetron o domperidone) riduce la durata complessiva del vomito, il numero di vomiti e la necessità di ricovero ospedaliero o di riammissione in Pronto Soccorso.
Disegno
dello studio
Lo studio
è un trial clinico prospettico multicentrico, randomizzato in
doppio cieco. Lo studio sarà coordinato dall’Istituto
per l’Infanzia IRCCS “Burlo Garofolo” di Trieste e
dal Laboratorio per la Salute Materno Infantile del “Mario
Negri” di Milano.
Popolazione
in studio
Lo studio
sarà condotto negli ospedali, presso i reparti di Pronto
Soccorso e di Emergenza.
Saranno
inclusi nello studio i bambini con età compresa tra 1-6 anni.
Tutti i bambini con vomito che faranno accesso consecutivamente nei
PS durante un periodo di 18 mesi saranno valutati dal medico per
definire i criteri di inclusione ed esclusione dello studio.
Saranno
utilizzati i seguenti criteri di inclusione ed esclusione.
Criteri
di inclusione
- Età compresa tra 1-6 anni;
- Diagnosi presuntiva di gastroenterite acuta in un bambino con vomito, con o senza diarrea (vedi Box 1 per la i criteri di diagnosi di AG e per la definizione di vomito);
- Più di 3 episodi di vomito non biliare, senza sangue, nelle 24 ore precedenti.
Criteri
di esclusione
- Trattamento con farmaci antiemetici o antidiarroici nelle 6 ore antecedenti all’accesso in PS;
- Presenza di una malattia cronica concomitante (tumore, reflusso gastroesofageo, emicrania, insufficienza renale, ipoalbuminemia ecc.);
- Disidratazione severa definita come: perdita di peso >10% o presenza di uno score clinico di disidratazione ≥ 18 per bambini tra 12-24 mesi o ≥ 16 per i bambini > 24 mesi (20) (vedi Box 1 per la definizione dello score clinico di disidratazione);
- Documentata ipersensibilità al domperidone o all’ondansetron
- Precedente inclusione nello studio
- 1) Diagnosi clinica di gastroenterite acuta (AG)Si fa riferimento alla linea guida del NICE (National Institute for Clinical Excellence, vedi testo completo all’indirizzo: www.nice.org.uk/guidance/index.jsp?action=download&o=42316) che raccomanda:“Quando si prende in considerazione la diagnosi di gastroenterite, ricercare le seguenti caratteristiche chiave:
- recente modificazione nella consistenza delle feci a molli o acquose
- recente inizio di vomito
- recente contatto con individuo con diarrea acuta
- esposizione a fonte conosciuta di infezione enterica (acqua o cibo)
- recente viaggio all’estero
Considerare i seguenti sintomi e segni come possibili indicatori di diagnosi diversa da quella di gastroenterite:- febbre alta:
- età minore di 3 mesi: > 38 °C- età maggiore di 3 mesi: > 39 °C- respirazione rapida o difficile
- fotofobia, rigidità nucale, fontanella tesa (nei bambini con meno di 1 anno)
- rash cutaneo che non impallidisce (emorragico)
- sangue e/o muco nelle feci
- vomito biliare (verde)
- dolore addominale o biliare severo
- distensione addominale o dolorabilità di rimbalzo”
2) VomitoIn accordo con la linea guida del NICE (www.nice.org.uk/guidance/index.jsp?action=download&o=42316), si definisce il vomito come una espulsione forzata del contenuto dello stomaco fino a e al di fuori della bocca. Episodi separati da non più di 2 minuti sono considerati come un singolo episodio. Conati di vomito non produttivi, salivazione/scialorrea non sono considerati vomito (20).3) Protocollo standard per la somministrazione di soluzione di reidratazione orale (ORS) nello studio11a ora:Età tra 1 e 2 anni: 50 cc di ORS a bassa osmolarità* somministrata fredda, in piccole quantità e frequentemente (piccolo sorsi, con intervallo tra uno e l’altro); questa quantità corrisponde a ½ cucchiaio da caffè (equivalente a 1,5 cc) ogni 2 minuti;Età tra 3 e 6 anni: 100 cc di ORS a bassa osmolarità* somministrata fredda, in piccole quantità e frequentemente (piccolo sorsi, con intervallo tra uno e l’altro); questa quantità corrisponde a 1 cucchiaio da caffé (equivalente a 3-3,5 cc) ogni 2 minuti.Dalla 2a alla 6a ora:ORS fredda somministrata a sorsi secondo il seguente schema:- disidratazione lieve: 30-60 ml/kg di peso corporeo ogni 4-6 ore- disidratazione moderata: 60-90 ml/kg di peso corporeo ogni 4-6 ore* ORS a bassa osmolarità: sodio 60 mmol/lnota1: Questo protocollo standard è il risultato della combinazione tra raccomandazioni delle linee guida internazionali e indicazioni dei centri partecipanti allo studio derivanti dalla pratica clinica in Pronto Soccorso.4) Score clinico di disidratazione*- 1 punto2 punti3 puntiTempo di retrazione della plica cutaneaImmediato[]Lento (≤ 2 sec)[]Molto lento (> 2 sec)[]Sensazione della pelle al tattoNormale[]Asciutta[]Fredda o marezzata[]Mucosa della boccaUmida[]Asciutta[]Molto asciutta[]Lacrime (se <24 mesi)Presenti[]Ridotte[]Nessuna[]Frequenza cardiacaNella norma[]Tachicardia lieve(≤ 10% della norma)[]Tachicardia moderata(> 10% della norma)[]UrineDi normale quantità e colore[]Di ridotta quantità edi colore più scuro[]Assenti da più di 6 ore[]Stato mentaleAssetato, in allerta[]Sonnolento, irritabile, irrequieto[]Fiacco, letargico[]
Disidratazione severa definita daBambini tra 12-24 mesi: punteggio finale ≥ 18Bambini >24 mesi:punteggio finale ≥ 16* Tratto da: Freedman SB, Adler M, Seshadri R, Powell E. Oral ondansetron for gastroenteritis in a paediatric emergency department. N Engl J Med 2006; 354:1698-705.Box 1.
Intervento
Dopo
avere valutato la presenza dei criteri di esclusione e inclusione, i
bambini riceveranno inizialmente la terapia reidratante orale (ORS),
secondo un protocollo standard (vedi Box 1 per la
definizione). L’ORS sarà prescritta dal medico e sarà
somministrata con la supervisione dell’infermiere del PS.
In caso
fallimento della iniziale ORS, definita come: 1) vomito dopo la
somministrazione dell’ORS, valutata dal medico o
dall’infermiere o 2) rifiuto dell’assunzione della
soluzione dopo 3 tentativi, il paziente sarà randomizzato a
ricevere una soluzione orale di:
1)
ondansetron (0,15 mg/kg);
2)
domperidone (0,5 mg/kg);
3)
placebo.
In caso
di vomito del farmaco entro 15 minuti dalla sua somministrazione la
dose può essere ripetuta.
Dopo
45-60 minuti dal trattamento, sarà realizzato un secondo
tentativo di ORS, seguendo le modalità standard del protocollo
(vedi Box 1).
Una volta
verificati i criteri di inclusione nello studio e il fallimento della
somministrazione iniziale della ORS, dopo adeguata informazione e
prima della randomizzazione del paziente, il medico dovrà
ottenere il consenso scritto alla partecipazione allo studio da parte
dei genitori o da parte dei rappresentanti legali del bambino.
Andrà
tenuto un registro di tutti i pazienti a cui è stato proposto
di entrare nello studio, in cui riportare le ragioni del rifiuto a
parteciparvi.
Una
flow-chart che descrive le procedure del trial e i gruppi di
randomizzazione è riportata nella Figura 1.
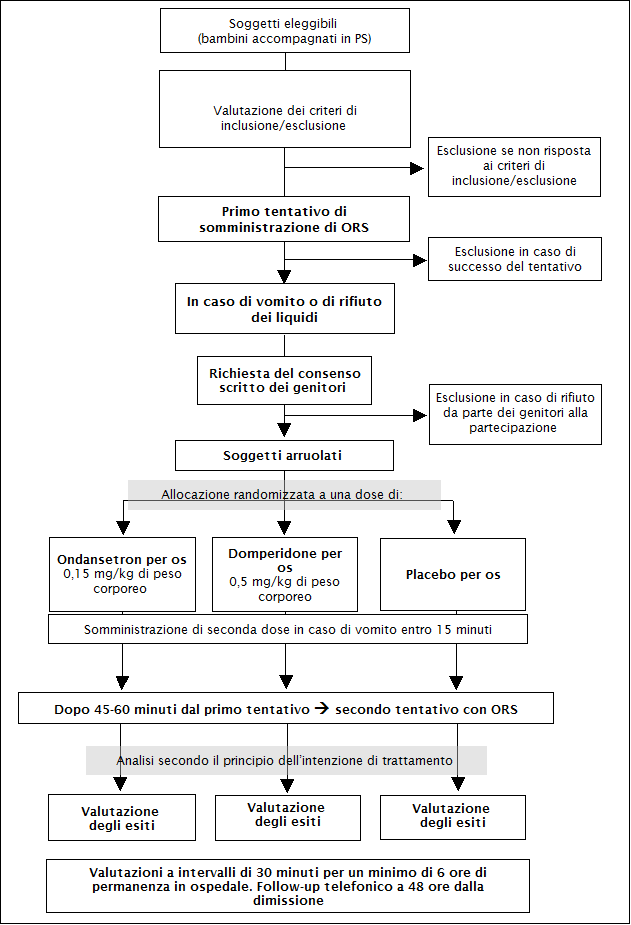
Misure
di esito
Primarie
Percentuale
dei pazienti che necessitano del passaggio alla reidratazione con
sondino nasogastrico o per via endovenosa per il fallimento di quella
orale (per vomito o rifiuto nell’assunzione) a distanza dalla
somministrazione del farmaco sintomatico.
Secondarie:
- Percentuale di soggetti che necessitano di ricovero per la stessa malattia
- Percentuale di soggetti che richiedono osservazione in Pronto Soccorso per un periodo superiore alle 6 ore per la stessa malattia
- Durata complessiva del vomito nei 3 gruppi di trattamento
- Numero di vomiti nei 3 gruppi di trattamento durante il periodo di follow-up
- Percentuale di soggetti che presentano eventi avversi.
I dati
riguardanti le misure di esito saranno raccolti dal medico di guardia
o dall’infermiere durante la permanenza del bambino in PS (o
nelle altre strutture pediatriche deputate all’osservazione)
con l’utilizzo di una scheda di rilevazione standardizzata. I
pazienti saranno valutati a intervalli di 30 minuti per un tempo non
inferiore alle 6 ore.
Durante
la permanenza in Ospedale sia il medico che l’infermiere non
conosceranno il trattamento che è stato assegnato.
Un
follow-up telefonico sarà eseguito a 48 ore dalla dimissione
dal PS, utilizzando una apposita scheda di rilevazione, da parte di
un assistente ricercatore di ciascun centro che non sarà a
conoscenza del trattamento eseguito.
Nota:
È stato discusso se considerare il ricovero ospedaliero come
misura di esito primaria. Tuttavia i criteri per il ricovero
ospedaliero potrebbero essere molto diversi tra i vari Ospedali e i
PS ed esistono tra i Centri varie tipologie di ricovero, compresa
“l’osservazione breve”, nelle modalità con
cui viene definita e applicata. Una recente revisione della
letteratura sui trial clinici sull’ondansetron conferma che
quando è stata considerata l’ospedalizzazione come
misura di esito è risultata esserci molta eterogeneità
nei risultati ottenuti. Gli Autori considerano che i differenti
criteri di ospedalizzazione possono spiegare questa variabilità.
La definizione e la standardizzazione dei criteri di ricovero
ospedaliero sono difficili da ottenere a causa delle caratteristiche
diverse, da un punto di vista amministrativo e organizzativo, dei
vari reparti di PS. È tuttavia da considerare che la
reidratazione per via nasogastrica o endovena rappresenta una misura
di esito spesso indicativa di ricovero ospedaliero (o di osservazione
breve).
Randomizzazione
I
pazienti saranno randomizzati a blocchi di nove, a ricevere
l’ondansetron o il domperidone o il placebo. La lista di
randomizzazione sarà generata utilizzando il software STATA e
sarà stratificata per centro partecipante. La procedura di
randomizzazione sarà centralizzata e gestita da uno statistico
del Centro Coordinatore dello studio, indipendente rispetto alla
ricerca.
La lista
di randomizzazione sarà trasmessa a una farmacia centrale che
si occuperà della preparazione e della fornitura dei farmaci
attivi e del placebo. Questi saranno distribuiti direttamente dalla
farmacia ai centri partecipanti.
Dopo la
verifica dei criteri di inclusione e dopo il fallimento della prima
somministrazione orale di soluzione reidratante, il medico o
l’infermiere apriranno il contenitore contenente i farmaci da
somministrare che presenta il numero più basso
disponibile e una dose appropriata pro/kg sarà somministrata
al paziente.
Tutti gli
operatori sanitari e i partecipanti allo studio non saranno a
conoscenza della lista di randomizzazione e delle preparazioni
farmacologiche che sono state assegnate.
Cecità
Le
preparazioni farmaceutiche saranno direttamente inviate ai centri
partecipanti in contenitori chiusi, opachi e numerati in maniera
consecutiva. Le preparazioni saranno rese indistinguibili per odore,
sapore, colore. Gli operatori sanitari e i partecipanti allo studio
non saranno a conoscenza del tipo di farmaco che verrà
somministrato.
Raccolta
delle informazioni
Un
questionario dettagliato sulle caratteristiche demografiche, la
storia medica, la presenza di allergie, la storia anamnestica e
clinica dell’episodio di AG e degli eventuali farmaci
somministrati, sarà compilato al momento del reclutamento dal
medico di guardia.
I dati
relativi alle misure di outcome saranno raccolte dal medico di
guardia o dall’infermiere.
I
pazienti saranno valutati ogni 30 minuti per un tempo minimo di 6 ore
di osservazione. Quarantotto ore dopo la dimissione, un assistente
ricercatore chiamerà al telefono la famiglia al fine di
valutare, con l’utilizzo di un apposito questionario,
l’evoluzione dei sintomi clinici gastrointestinali, l’eventuale
successiva ospedalizzazione o il nuovo accesso alla struttura di PS.
Le
informazioni saranno raccolte in un apposito database elettronico. La
percentuale dei pazienti che si prevede potranno essere persi al
follow-up, basandosi sui dati della letteratura e tenendo conto del
breve periodo di osservazione dopo la dimissione, può essere
stimata inferiore al 10%20,22.
Calcolo
della numerosità del campione
In
letteratura sono disponibili studi che hanno comparato l’ondansetron
vs placebo, mentre non sono stati condotti studi che hanno comparato
l’ondansetron vs il domperidone. I due studi che hanno valutato
domperidone vs placebo sono di non adeguata qualità
metodologica e con una numerosità campionaria molto bassa.
Sulla base della letteratura disponibile è comunque possibile
ipotizzare una maggiore efficacia dell’ondansetron sia rispetto
al placebo che rispetto al domperidone. Il presente studio viene
quindi disegnato come trial di superiorità.
Per il
calcolo della numerosità campionaria ci siamo riferiti al
trial clinico di Roslund et al22 che ha un disegno dello
studio molto simile al nostro (reclutamento di bambini con AG dopo
fallimento della prima somministrazione di ORS in PS). Tenendo in
considerazione tali criteri stringenti di eleggibilità, si
stima che il reclutamento di 540 bambini (180 per ogni braccio di
trattamento) fornirà allo studio una potenza statistica
dell’80% per identificare una modificazione nella percentuale
di soggetti che richiedono la reidratazione nasogastrica o per via
endovenosa dal 50% nel gruppo placebo al 35% nel gruppo domperidone,
al 20% nel gruppo ondansetron, dato un errore tipo I a due code
<0,05. Data la mancanza di stime disponibili, l’efficacia
del domperidone è stata stimata come intermedia tra
l’ondansetron e il placebo.
Analisi
statistica
Le
caratteristiche di base dei tre gruppi saranno confrontate con il
test del chi-quadrato per le variabili categoriche e con l’analisi
della varianza o con il test di Kruskal-Wallis (a seconda della
distribuzione dei dati) per le variabili continue. I dati categorici
saranno presentati come rischi relativi e intervalli di confidenza al
95% mentre quelli continui come medie e deviazioni standard. Per le
misure di esito categoriche le differenze tra i gruppi saranno
valutate con il test del chi-quadrato; per le variabili continue
mediante l’analisi della varianza o il test di Kruskal-Wallis,
a seconda della distribuzione dei dati.
Le
analisi saranno effettuate con il software STATA (versione 9),
secondo l’analisi per intenzione di trattamento
(intention-to-treat). Tutti i valori di p saranno a due code, con un
valore di p inferiore a 0,05 usato per indicare la significatività
statistica.
Caratteristiche
Organizzative
Coordinamento
dello studio
Lo studio
sarà coordinato dal Dipartimento di Pediatria e dall’Unità
di Epidemiologia e Biostatistica, Istituto per la l’Infanzia,
IRCCS “Burlo Garofolo”, Trieste e dal Laboratorio per La
Salute Materno Infantile, Istituto di Ricerche Farmacologiche “Mario
Negri”, Milano. Le Unità che coordinano lo studio
saranno responsabili della formazione dei Centri partecipanti allo
studio, delle procedure di randomizzazione, del monitoraggio, della
raccolta e analisi dei dati, dei rapporti e delle pubblicazioni sui
risultati dello studio, che ci si impegna a realizzare
indipendentemente dai risultati dello studio stesso e a nome
dell’intero gruppo di lavoro.
I
pazienti saranno arruolati nelle seguenti 15 Strutture di Pronto
Soccorso Pediatrico:
-
Dipartimento di Emergenza Pediatrica, Azienda Ospedaliera -
Università di Padova (Referente: dott. Tiziana Zangardi)
- Unità
Operativa di Pediatria, Ospedale GB Morgagni, Forlì
(Referente: dott. Enrico Valletta)
-
Dipartimento di Emergenza Pediatrica, Ospedale Pediatrico Bambino
Gesù, IRCCS, Roma (Referente: dott. Antonino Reale)
-
Dipartimento di Emergenza Pediatrica, P.O. Spedali Civili, Brescia
(referente: dott. Alberto Arrighini)
-
Dipartimento di Pediatria, Azienda Policlinico, Modena (referente:
dott. Paolo Bertolani)
- Unità
di Terapia Intensiva Pediatrica, Ospedale Civile Maggiore, Verona
(referente: dott. Paolo Biban)
-
Divisione di Emergenza Pediatrica, Istituto “G. Gaslini”,
Genova (referenti: dott. Salvatore Renna, dott. Pasquale Di Pietro)
-
Dipartimento di Pediatrica, Azienda Ospedaliera - Università
di Parma (referente: dott. Maria Teresa Tondelli)
-
Divisione di Emergenza Pediatrica, Ospedale Pediatrico “A.
Meyer”, Firenze (Referenti: dott. Anna Pazzaglia, dott.
Francesco Mannelli)
-
Dipartimento di Emergenza Pediatrica, Istituto per la l’Infanzia,
IRCCS “Burlo Garofolo”, Trieste (Referenti: dott. Gianni
Messi)
-
Dipartimento di Pediatrica, Ospedale di Macerata (referente: dott.
Paolo Francesco Perri)
-
Dipartimento di Emergenza Pediatrica, Ospedale Infantile “Regina
Margherita”, Torino (Referente: dott. Antonio Francesco Urbino)
- Dipartimento di Emergenza Pediatrica, Ospedale “Giuseppe
Moscati”, Avellino (Referente: dott. Antonio Vitale)
-
Dipartimento di Pediatria, Ospedale Castelli, Verbania (Referente:
dott. Andrea Guala)
-
Dipartimento di Pediatria, Ospedale di Treviso (Referente dott.
Liviana Da Dalt)
Tempistiche
del lavoro
La durata
complessiva dello studio è prevista in 24 mesi. Il
reclutamento dei pazienti avverrà in un arco di tempo di 18
mesi. Ciascun paziente arruolato sarà monitorato ogni 30
minuti per un periodo minimo di 6 ore durante la permanenza in PS.
Ciascun paziente sarà contattato telefonicamente dopo 48 ore
dalla dimissione dall’ospedale al fine di valutare gli esiti a
distanza. Incontri tra il centro Coordinatore e le singole Unità
Operative partecipanti allo studio sono previsti ogni 8 mesi, con
l’obiettivo di realizzare un aggiornamento sull’andamento
dello studio e discutere eventuali criticità. Il rapporto
finale dello studio è previsto entro 6 mesi dalla conclusione
dello studio.
Buona
pratica clinica e controllo della qualità
Diverse
azioni saranno intraprese per garantire la qualità globale
dello studio, e quindi per massimizzare la sua validità e
affidabilità:
- il Comitato Direttivo realizzerà un monitoraggio della sicurezza, della qualità complessiva e dell’integrità scientifica dello studio. Qualsiasi problema dovesse emergere durante lo studio, compresa la valutazione di eventi avversi, sarà discusso dai membri del Comitato Direttivo e le decisioni saranno quindi condivise con le Unità partecipanti. Nel corso dello studio sarà realizzata da parte di membri del Comitato una visita di monitoraggio in ciascun centro;
- prima dell’inizio dello studio e ogni 8 mesi, saranno organizzati incontri tra il Centro Coordinatore e le Unità partecipanti per rendere standard le procedure, discutere lo svolgimento della ricerca e affrontare eventuali problemi emergenti:
- i Coordinatori delle diverse Unità partecipanti organizzeranno incontri locali di formazione con infermieri e medici coinvolti nello studio sul campo per spiegare e discutere procedure e flow chart;
- la procedura di randomizzazione sarà centralizzata presso il Centro Coordinatore e gestita da uno statistico indipendente;
- le preparazioni farmaceutiche saranno predisposte e inviate direttamente alle Unità Partecipanti da una farmacia centrale indipendente;
- i documenti prodotti per lo studio (scheda per la raccolta dei dati, database elettronico, consenso informato) saranno standard per tutte le Unità partecipanti;
- verranno predisposti e distribuiti documenti scritti sul processo dello studio e un manuale per infermieri e medici coinvolti nello studio sul campo con incluse istruzioni su come compilare la scheda raccolta dati e il database elettronico;
- il database elettronico sarà periodicamente valutato dal Centro Coordinatore rispetto alla accuratezza della sua compilazione;
- un report sullo stato di avanzamento dello studio sarà prodotto ogni 8 mesi dal Centro Coordinatore.
Monitoraggio
della sicurezza
Definizione
di evento avverso, reazione avversa e evento avverso serio (o grave)
Evento
avverso (Adverse Event, AE): un AE è un evento clinico
spiacevole che si verifica in un paziente o in un soggetto incluso in
una sperimentazione in seguito alla somministrazione di un
trattamento e che non ha necessariamente un rapporto di causalità
con il trattamento stesso. Un AE può perciò essere
qualsiasi segno (p.es. anche un risultato anomalo di un esame di
laboratorio), sintomo o patologia sfavorevole e non intenzionale,
temporalmente associato con l’impiego di un prodotto
medicinale, indipendentemente dal fatto che sia considerato o no
associato al prodotto medicinale.
Reazione
avversa (Adverse Drug Reaction, ADR): Si definisce reazione avversa
da farmaco, qualsiasi risposta a un farmaco che sia nociva e non
intenzionale e che si verifica a prescindere dalla dose
somministrata. Nel caso della reazione avversa, è possibile o
quantomeno non può essere escluso un nesso causa-effetto tra
il prodotto medicinale e l’evento osservato.
Evento
avverso serio (SAE) o reazione avversa seria (SAR): Qualsiasi evento
avverso o reazione avversa che: provoca la morte; mette in pericolo
la vita del paziente; richiede l’ospedalizzazione del paziente
o prolunga l’ospedalizzazione; risulta in una persistente o
significativa disabilità/incapacità.
Monitoraggio
degli eventi avversi
Tutti gli
eventi avversi che si manifestino nei pazienti coinvolti nello studio
verranno raccolti e riportati dagli sperimentatori sulla scheda di
raccolta dati. Saranno registrati tutti gli eventi avversi che si
verifichino nelle prime 48 ore dopo la somministrazione dei
trattamenti.
Procedure
per la segnalazione degli eventi avversi seri (SAE)
Qualsiasi
evento avverso serio dovrà essere segnalato immediatamente
dallo sperimentatore al promotore dello studio. Alla segnalazione
telefonica deve seguire una comunicazione scritta via fax o via
e-mail, utilizzando un’apposita scheda di segnalazione. Si
definiscono come sospette reazioni avverse serie e inattese (SUSAR,
Suspected Unexpected Serious Adverse Reaction) le reazioni avverse
gravi non attese sulla base delle informazioni riportate nel
Riassunto delle Caratteristiche del Prodotto. Il promotore è
l’unico responsabile dell’invio dei report sulle SUSAR a
tutti gli sperimentatori partecipanti, all’Agenzia Italiana del
Farmaco e ai comitati etici in accordo con quanto previsto dalla
normativa italiana e dalle linee guida ICH/GCP.
Aspetti
etici
Lo studio
sarà sottoposto all’approvazione da parte dei Comitati
Etici di tutte le Unità partecipanti che dovranno arruolare
pazienti. Tutti i pazienti riceveranno adeguate informazioni, anche
scritte, sullo studio e sarà proposta loro una apposita scheda
per l’espressione del consenso informato. I dati saranno
trattati ai sensi del Decreto Legge 196/03 (Art. 7 e 13) e della
deliberazione n. 52 del 24 luglio 2008 del Garante per la protezione
dei dati personali (GU n. 190 del 14-8-2008).
Lo
studio è finanziato dall’Agenzia Italiana del Farmaco
(AIFA), bando per la ricerca indipendente 2008.
Codice
AIFA: FARM8E53XM; Codice Eudract: 2010- 019787- 36
Conflitto
di interesse: non dichiarato.
Abbreviazioni
AAP:
American Academy of Pediatrics
AIFA:
Agenzia Italiana del Farmaco
AG:
Gastroenterite acuta
ARNO:
progetto ARNO (Osservatorio sulla prescrizione farmaceutica)
ESPGHAN:
European Society for Paediatric Gastroenterology, Hepatology, and
Nutrition
DRG:
Raggruppamenti Omogenei di Diagnosi (Diagnosis-related group)
IRCCS:
Istituto di Ricovero e Cura a Carattere Scientifico
IVT:
reidratazione per via endovenosa
NICE:
National Institute for Clinical Excellence
NNT:
numero necessario da trattare per ottenere un esito (Number Needed to
Treat)
ORS:
soluzione di reidratazione orale
ORT:
terapia di reidratazione orale
PS:
Pronto Soccorso
RCT:
trial controllato randomizzato
WHO:
Organizzazione Mondiale della Sanità
1.
Malek MA, Curns AT, Holman RC, et al. Diarrhea- and
rotavirus-associated hospitalizations among children less than 5
years of age: United States, 1997 and 2000. Pediatrics
2006;117:1887-92.
2.
Fontana M, Federico P, Cantucci S. Il ricovero pediatrico in
Lombardia: cause, variabilità e possibile inappropriatezza.
Medico e Bambino
2007;26:520-6.
3.
King CK, Glass R, Bresee JS, Duggan C.
Managing acute gastroenteritis among children: oral rehydration,
maintenance, and nutritional therapy. MMWR
Recomm Rep
2003;52:1-16.
4.
Guarino A, Albano F, Ashkenazi S, et al.
European Society for Paediatric Gastroenterology, Hepatology, and
Nutrition/European Society for Paediatric Infectious Diseases
evidence-based guidelines for the management of acute gastroenteritis
in children in Europe: executive summary. J
Pediatr Gastroenterol Nutr 2008;46:619-21.
5.
Elliott EJ. Acute gastroenteritis in
children. BMJ
2007;334:35-40.
6.
Bass ES, Pappano DA, Humiston SG.
Rotavirus. Pediatr Rev
2007;28:183-91.
7.
Ozuah PO, Avner JR, Stein RE. Oral
rehydration, emergency physicians, and practiceparameters: a national survey. Pediatrics
2002;109:259-61.
8.
Reis EC, Goepp JG, Katz S, Santosham M. Barriers to use of oral
rehydration therapy. Pediatrics
1994;93:708-11.
9.
British National Formulary 54. London: BMJ
Publishing Group Ltd; RPS Publishing; 2007.
10.
Menniti-Ippolito F, Traversa G, Da Cas R, et al. Extrapyramidal
reactions in children treated with metoclopramide.
Ital J Pediatr
2004;30:49-52.
11.
Pfeil N, Uhlig U, Kostev K, et al. Antiemetic
medications in children with presumed infectious
gastroenteritis--pharmacoepidemiology in Europe and Northern America.J Pediatr 2008;153:659-62.
12.
Albano F, Bruzzese E, Spagnuolo M, et al. Antiemetics
for children with gastroenteritis: off label but still on in clinical
practice. J Pediatr Gastroenterol Nutr 2006;43:402-4.
13. AAVV.
Il profilo prescrittivo della popolazione pediatrica italiana nelle
cure primarie. Gastrointestinali. Ricerca
& Pratica 2004;120:267-72.
14.
Alhashimi D, Alhashimi H, Fedorowicz Z. Antiemetics for reducing
vomiting related to acute gastroenteritis in children and
adolescents. Cochrane Database Syst Rev
2006;3:CD005506.
15.
Szajewska H, Gieruszczak-Bialek D, Dylag M.
Meta-analysis: ondansetron for vomiting in acute gastroenteritis in
children. Aliment Pharmacol Ther
2007;25:393-400.
16.
DeCamp LR,
Byerley JS, Doshi
N, Steiner MJ.
Use of antiemetic agents in acute
gastroenteritis: a systematic review and meta-analysis. Arch
Pediatr Adolesc Med 2008;162:858-65.
17.
Stork CM, Brown KM, Reilly TH, Secreti L, Brown LH. Emergency
department treatment of viral gastritis using intravenous ondansetron
or dexamethasone in children. Acad Emerg
Med 2006;13:1027-33.
18.
Reeves JJ, Shannon MW, Fleisher GR. Ondansetron decreases vomiting
associated with acute gastroenteritis: a randomized, controlled
trial. Pediatrics. 2002; 109(4):e62.
http://www.pediatrics.org/cgi/content/full/109/4/e62.
19.
Ramsook C, Sahagun-Carreon I, Kozinetz CA, Moro-Sutherland D. A
randomized clinical trial comparing oral ondansetron with placebo in
children with vomiting from acute gastroenteritis. Ann
Emerg Med 2002;39:397-403.
20.
Freedman SB, Adler M, Seshadri R, Powell EC. Oral
ondansetron for gastroenteritis in a pediatric emergency department.
N Engl J Med
2006;354:1698-705.
21.
Cubeddu LX, Trujillo LM, Talmaciu I, et al. Antiemetic activity of
ondansetron in acute gastroenteritis. Aliment
Pharmacol Ther 1997;11:185-91.
22.
Roslund G, Hepps TS, McQuillen KK. The role of oral ondansetron in
children with vomiting as a result of acute gastritis/gastroenteritis
who have failed oral rehydration therapy: a randomized controlled
trial. Ann Emerg Med 2008;52:22-9.
23.
Van Eygen M, Dhondt F, Heck E, Ameryckx L, Van Ravensteyn H. A
double-blind comparison of domperidone and metoclopramide
suppositories in the treatment of nausea and vomiting in children.
Postgrad Med J
1979;55(suppl 1):36-9.
24.
Dhondt F, Traen S, VanEygen M, Baran D, Willaert H. Domperidone
(R-33812) suppositories: an effective antiemetic agent in diverse
pediatric conditions: multi center trial. Curr Ther Res Clin
Exp 1978;24:912-23.
25.
Marchetti F, Santuccio C per il gruppo di lavoro sui Farmaci
Pediatrico AIFA. Il Trattamento farmacologico del vomito: bilancio
tra i rischi e benefici. Bif 2007;5:1-16 (inserto).
Vuoi citare questo contributo?
