Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Ottobre 2023 - Volume XXVI - numero 8
M&B Pagine Elettroniche
Pediatria per l'ospedale
Una sindrome infiammatoria multisistemica “fredda” complicata da shock
Caso clinico e revisione della letteratura
1Scuola di Specializzazione in Pediatria, Alma Mater Studiorum, Università di Bologna
2UOC di Pediatria, Ospedale Maggiore, AUSL di Bologna
Indirizzo per corrispondenza: mattia.moratti@studio.unibo.it
A “cold” multisystem inflammatory syndrome complicated by shock: a literature review starting from the difficult management of a complex case
Key words: Atypical MIS-C, POCUS, Shock
Abstract
Rationale - In clinical practice there are numerous factors influencing the correct process of diagnosis and treatment, especially in the context of complex clinical cases such as severe and atypical forms of "multisystem inflammatory syndrome" (MIS-C): several studies have observed that in the Emergency Department fewer than half of cases of hemodynamic shock are treated according to Paediatric Advanced Life Support (PALS) guidelines.
Objectives - To favour the recognition of MIS-C in its atypical form and to provide indications on the correct treatment in the course of its acute complications such as mixed shock (distributive-cardiogenic).
Materials and methods - Starting from the analysis of a clinical case, the literature about MIS-C and the management of mixed shock in the Emergency Department was reviewed. The paper describes the case of a patient with atypical MIS-C characterized by multiple organ failure syndrome, highlighting possible interventions of good clinical practice aimed to improve the outcome of patients affected by these disorders.
Results - The analysis of the literature and guidelines has allowed new management guidelines for atypical MIS-C syndrome to be produced, in order to obtain a better outcome, despite a highly severe clinical scenario.
Conclusions - Although there are no studies on the treatment of MIS-C shock in the literature, in view of the pathogenic continuum between MIS-C and Kawasaki syndrome, the adapted application of the American Heart Association guidelines allows the achievement of a good outcome even in cases of MIS-C with severe presentation.
Riassunto
Razionale - Nella pratica clinica esistono numerosi fattori che possono influenzare il corretto processo di diagnosi e cura, soprattutto nel contesto di casi clinici complessi come forme severe e atipiche di sindrome infiammatoria multisistemica (MIS-C): diversi studi hanno osservato che in Pronto Soccorso meno della metà dei casi di shock emodinamico è trattata rispettando le linee guida del Pediatric Advanced Life Support (PALS).
Obiettivi - Favorire il riconoscimento del quadro della MIS-C nella sua forma atipica e fornire indicazioni sul trattamento corretto in corso di complicanze acute come lo shock misto (distributivo-cardiogeno).
Materiali e metodi - A partire dall’analisi di un caso clinico, è stata effettuata una revisione della letteratura inerente alla MIS-C e alla gestione dello shock misto in Pronto Soccorso. Descriviamo il caso di una paziente con MIS-C atipica caratterizzata da sindrome da insufficienza d’organo multipla in cui sono stati evidenziati possibili interventi di buona pratica clinica, atti a migliorare l’outcome dei pazienti con quadro patologico analogo.
Risultati - L’analisi della letteratura e delle linee guida ha permesso di tracciare nuove linee di gestione di una sindrome MIS-C atipica, permettendo di ottenere un outcome ottimale, nonostante un quadro clinico di alta severità.
Conclusioni - Nonostante in letteratura non esistano studi relativi al trattamento dello shock da MIS-C, in considerazione del continuum patogenetico tra MIS-C e sindrome di Kawasaki, l'applicazione adattata delle linee guida della American Heart Association consente il raggiungimento di un buon outcome anche in casi di MIS-C con presentazione severa.
Caso clinico
Una bambina di 6 anni giungeva in Pronto Soccorso Pediatrico per prostrazione associata a dolore addominale diffuso, diversi episodi di vomito e due evacuazioni diarroiche in apiressia esorditi da 24 ore.
All’anamnesi i genitori riferivano un episodio febbrile a risoluzione spontanea nella settimana precedente, per il resto non emergevano altri elementi di rilievo clinico, anche se la raccolta anamnestica era limitata da una forte barriera linguistica. Alla visita la bambina presentava mucose disidratate, cute pallida con pomfi circolari sulla superficie degli avambracci e delle cosce; tuttavia, la restante obiettività clinica e i parametri vitali non indicavano alterazioni degne di nota (pressione arteriosa 80/40 mmHg, frequenza cardiaca 120 bpm; tempo di refill 3”, punteggio Gorelick 4 - deficit idrico moderato 5-9%).
Visto il quadro di disidratazione da verosimile gastroenterite virale, previa esecuzione degli esami ematici e dei tamponi faringo-nasali per streptococco di gruppo A e SARS-CoV-2 (risultati negativi con riferita storia negativa per pregresse infezioni), la paziente, dopo somministrazione di ondansetron linguale, iniziava la reidratazione orale con soluzione reidratante in regime di Osservazione Breve Intensiva.
Nelle ore seguenti, in corso di trattamento, la bambina manifestava un episodio di irrigidimento degli arti superiori con estensione delle mani e del capo della durata di alcuni secondi, con successivo stato soporoso della durata di alcuni minuti. Alla rivalutazione medica le condizioni della piccola apparivano peggiorate: si presentava tachicardica (134 bpm), tachipnoica (32 atti/min), ipotesa (80/40 mmHg) e fortemente astenica; l’esame obiettivo neurologico evidenziava disturbi di equilibrio, della coordinazione e ipostenia. A causa del rapido peggioramento, si poneva un dubbio in merito alla completezza della raccolta anamnestica, per cui a un’analisi più approfondita emergeva la presenza di una contrazione della diuresi da circa 24 ore.
A questo punto, ormai nel turno notturno, la paziente appariva in stato di shock emodinamico, di verosimile natura ipovolemica.
Contestualmente alla constatazione dell’evoluzione del quadro clinico, l’esito degli esami ematici mostrava leucocitosi neutrofila (leucociti 20.710/mm3, di cui neutrofili 89%, linfociti 9%, monociti 1,5%), grave disfunzione renale (urea 74 mg/dl, creatinina 1,11 mg/dl), elevazione degli indici di flogosi (ferritina 586 ng/ml, procalcitonina 178 ng/ml, proteina C reattiva 39 mg/dl, interleuchina 6 245 pg/ml), aumento dei lattati (acido lattico 3,7 mmol/l) e iponatriemia severa (Na 123 mmol/l).
Durante i tentativi di reperire un accesso vascolare, la bambina presentava nuovamente una crisi con irrigidimento dei quattro arti, deviazione dello sguardo verso destra e perdita di contatto per circa una decina di secondi; in ragione dell’iponatriemia severa sintomatica si effettuava un bolo di soluzione ipertonica al 3% a una dose di 1,5 ml/kg/30 min, seguito da somministrazione di soluzione fisiologica, inizialmente con tre boli da 10 ml/kg e poi con infusione di mantenimento; inoltre, per copertura antimicrobica nonostante l’apiressia, si somministrava una dose di ceftriaxone.
In considerazione del quadro di instabilità emodinamica e del riscontro all’auscultazione cardiaca di toni cardiaci ovattati, a completamento diagnostico si eseguivano in emergenza un elettrocardiogramma risultato nella norma e una radiografia del torace che mostrava incremento dei diametri cardiaci con aspetto prominente degli ili verosimilmente su base vascolare; per il ripetersi di due ulteriori episodi di crisi convulsive si eseguiva una TC encefalo che risultava nella norma.
A distanza di circa un’ora dall’inizio della correzione della iponatriemia severa con boli infusionali, la bambina non aveva più presentato episodi critici, con notevole miglioramento dello stato di vigilanza e della reattività; i parametri vitali erano ancora critici benché in miglioramento tuttavia, gli esami di laboratorio ripetuti a sei ore dall’esordio dei sintomi neurologici mostravano un peggioramento degli indici di citolisi e di funzionalità epatica (ALT 1155 U/l, AST 3906 U/l, INR 1,82) e renale (urea 104 mg/dl, creatinina 1,48 mg/dl). A scopo diagnostico-terapeutico si posizionava quindi un catetere urinario e in tale occasione si riscontrava una mucosa genitale fortemente infiammata e sanguinante; l’esame ecografico addominale mostrava la colecisti con pareti ispessite con edema della regione peri-colecistica.
Visto il quadro infiammatorio con interessamento poli-distrettuale, pur in assenza di febbre, si poneva il sospetto diagnostico di sindrome infiammatoria multisistemica da Covid-19 (MIS-C), avvalorato dall’esecuzione di un’ecografia cardiaca che evidenziava un quadro di miocardite severa con ipocinesia globale (frazione di eiezione (FE) del ventricolo sinistro 28%), insufficienza mitralica e tricuspidalica e ipertensione polmonare.
All’undicesima ora dalla presa in carico si osservava una lieve riduzione dei lattati con incremento della sodiemia (acido lattico 2,3 mmol/l, Na 126 mmol/l), associati a un rilevante incremento della ferritinemia (ferritina > 7500 ng/ml) nel contesto di elevati indici di lisi epatica e sofferenza cardiaca (troponina 153 ng/l, peptide natriuretico cerebrale BNP 2369 pg/ml); la bambina appariva francamente astenica ma in stato di coscienza conservato: non aveva più presentato episodi critici convulsivi e dopo la reidratazione per via infusionale e la cateterizzazione vescicale, la diuresi era tornata ai limiti di norma (0,8 ml/kg/h).
Nel sospetto di miocardite da quadro infiammatorio post-infettivo MIS-C-relato, si iniziava terapia con immunoglobuline a dosaggio immunomodulante (2 g/kg) e metilprednisolone endovena; a supporto della circolazione sistemica si avviava infusione di inotropo (dopamina 5 µg/kg/min).
Alla ventiduesima ora dall’arrivo in Pronto Soccorso Pediatrico, si stabilizzava la paziente con successivo trasferimento in Terapia Intensiva Cardiologica con diagnosi di shock cardiogeno in corso di miocardite acuta, insufficienza multi-organo (renale ed epatica), colecistite acuta, crisi convulsive in corso di iponatriemia severa e rialzo di indici di flogosi, elementi che configuravano un quadro suggestivo di MIS-C.
La diagnosi di MIS-C trovava supporto nel riscontro al pannello sierologico esteso di anticorpi anti SARS-CoV-2 (IgG 187 BAL/m) e negatività per gli altri virus testati; dopo quattro giorni di ricovero in Terapia Intensiva, si sospendeva il supporto inotropo per miglioramento della funzionalità ventricolare; a una settimana dall’esordio si intraprendeva terapia antiaggregante con acido acetilsalicilico e infine, a distanza di due settimane dall’arrivo in Pronto Soccorso, si dimetteva la paziente a domicilio in ottime condizioni cliniche, con un programma di scalo della terapia steroidea fino alla completa sospensione.
Discussione
L’epidemia da malattia da coronavirus 2019 (Covid-19) causata dall’infezione da SARS-CoV-2, esordita dalla fine del 2019, è stata associata a mortalità e morbilità diffuse, sia negli adulti sia nei bambini1.
Nonostante studi di sieroprevalenza svolti negli Stati Uniti abbiano mostrato che i tassi di sieropositività per anticorpi anti-SARS-CoV-2 sono più elevati nella popolazione pediatrica rispetto a quella degli adulti2, nei bambini è riportata una minore incidenza di infezioni sintomatiche, gravi e sequele, inclusa la MIS-C3, che ricorre in 0,4-5,5/100.000 pazienti pediatrici a un’età media di 6-11 anni4-6, con una latenza da due a sei settimane dallo sviluppo di Covid-194,7.
I primi casi di MIS-C, risalenti ad aprile 20208, sono stati inquadrati come un disordine iperinfiammatorio analogo alla sindrome di Kawasaki9.
Con il tempo, è stato osservato come la predominanza di segni e sintomi gastrointestinali e il risentimento miocardico diffuso con compromissione del circolo sanguigno siano condizioni più suggestive di MIS-C, al contrario delle manifestazioni mucocutanee, più frequentemente associate alla malattia di Kawasaki7,10. Ad oggi non esiste una definizione univoca di caso indice universalmente riconosciuta per la MIS-C. I due set di criteri diagnostici più comunemente adottati sono quelli proposti dal Center for Disease Control and Prevention (CDC) e dall’Organizzazione Mondiale della Sanità (OMS), basati su età, presenza di febbre, elevazione degli indici di flogosi, coinvolgimento multisistemico di almeno 2 apparati, evidenza di recente infezione da SARS-CoV-2 ed esclusione di altre diagnosi plausibili. Le principali differenze tra le due definizioni riguardano il limite superiore di età (19 anni per l’OMS e 20 per il CDC), la durata della febbre (tre giorni per l’OMS e uno per il CDC), la necessità di ricovero e la presenza di una gamma più ampia di criteri laboratoristici per il CDC11-13.
Iter in emergenza
Il caso descritto ha presentato plurime difficoltà di gestione oggettive, che si prestano a diverse considerazioni sulla gestione del paziente pediatrico.
La prima criticità è la valutazione dello stato di disidratazione. All’arrivo in Pronto Soccorso, l’esame medico non ha rilevato alterazioni significative e i parametri non hanno evidenziato una chiara criticità delle condizioni della paziente: infatti, anche riportando i dati all’interno degli score standardizzati quali il Gorelick score, il WHO score e la Clinical Dehydration Scale, lo stato di disidratazione risultava “moderato”.
Al netto di potenziali errori, non esistono parametri o sistemi di punteggio clinici in grado di predire con sicurezza e accuratezza la gravità dell’ipovolemia14,15.
Una soluzione per oggettivare lo stato volemico del paziente, arginando tale criticità, è rappresentata dall’utilizzo della Point Of Care Ultra Sound (POCUS): diversi studi hanno dimostrato infatti che vi è una correlazione significativa tra riempimento del circolo vascolare e rapporto dei diametri della vena cava inferiore e aorta; in particolare, valori < 0,8 sono associati a uno stato di deplezione di fluidi mentre valori > 1,2 sono indicativi di un eccesso di liquidi. Altri segni indicativi del livello di riempimento del circolo sanguigno sono la variazione della vena cava inferiore durante il ciclo cardiorespiratorio e l'obliterazione della cavità ventricolare sinistra, nota anche come kissing ventricle16,17.
In secondo luogo, l’applicazione della POCUS in questo contesto avrebbe permesso di inquadrare precocemente il deterioramento della cinetica cardiaca fornendo informazioni fisiologiche tali da cambiare l’approccio terapeutico al paziente. L’ecocardiografia permette infatti di rilevare un versamento pericardico e di effettuare una valutazione della funzionalità del ventricolo sinistro tramite due parametri surrogati che sono la frazione di accorciamento e FE, ottenuti a loro volta dalla misurazione del volume ventricolare sinistro in telediastole e in telesistole da una proiezione apicale a quattro camere18-20.
Nella MIS-C la compromissione del circolo vascolare non è dovuta soltanto a una disfunzione miocardica intrinseca da miocardite, ma anche e talvolta soprattutto al rilascio di molecole endogene che mediano una diminuzione della resistenza vascolare periferica con ipovolemia relativa e assoluta, determinando quindi uno shock a genesi per lo più mista10.
Un altro elemento di rilievo meritevole di discussione, in quanto potenzialmente responsabile di una sottostima della gravità del quadro clinico e di ritardo diagnostico nel contesto di una MIS-C, è rappresentato dall’assenza di febbre.
Come già affermato, la presenza di febbre è uno dei criteri diagnostici fondamentali per la diagnosi di MIS-C, e secondo il CDC e secondo l’OMS, con una durata che si attesta mediamente tra uno e sette giorni. Tuttavia, secondo una recente metanalisi di Jiang e coll., che ha analizzato le caratteristiche epidemiologiche, cliniche e gli esiti della MIS-C in una popolazione di 4475 bambini e adolescenti, la febbre è assente mediamente nel 9% dei pazienti con MIS-C, nonostante rappresenti il segno clinico più frequentemente presente in questo disordine10.
Per quanto riguarda il trattamento della MIS-C, questo si fonda sull’utilizzo di immunoglobuline a dosaggio immunomodulante (2 g/kg) e corticosteroidi (da 1-2 mg/kg/die a 10-30 mg/kg/die in base alla gravità clinica, in particolare se vi è necessità di terapia di supporto cardiovascolare), da iniziare quanto prima: questa duplice terapia si è dimostrata indurre un miglioramento della funzionalità del ventricolo sinistro, oltre che favorire la risoluzione del quadro infiammatorio sistemico. L’anakinra ad alte dosi (> 4 mg/kg/die) dovrebbe essere preso in considerazione nelle forme refrattarie a immunoglobuline, o con caratteristiche di sindrome da attivazione macrofagica, o ancora in caso di controindicazioni all'uso a lungo termine di glucocorticoidi.
L'aspirina a basso dosaggio (3-5 mg/kg/die) dovrebbe essere iniziata alla diagnosi di MIS-C e proseguita per almeno 6-8 settimane, fino alla normalizzazione della conta piastrinica e regressione della dilatazione delle arterie coronarie (CAA). I pazienti con FE < 35% o con z-score-CAA ≥ 10 devono effettuare una terapia anticoagulante con enoxaparina per almeno 2 settimane; il proseguimento dell’iter antitrombotico andrà valutato in base alla progressione della clinica21-23.
In ragione del continuum patogenetico che esiste tra MIS-C e sindrome di Kawasaki, sembra corretto l’utilizzo di schemi terapeutici comuni per quanto concerne il quadro sintomatico. Al momento non esistono studi clinici specifiche valutino il trattamento dello shock in pazienti affetti dalle suddette sindromi; pertanto, in tale contesto le linee guida della American Heart Association consigliano l’applicazione dei bundle utilizzati per lo shock settico pediatrico24.
Il primo passo della rianimazione in caso di shock distributivo consiste nella fluidoterapia con soluzione cristalloide isotonica (ad esempio con Ringer lattato o soluzione salina 0,9%); tuttavia, nel caso di uno shock misto bisogna considerare rischi e benefici dovuti all’entità della disfunzione cardiaca. Per ridurre la probabilità di esacerbare un’insufficienza cardiaca, la rianimazione volemica dovrebbe essere effettuata con una quantità inferiore di fluidi e per un periodo di tempo più lungo: sono indicati infatti boli di 10 ml/kg di cristalloidi isotonici da eseguire in 20-30 minuti, seguiti da ulteriori boli di 10 ml/kg da effettuare in 20-30 minuti come da raccomandazioni dell’OMS per il trattamento delle emergenze pediatriche25-27.
Gli indicatori di efficacia terapeutica da monitorare nello stato di shock sono la pressione arteriosa, le caratteristiche dei polsi centrali e periferici, il tempo di refill capillare, lo stato di coscienza e la produzione di urina. Nel caso sia necessario proseguire la correzione volemica, bisogna fare particolare attenzione ai segni di sovraccarico del circolo sistemico e polmonare, tra cui rantoli, peggioramento del distress respiratorio, ritmo di galoppo, epatomegalia, cardiomegalia o edema polmonare alla radiografia del torace28.
La MIS-C refrattaria all'espansione volemica trae beneficio dall’utilizzo di farmaci inotropi; in particolare, in presenza di disfunzione del ventricolo sinistro, alcuni studi consigliano l’uso dell'epinefrina con l’eventuale aggiunta di vasopressina e milrinone25.
Tuttavia, non ci sono prove sufficienti per raccomandare uno specifico inotropo o vasopressore per migliorare la mortalità nello shock distributivo pediatrico, pertanto la scelta del farmaco andrebbe adattata al caso clinico specifico e alla confidenza dell’équipe medica nell’utilizzarlo26,27.
La gestione dello shock segue una flow-chart con interventi consequenziali che dovrebbero portare a completare le prime fasi della rianimazione nell’arco di sessanta minuti; tuttavia, come dimostrato da uno studio svolto in un Pronto Soccorso Pediatrico di terzo livello, solo poco meno del 40% delle casistiche di shock vengono gestite rispettando in maniera stringente le indicazioni del Pediatric Advanced Life Support (PALS)28.
Lo studio di Paul e coll. ha evidenziato che nella realtà ospedaliera esistono numerose variabili che posso influire sul corretto processo terapeutico, in particolare è possibile distinguere 4 macrocategorie di problemi: condizioni dell’ambiente lavorativo, difficoltà relative alla pratica clinica, disponibilità di accedere all’equipaggiamento e condizioni relative al personale sanitario (Figura 1)29.
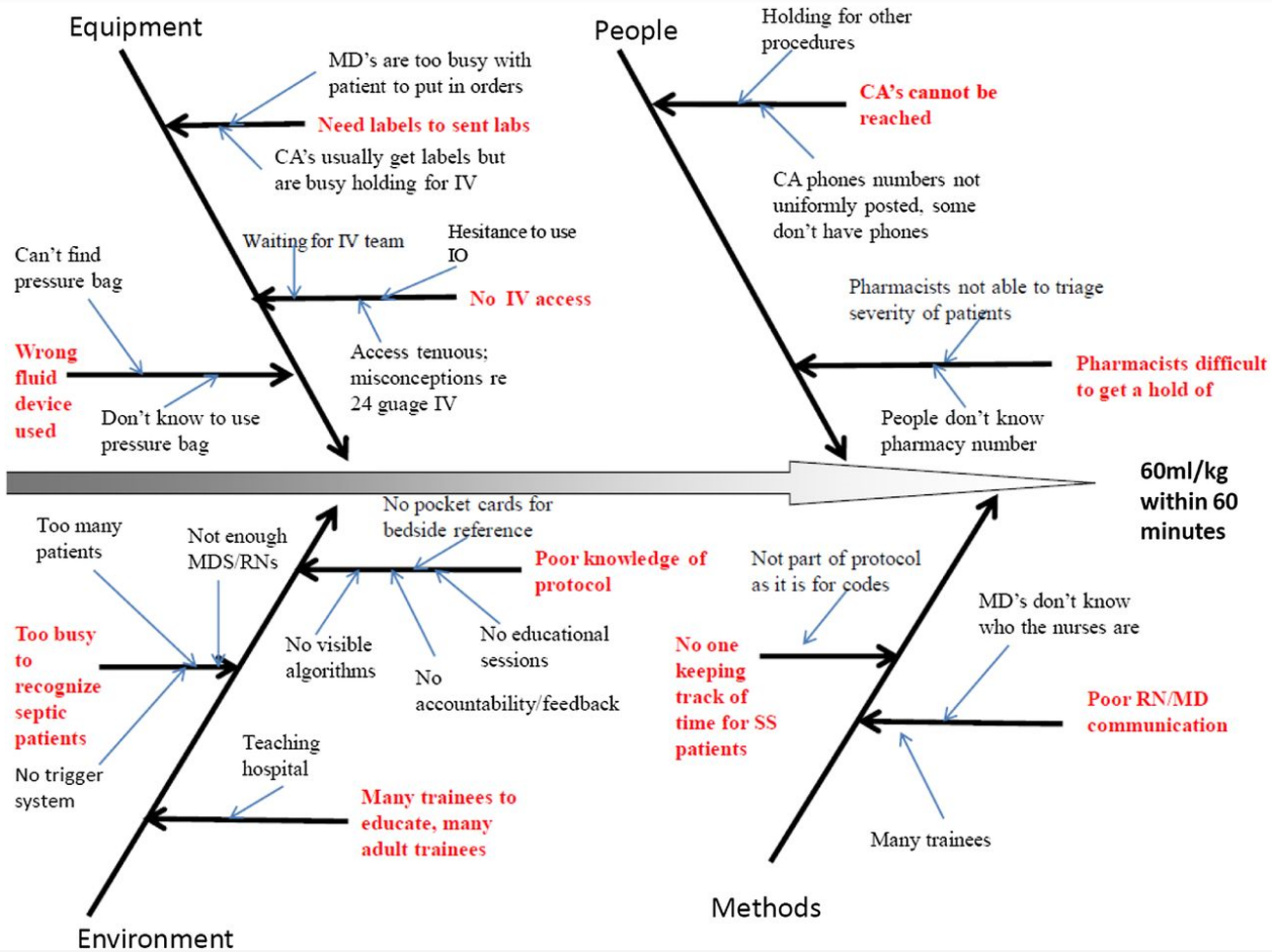
Nel suddetto studio è stato dimostrato che sono potenzialmente applicabili numerosi possibili interventi atti a migliorare la performance ospedaliera, tra cui:
- promuovere un aggiornamento cadenzato della formazione del personale;
- strutturare algoritmi PALS (iter operativi, definizioni e dosaggio dei farmaci) semplificati e adattati alla realtà locale, distribuiti poi sottoforma di schede tascabili agli operatori e affissi in maniera evidente in tutti gli ambienti di lavoro;
- utilizzare uno shock clock, ossia un cronometro al letto dei pazienti con sospetto di shock in osservazione, in modo che lo staff sia più consapevole della finestra temporale di intervento efficace29.
Conclusioni
Il caso clinico presentato, esemplificativo delle difficoltà di gestione che si possono incontrare nella gestione di un paziente critico con sospetta MIS-C, mira a offrire spunti di riflessione che possano promuovere un miglioramento nello svolgimento dell’iter diagnostico-terapeutico in un setting emergenziale.
Da un punto di vista diagnostico, è importante ricordare l’esistenza di casi di MIS-C in apiressia, per cui bisogna porre attenzione a non ritardare queste diagnosi di MIS-C “fredde”, che possono anche avere esiti infausti data la tempo-dipendenza dell'efficacia del trattamento.
La pandemia da SARS-CoV-2 ha favorito la conoscenza di forme infiammatorie multisistemiche con coinvolgimento miocardico a potenziale rapida evoluzione sfavorevole, diagnosticabile precocemente attraverso i parametri cardiocircolatori forniti dalla POCUS; da un punto di vista terapeutico questo strumento di indagine si è dimostrato efficace nel migliorare l’applicazione dei protocolli di urgenza-emergenza PALS nei pazienti critici.
Le suddette considerazioni avvalorano l’emergente necessità della disponibilità e capacità di utilizzo di questa metodica diagnostica nel contesto di un Pronto Soccorso Pediatrico; questa competenza, acquisibile e mantenibile soltanto attraverso una costante partecipazione a corsi di formazione specialistica, dovrebbe rappresentare un requisito cardine di ogni Pediatra di Urgenza.
Bibliografia
- Chang D, Chang X, He Y, Tan KJK. The determinants of COVID-19 morbidity and mortality across countries. Sci Rep 2022;12(1):5888. doi: 10.1038/s41598-022-09783-9.
- Clarke KEN, Jones JM, Deng Y, et al. Seroprevalence of infection-induced SARS-CoV-2 antibodies - United States, September 2021-February 2022. MMWR Morb Mortal Wkly Rep 2022;71(17):606-8. doi: 10.15585/mmwr.mm7117e3.
- Irfan O, Muttalib F, Tang K, Jiang L, Lassi ZS, Bhutta Z. Clinical characteristics, treatment and outcomes of paediatric COVID-19: a systematic review and meta-analysis. Arch Dis Child 2021;106(5):440-8. doi: 10.1136/archdischild-2020-321385.
- Dionne A, Son MBF, Randolph AG. An update on multisystem inflammatory syndrome in children related to SARS-CoV-2. Pediatr Infect Dis J 2022;41(1):e6-e9. doi: 10.1097/INF.0000000000003393.
- Levy N, Koppel JH, Kaplan O, et al. Severity and incidence of multisystem inflammatory syndrome in children during 3 SARS-CoV-2 pandemic waves in Israel. JAMA 2022;327(24):2452-4. doi: 10.1001/jama.2022.8025.
- Payne AB, Gilani Z, Godfred-Cato S, et al. Incidence of multisystem inflammatory syndrome in children among US persons infected with SARS-CoV-2. JAMA Netw Open 2021;4(6):e2116420. doi: 10.1001/jamanetworkopen.2021.16420.
- Jiang L, Tang K, Levin M, et al. Covid-19 and multisystem inflammatory syndrome in children and adolescents. Lancet Infect Dis 2020;20(11):e276-88. doi: 10.1016/S1473-3099(20)30651-4.
- Riphagen S, Gomez X, Gonzalez-Martinez C, Wilkinson N, Theocharis P. Hyperinflammatory shock in children during Covid-19 pandemic. Lancet Lond Engl 2020;395(10237):1607-8. doi: 10.1016/S0140-6736(20)31094-1.
- Verdoni L, Mazza A, Gervasoni A, et al. An outbreak of severe Kawasaki-like disease at the Italian epicentre of the SARS-CoV-2 epidemic: an observational cohort study. Lancet Lond Engl 2020;395(10239):1771-8. doi: 10.1016/S0140-6736(20)31103-X.
- Jiang L, Tang K, Irfan O, Li X, Zhang E, Bhutta Z. Epidemiology, clinical features, and outcomes of multisystem inflammatory syndrome in children (MIS-C) and adolescents-a live systematic review and meta-analysis. Curr Pediatr Rep 2022;10(2):19-30. doi: 10.1007/s40124-022-00264-1.
- Centers for Disease Control and Prevention. Multisystem Inflammatory Syndrome (MIS). Published February 11, 2020.
- World Health Organization. Multisystem inflammatory syndrome in children and adolescents temporally related to Covid-19. 15th May 2020.
- Cattalini M, Della Paolera S, Zunica F, et al.; Rheumatology Study Group of the Italian Pediatric Society. Defining Kawasaki disease and pediatric inflammatory multisystem syndrome-temporally associated to SARS-CoV-2 infection during SARS-CoV-2 epidemic in Italy: results from a national, multicenter survey. Pediatr Rheumatol Online J 2021;19(1):29. doi: 10.1186/s12969-021-00511-7.
- Pringle K, Shah SP, Umulisa I, et al. Comparing the accuracy of the three popular clinical dehydration scales in children with diarrhea. Int J Emerg Med 2011;4(1):58. doi: 10.1186/1865-1380-4-58.
- Gorelick MH, Shaw KN, Murphy KO. Validity and reliability of clinical signs in the diagnosis of dehydration in children. Pediatrics 1997;99(5):E6. doi: 10.1542/peds.99.5.e6.
- Su E, Dalesio N, Pustavoitau A. Point-of-care ultrasound in pediatric Anesthesiology and critical care Medicine. Can J Anesth Can Anesth 2018;65(4):485-98. doi: 10.1007/s12630-018-1066-6.
- Chen L, Kim Y, Santucci KA. Use of ultrasound measurement of the inferior vena cava diameter as an objective tool in the assessment of children with clinical dehydration. Acad Emerg Med 2007;14(10):841-5. doi: 10.1197/j.aem.2007.06.040.
- Singh Y, Tissot C, Fraga MV, et al. International evidence-based guidelines on Point of Care Ultrasound (POCUS) for critically ill neonates and children issued by the POCUS Working Group of the European Society of Paediatric and Neonatal Intensive Care (ESPNIC). Crit Care 2020;24(1):65. doi: 10.1186/s13054-020-2787-9.
- Tissot C, Muehlethaler V, Sekarski N. Basics of functional echocardiography in children and neonates. Front Pediatr 2017;5:235. doi: 10.3389/fped.2017.00235.
- Singh Y. Echocardiographic evaluation of hemodynamics in neonates and children. Front Pediatr 2017;5:201. doi: 10.3389/fped.2017.00201.
- Belhadjer Z, Méot M, Bajolle F, et al. Acute heart failure in multisystem inflammatory syndrome in children in the context of global SARS-CoV-2 pandemic. Circulation 2020;142(5):429-36. doi: 10.1161/CIRCULATIONAHA.120.048360.
- Cattalini M, Taddio A, Bracaglia C, et al.; Rheumatology Study Group of the Italian Society of Pediatrics. Childhood multisystem inflammatory syndrome associated with Covid-19 (MIS-C): a diagnostic and treatment guidance from the Rheumatology Study Group of the Italian Society of Pediatrics. Ital J Pediatr 2021;47(1):24. doi: 10.1186/s13052-021-00980-2.
- Henderson LA, Canna SW, Friedman KG, et al. American College of Rheumatology Clinical Guidance for multisystem inflammatory syndrome in children associated with SARS-CoV-2 and hyperinflammation in pediatric Covid-19: version 2. Arthritis Rheumatol Hoboken NJ 2021;73(4):e13-e29. doi: 10.1002/art.41616.
- McCrindle BW, Rowley AH, Newburger JW, et al.; American Heart Association Rheumatic Fever, Endocarditis, and Kawasaki Disease Committee of the Council on Cardiovascular Disease in the Young; Council on Cardiovascular and Stroke Nursing; Council on Cardiovascular Surgery and Anesthesia; and Council on Epidemiology and Prevention. Diagnosis, treatment, and long-term management of Kawasaki disease: a scientific statement for health professionals from the American Heart Association. Circulation 2017;135(17):e927-e999. doi: 10.1161/CIR.0000000000000484.
- Weiss SL, Peters MJ, Alhazzani W, et al. Surviving sepsis campaign international guidelines for the management of septic shock and sepsis-associated organ dysfunction in children. Pediatr Crit Care Med 2020;21(2):e52-e106. doi: 10.1097/PCC.0000000000002198.
- World Health Organization. Guideline: updates on paediatric emergency triage, assessment and treatment: care of critically-ill children. World Health Organization, 2016.
- Kleinman ME, Chameides L, Schexnayder SM, et al. Part 14: Pediatric Advanced Life Support. Circulation 2010;122(18_suppl_3):S876-S908. doi: 10.1161/CIRCULATIONAHA.110.971101.
- Paul R, Neuman MI, Monuteaux MC, Melendez E. Adherence to PALS Sepsis Guidelines and hospital length of stay. Pediatrics 2012;130(2):e273-80. doi: 10.1542/peds.2012-0094.
- Paul R, Melendez E, Stack A, Capraro A, Monuteaux M, Neuman MI. Improving adherence to PALS septic shock guidelines. Pediatrics 2014;133(5):e1358-66. doi: 10.1542/peds.2013-3871.
Vuoi citare questo contributo?
