Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Giugno 2010 - Volume XIII - numero 6
M&B Pagine Elettroniche
Il punto su
Staphylococcus
aureus meticillino-resistente comunitario e nosocomiale in
fibrosi cistica: uno studio di epidemiologia molecolare
per
il Gruppo di Studio su MRSA in fibrosi cistica (vedi elenco
completo in calce all’articolo)
Centro
Fibrosi Cistica, Azienda Ospedaliero-Universitaria Meyer, Firenze
1Dipartimento
di Pediatria, Università di Firenze
Indirizzo
per corrispondenza: g.taccetti@meyer.it
Community-acquired
and Nosocomial Methicillin-resistant Staphylococcus
aureus in Cystic Fibrosis
Key
words
Methicillin-resistant Staphylococcus
aureus, MRSA, hospital-acquired MRSA, community-acquired
MRSA, Cystic fibrosis
Summary
If
a hospitalized patient acquires a
methicillin-resistant Staphylococcus aureus (MRSA)
infection within 48 h of being hospitalized, it is considered a
community-acquired infection. If the patient has had
frequent or recent contact with a hospital or clinic, or has
undergone recent invasive medical procedures, a MRSA infection is
considered nosocomial.
The
MRSA strains responsible for hospital-acquired (HA-MRSA) or
community-acquired (CA-MRSA) infections are genetically
different.
Although
patients who are frequently hospitalized such as those with
cystic fibrosis (CF) are considered to be at greatest risk of
contracting HA-MRSA strains, CA-MRSA infections have increased,
leading us to believe that the epidemiology of MRSA infection is
changing.
We
have performed molecular typing of MRSA strains from 178 CF
patients from 9 specialized Italian CF centres. Even though
these patients were at risk of acquiring HA-MRSA infections, our
molecular study found they had a high incidence of CA-MRSA
(31.4%).
The
role of MRSA infection in the evolution of CF patients’
lung damage has to be clarified since published results are
contrasting. There is not yet any agreement on treatment
modalities for CF patients suffering from their first MRSA
infection or when this bacterium persists in their respiratory
tract. Frequent hand-washings with soap or alcohol
gel are important prevention measures. |
|
Riassunto
Dal punto
di vista clinico un’infezione da Staphylococcus aureus
meticillino-resistente (MRSA) viene ritenuta acquisita in comunità
quando è diagnosticata in pazienti non ricoverati o quando si
manifesta entro 48 ore dall’ospedalizzazione. Se invece si
verifica in pazienti che hanno avuto frequenti o recenti contatti con
strutture ospedaliere (o di assistenza sanitaria) o in soggetti
recentemente sottoposti a procedure mediche invasive l’infezione
è ritenuta acquisita in ospedale. A livello molecolare i ceppi
di MRSA possono essere distinti in hospital-acquired (HA-MRSA)
o community-acquired (CA-MRSA). I pazienti con frequenti
ospedalizzazioni come i fibrocistici sono ritenuti a maggior rischio
di contrarre un’infezione da ceppi di HA-MRSA. Recentemente
tuttavia è stato osservato un incremento del numero di
infezioni da MRSA anche in pazienti mai ospedalizzati. Tutto ciò
ha fatto ipotizzare un cambiamento nell’epidemiologia
dell’infezione da MRSA. È stata valutata dal punto di
vista molecolare la tipologia di ceppi di MRSA presenti in 178
pazienti con fibrosi cistica afferenti a 9 centri specialistici
italiani. Nonostante i pazienti fossero a rischio di acquisire ceppi
ospedalieri di MRSA, lo studio molecolare ha riscontrato un’alta
prevalenza di ceppi CA-MRSA (31,4%). Il ruolo dell’infezione da
MRSA nell’evoluzione del danno polmonare in pazienti affetti da
FC deve ancora essere ancora chiarito e gli studi finora condotti
hanno evidenziato risultati apparentemente discordanti. In caso di
prima infezione da MRSA o in caso di persistenza del germe a livello
delle vie aeree non esiste ancora un accordo univoco sulla necessità
e sulle eventuali modalità di trattamento dei soggetti
infettati. Il lavaggio frequente delle mani con sapone o gel alcolico
rimane una misura importante di prevenzione.
Introduzione
La
fibrosi cistica (FC) è la più comune malattia
ereditaria letale nella popolazione caucasica, con un’incidenza
di 1:3500-4000 nuovi nati1. La malattia, a trasmissione
autosomica recessiva, dipende sostanzialmente da un difetto a livello
del canale transmembrana del cloro, denominato Cystic Fibrosis
Transmembrane Regulator (CFTR), che porta alla formazione di
secrezioni disidratate, dense e viscose da parte di tutte le
ghiandole a secrezione esocrina2. Tale alterazione delle
caratteristiche delle secrezioni bronchiali finisce per costituire un
habitat ideale per le varie specie batteriche, responsabili dei
quadri di infezione polmonare di cui i pazienti soffrono (Figura 1) e
che condizionano la prognosi3.
Staphylococcus
aureus solitamente è il primo patogeno a colonizzare le
vie aeree dei pazienti affetti da FC. In era pre-antibiotica, questo
patogeno era la principale causa di morbilità e mortalità3-5.
Recentemente si è andata affermando l’importanza dei
germi gram negativi non-fermentanti come principali responsabili di
infezione polmonare. P. aeruginosa è il germe isolato
con maggior frequenza dalle vie aeree dei pazienti5. Recentemente
tuttavia, anche in FC, un argomento di preoccupazione è
rappresentato dall’emergenza di ceppi di Staphylococcus
aureus meticillino-resistente (MRSA), la cui prevalenza in alcune
casistiche ha raggiunto il 20%5-12.
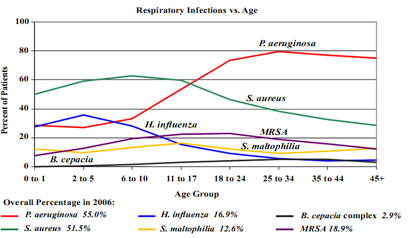
Figura
1. Germi colonizzanti le vie aeree dei pazienti con fibrosi
cistica in relazione all’età (Cystic Fibrosis
Foundation, Patient Registry 2006 Annual Report5).
Dal suo
primo isolamento negli anni ’60, questo patogeno è
diventato un’importante causa di infezioni e una delle
principali cause di infezioni nosocomiali7-10,13,14.
Come per
altre specie di S. aureus, il normale habitat dei ceppi di
MRSA è rappresentato dalla cute e dalle narici.
La
meticillino-resistenza è dovuta alla presenza di un elemento
genetico mobile chiamato “Staphylococcal
Cassette Chromosome mec” (SCCmec)
integrato nel cromosoma di MRSA. Tale elemento genetico porta il gene
mecA, che codifica per una proteina legante la meticillina (PBP-2)
responsabile della ridotta affinità di legame per gli
antibiotici beta lattamici10.
Studi sui
fattori di rischio per l’acquisizione di MRSA hanno mostrato
che il rischio di carriage nasale di ceppi di MRSA include
l’ospedalizzazione, la degenza prolungata, i frequenti contatti
con ambienti extra-ospedalieri in cui vengono erogate cure, i
trattamenti antibiotici recenti (entro i 60 giorni precedenti) o i
frequenti contatti con soggetti con uno o più dei fattori di
rischio precedentemente elencati8-15.
In
passato si riteneva che le infezioni causate da questo germe si
verificassero principalmente per contagio nei luoghi di cura.
Recentemente tuttavia è stato segnalato un aumento di epidemie
da MRSA in aree rurali e urbane, senza che i pazienti riferissero
nell’anamnesi ammissione in strutture sanitarie. Queste
osservazioni hanno suggerito un cambiamento nell’epidemiologia
delle infezioni da MRSA12,16-19.
Il ruolo
di MRSA nella FC è attualmente conosciuto in modo incompleto.
I dati riguardo alla sua prevalenza, al pattern di resistenza agli
antibiotici, all’epidemiologia, alla trasmissibilità,
alla virulenza e all’impatto clinico sui pazienti fibrocistici
sono ancora limitati11,20-23. Un miglioramento delle
conoscenze su questo importante patogeno potrebbe essere importante
per l’ottimizzazione della gestione delle infezioni polmonari
in pazienti FC.
Nomenclatura
La
definizione dei Centri per il controllo e la prevenzione delle
malattie (CDC) stabilisce che un’infezione è acquisita
in comunità quando è diagnosticata in pazienti non
ricoverati in ospedale o quando si verifica entro 48 ore
dall’ospedalizzazione8,9. L’infezione da MRSA
non fa eccezione a questa regola. I ceppi di MRSA acquisiti in
comunità sono conosciuti con l’acronimo CA-MRSA
(community-acquired MRSA).
L’infezione
è invece ritenuta acquisita in ospedale quando si verifica in
pazienti che hanno avuto frequenti o recenti contatti con strutture
ospedaliere (o di assistenza sanitaria) o in soggetti che si sono
recentemente sottoposti a procedure mediche invasive24. I
ceppi di MRSA acquisiti in ospedale sono conosciuti con l’acronimo
HA-MRSA (hospital-acquired MRSA). In relazione all’attuale
evoluzione dell’organizzazione delle cure, che vede diminuire
sempre di più il ricorso all’ospedalizzazione classica,
il termine “MRSA acquisito in ambiente di cura’’
sembra oggi preferibile rispetto al termine “acquisito in
ospedale”, poiché è stata documentata la
possibilità di contagio anche in ambito sanitario
extraospedaliero10.
I termini
“associato” o “acquisito” vengono in pratica
usati indifferentemente7,8. Il termine “associato”
è preferibile quando viene fatto riferimento a ceppi, isolati
indifferentemente nella comunità o negli ambienti di cura, in
un contesto in cui non sia stabilito con certezza il nesso causale,
mentre il termine “acquisito” viene preferito quando
viene dimostrata la trasmissione dell’infezione10.
Microbiologia
L’isolamento
e l’identificazione di MRSA si basa su l’uso di terreni e
test specifici12 alla portata di tutti i laboratori di
microbiologia diagnostica. La corretta differenziazione su base
molecolare fra CA-MRSA e HA-MRSA necessita invece di un approccio
genetico molecolare specifico, attuabile esclusivamente in laboratori
specialistici25-27.
I CA-MRSA
possono essere distinti dagli HA-MRSA su base molecolare per la
differenza dell’elemento genetico mobile chiamato
“Staphylococcal cassette chromosome mec”
(SCCmec) che determina la ridotta affinità di legame
per gli antibiotici beta-lattamici.
Sono
stati evidenziati vari tipi di SCCmec, che hanno portato alla
classificazione dei tipi SCCmec I, II, III, IV, V e VI25-32. I
ceppi HA-MRSA appartengono a SCCmec tipo I, II, III mentre SCCmec
tipo IV e V appartengono a CA-MRSA.
È
stato dimostrato che la definizione di CA-MRSA e HA-MRSA basata sui
soli criteri clinici, senza caratterizzazione molecolare di SCCmec,
sottostima di circa un terzo la prevalenza dei CA-MRSA33.
I ceppi
di CA-MRSA possono avere un diverso background genetico in diverse
aree geografiche34 e ceppi diversi di CA-MRSA possono
essere riscontrati in vari Paesi35-37, riflettendo la loro
diversa capacità a causare infezioni, a persistere e a
diffondersi. La maggior parte dei CA-MRSA studiati fino a ora
appartengono a SCCmec type IV, suggerendo che questo sia il
tipo più adattabile all’ospite e all’ambiente e il
più facilmente trasmissibile.
La
maggior parte dei ceppi HA-MRSA sono di solito resistenti a varie
classi di antibiotici mentre la maggior parte dei ceppi CA-MRSA sono
suscettibili al trimetoprim-sulfametossazolo, alla gentamicina, e
alle tetracicline8,10. La sensibilità alla
clindamicina può essere variabile.
I ceppi
che appartengono a CA-MRSA sono in genere caratterizzati anche dalla
produzione della leucocidina di Panton-Valentine (PVL), da
considerare un fattore di virulenza38. Il gene PVL è
situato nel genoma batterico in sede diversa rispetto a SCCmec.
In ambito extra-FC, ceppi di CA-MRSA sintetizzanti la PVL (PVL+),
sono stati epidemiologicamente correlati con infezioni cutanee39 e
polmonari a decorso severo40-47.
Epidemiologia
MRSA è
attualmente riconosciuto come un problema di salute pubblica
mondiale, per l’incremento della prevalenza di infezioni
sostenute da questo patogeno7,8,48. In ambito non FC le
infezioni causate da questo germe si verificavano principalmente per
contagio nei luoghi di cura. Recentemente tuttavia è stato
osservato un aumento di epidemie da MRSA in aree rurali e urbane,
senza che i pazienti avessero in alcun modo nell’anamnesi
ammissione in strutture sanitarie. Queste osservazioni hanno
suggerito un cambiamento nell’epidemiologia delle infezioni da
MRSA12,16-19, 49.
Studi
recenti, utilizzando sofisticate tecniche molecolari, hanno
dimostrato che la definizione clinica relativa alla distinzione fra
ceppi HA-MRSA e CA-MRSA non correla con i dati molecolari.
In
particolar modo la definizione clinica del CDC sottostima la
prevalenza di CA-MRSA perché molti pazienti, pur frequentando
ambienti ospedalieri, albergano ceppi che hanno caratteristiche
genetiche e pattern di sensibilità antibiotica tipiche dei
CA-MRSA. Recenti osservazioni, basate su studi molecolari,
suggeriscono che la sola associazione anamnestica con ambienti
ospedalieri abbia un basso valore predittivo per distinguere i
pazienti infettati da CA-MRSA da quelli infettati da HA-MRSA33,50
(Figura 2).
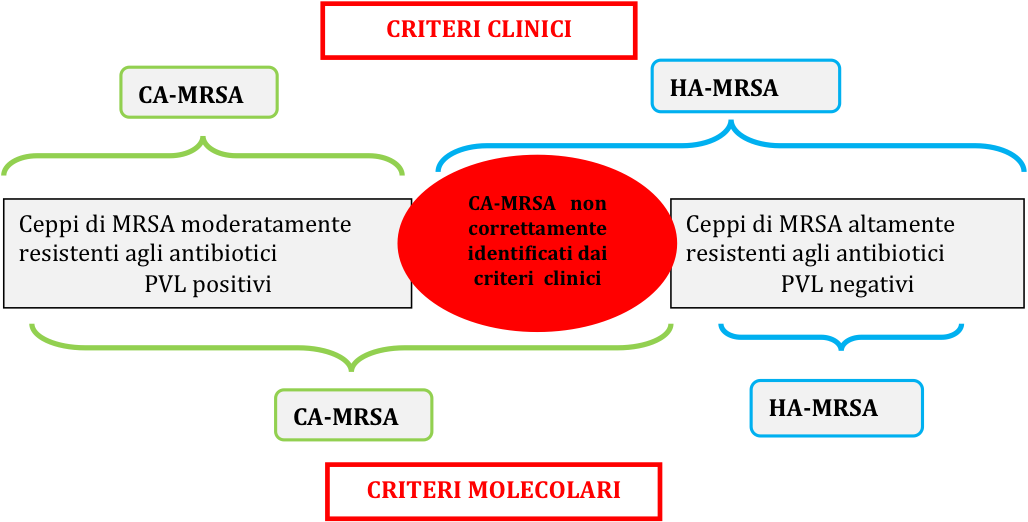
Figura
2. A scopo esemplificativo, in alto viene mostrata la definizione
di MRSA basata su criteri clinici. Per HA-MRSA vengono considerati i
frequenti e recenti contatti con strutture ospedaliere e/o esecuzione
di metodiche diagnostiche/terapeutiche invasive. In basso viene
invece illustrato il risultato dell’identificazione basata su
criteri molecolari. L’utilizzo dei soli criteri clinici porta a
una marcata sottostima dei ceppi comunitari (Da: David MZ, Glikman D,
Crawford SE, et al. J Infect Dis 2008;197:1235-43, modificato).
In USA, e
in misura minore in Europa, ceppi di CA-MRSA sono descritti in
continuo aumento in ambito nosocomiale, con tendenza a rimpiazzare
progressivamente i ceppi di MRSA healthcare-associated
ritenuti responsabili di infezioni ospedaliere51-56.
In
fibrosi cistica i dati disponibili sull’epidemiologia di MRSA
sono ancora da considerare parziali e solo un numero limitato di
studi ha analizzato questa problematica12,21,23,57-61.
Presso il
Laboratorio del Centro Regionale Toscano Fibrosi Cistica dell’Azienda
Ospedaliero-Universitaria Meyer, dove sono presenti le facilities e
le competenze per la caratterizzazione molecolare dei ceppi, è
stato condotto uno studio epidemiologico policentrico biennale su
MRSA valutando il pattern di sensibilità agli antibiotici, la
produzione di PVL, la prevalenza di SCCmec types e
caratterizzando i ceppi con Multi-Locus-Sequence-Typing
(MLST)22. Dati preliminari derivanti da tale studio hanno
evidenziato che 178 (7,5%) dei 2362 pazienti FC di 9 Centri erano
infettati da MRSA. È stata osservata una variabilità
estrema nella prevalenza di MRSA tra i Centri FC57-61.
La
Tabella I illustra la percentuale di sensibilità di 178 isolati
di MRSA da pazienti fibrocistici valutati con il test di diffusione
su disco su agar Mueller-Hinton.
Agenti
antimicrobici |
Sensibili
(%) |
Resistenti
(%) |
Intermedi
(%) |
Tobramicina |
13 |
86 |
1 |
Gentamicina
|
25 |
75 |
- |
Erithromicina
|
2 |
90 |
8 |
Ciprofloxacina
|
22 |
73 |
5 |
25 |
63 |
12 | |
Trimetoprim/sulfametossazolo |
87 |
13 |
- |
Rifampicina
|
72 |
28 |
- |
Vancomicina |
100 |
- |
- |
Teicoplanina
|
100 |
- |
- |
Linezolid
|
100 |
- |
- |
Tabella
I. Attività
degli agenti antimicrobici più comunemente usati nei confronti
di 178 isolati di MRSA.
Non è
stata dimostrata resistenza a vancomicina, teicoplanina, e linezolid.
La sensibilità a trimetoprim-sulfametossazolo e rifampicina è
elevata.
La
Tabella II illustra la distribuzione di SCCmec type in 178 ceppi di
MRSA.
SCCmec
tipo
I n (%)
|
SCCmec
tipo II n (%)
|
SCCmec
tipo III n (%)
|
SCCmec
tipo IV n (%) |
Non
determinato
n
(%) |
Profilo
multiplo
n
(%) |
Totale |
88
(49,4%) |
2
(1,1%) |
7
(3,9%) |
56
(31,4%) |
14
(7,8%) |
11
(6,1%) |
178 |
Può
essere osservata un’alta prevalenza di ceppi CA-MRSA,
apparentemente inusuale in pazienti considerati a rischio di
acquisizione di HA-MRSA22. La maggior parte di HA-MRSA
appartengono a SCCmec type I, invece che al type II, descritto
di solito come il ceppo di HA-MRSA più comunemente isolato. In
base alle nostre osservazioni, anche nel campo di una patologia
caratterizzata da frequenti ospedalizzazioni dei pazienti come la
fibrosi cistica, la sola definizione clinica sottostima la reale
prevalenza dei CA-MRSA, come viene evidenziato dall’uso della
definizione microbiologica basata su criteri molecolari.
Nella
casistica precedentemente illustrata tutti i ceppi di CA-MRSA sono
stati testati per la presenza dei geni PVL, ma nessun ceppo è
risultato positivo.
Poiché
esiste solo un numero limitato di esperienze riguardo a studi di
tipizzazione su isolati di MRSA di pazienti FC, non è
attualmente noto se il complessivo incremento della prevalenza di
MRSA, osservato anche in altre casistiche, sia dovuto a ceppi CA-MRSA
o HA-MRSA. Glikman et al. hanno tuttavia suggerito che CA-MRSA
potrebbe diventare predominante, principalmente tra i pazienti FC con
nuova infezione.
L’analisi
con MLST (Multi-Locus-Sequence-Typing) consente di
caratterizzare univocamente ogni ceppo batterico verificando se esso
appartenga o meno a cloni epidemici noti a livello mondiale. Questa
metodica rappresenta oggi un potente mezzo di analisi epidemiologica
basato sull’analisi dei singoli isolati batterici mediante il
sequenziamento di 7 geni specifici25. In base alla nostra
esperienza gli isolati batterici analizzati con questa tecnica hanno
rivelato che in Italia in pazienti fibrocistici i cloni di HA-MRSA ad
ampia diffusione europea sono scarsamente rappresentati. Il clone più
rappresentativo che raggruppa 22 isolati di 6 centri diversi è
costituito da CA-MRSA con lo stesso background genetico di cloni
epidemici americani, quali USA500/USA300, noti per aver causato gravi
episodi epidemici negli Stati Uniti62.
Il quadro
epidemiologico italiano di MRSA delineato da questo studio dimostra
che i ceppi di CA-MRSA, seguendo una tendenza generale, stanno
diffondendo a livello ospedaliero interessando pazienti soggetti a
frequenti ospedalizzazioni come quelli con fibrosi cistica.
Utilizzando l’esperienza maturata, è attualmente in
corso uno studio prospettico policentrico coordinato dal Centro
Regionale Toscano Fibrosi Cistica dell’Azienda
Ospedaliero-Universitaria Meyer con il coinvolgimento di 13 Centri di
cura a livello nazionale. Tale studio è volto a valutare
longitudinalmente per un periodo di 4 anni il ruolo dell’infezione
persistente da ceppi di CA- o HA-MRSA sulle condizioni cliniche dei
pazienti affetti da FC (variazioni di FEV1 nel tempo, esacerbazioni
respiratorie, uso di antibiotici e stato nutrizionale).
Se è
ben noto il quadro clinico determinato da MRSA in molte malattie
dell’uomo40-47, la storia naturale dell’infezione
da MRSA in FC è invece solo parzialmente conosciuta. Mancano
infatti informazioni esaustive sulla persistenza del germe nelle vie
aeree e sulla sua capacità di causare un aggravamento del
danno polmonare.
Studi
condotti su numeri rilevanti di pazienti hanno evidenziato che il 30%
circa dei pazienti FC vengono colonizzati solamente in modo
transitorio20,58,63.
A
differenza di quanto si verifica in FC per altri patogeni (P.
aeruginosa), al momento attuale non esistono criteri
uniformemente accettati sulla definizione di cronicità di
infezione a livelle delle vie aeree. Recentemente MRSA è stato
definito persistente quando presente in tre o più colture
durante un follow-up di 3-5 anni20.
L’impatto
clinico del germe in pazienti affetti da FC continua a essere
argomento di dibattito. In alcune esperienze la presenza continuativa
di MRSA nelle vie aeree non sembra significativamente associata con
un peggioramento delle condizioni cliniche64, in altri
studi è stata evidenziata invece un’influenza
sull’accrescimento staturo-ponderale e sull’indice di
massa corporea (BMI), un più rapido declino del FEV1 e la
necessità di ricorrere più frequentemente alla terapia
antibiotica e all’ospedalizzazione65-67 (Figura
3). Le difficoltà finora registrate nell’attribuire
un reale ruolo patogeno a MRSA in FC possono dipendere da molteplici
fattori, come ad esempio le infezioni polmonari da flora
polimicrobica, la brevità del periodo di osservazione degli
studi, il limitato numero di soggetti inclusi nelle
casistiche21,23,68,69.
Ulteriori
studi sono necessari per verificare l’eventuale diverso effetto
patogeno di MRSA sul polmone in relazione alle diverse
caratteristiche molecolari dei ceppi di MRSA.
Attualmente
l’infezione o la colonizzazione da MRSA non sono considerate
controindicazioni assolute per il trapianto d’organo70.
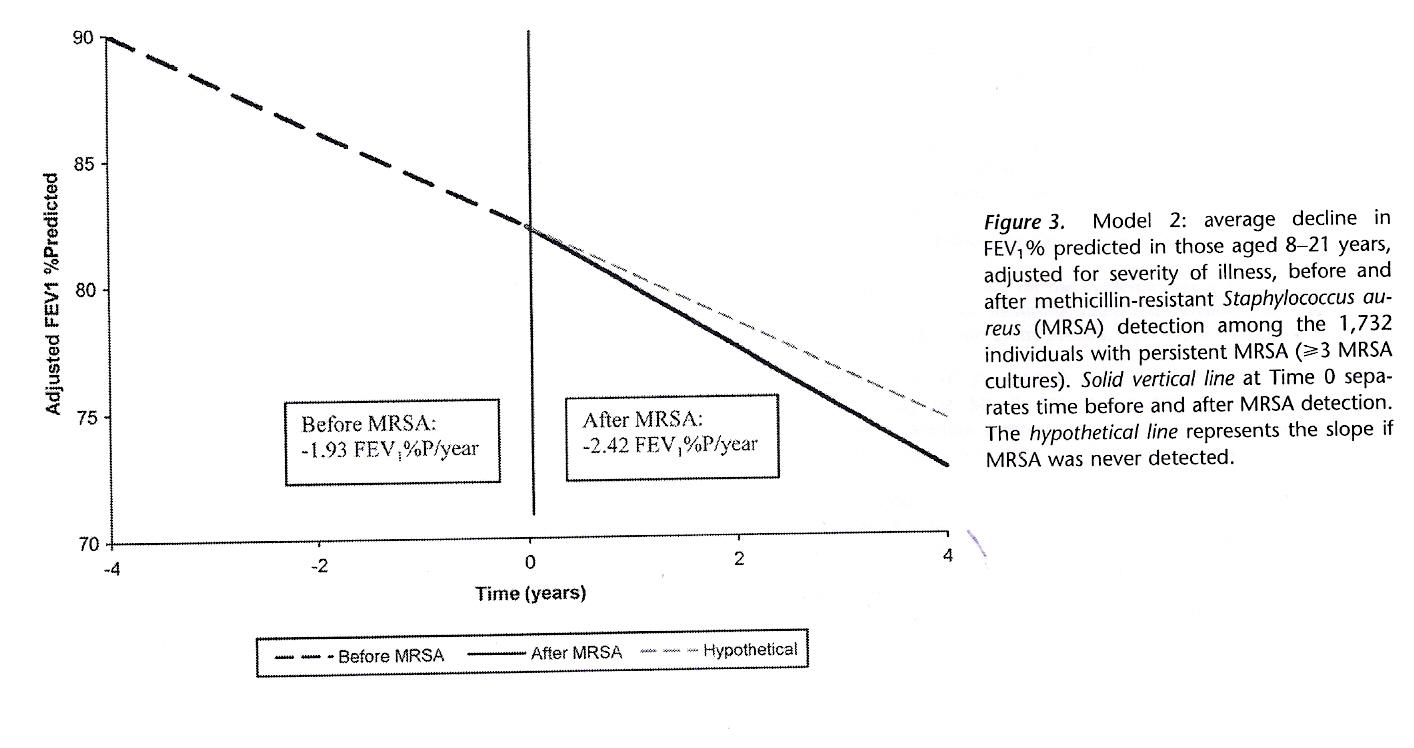
Figura
3. Declino della funzionalità polmonare (espressa come
FEV1%/predetto) nel periodo precedente (a sinistra) e in quello
successivo (a destra) all’acquisizione di MRSA (Dasenbrook EC,
et al. Am J Respir Crit Care Med 2008;178:814-21).
L’opinione
medica corrente è che pazienti FC con infezioni da MRSA
dovrebbero essere segregati tra di loro e da tutti gli altri pazienti
FC8,12,51,57,71,72. La trasmissione di MRSA tra pazienti
FC è stata documentata sia in ambienti ospedalieri sia in
pazienti extraospedalieri. La percentuale di isolati MRSA è
più alta in pazienti FC ospedalizzati rispetto ai
non-ospedalizzati. MRSA, pur essendo abitualmente un ospite delle
fosse nasali dei pazienti, può contaminare le superfici degli
arredi nelle stanze degli ospedali e la diffusione del germe è
stata descritta. Ogni Centro FC dovrebbe avere una politica di
sorveglianza microbiologica che tenga in considerazione il rischio di
infezione crociata da MRSA11.
L’igiene
delle mani (lavaggio o disinfezione con soluzioni alcoliche) è
un componente importante delle Precauzioni Standard e molti studi
hanno dimostrato una relazione temporale tra miglior aderenza alle
raccomandazioni di igiene delle mani e controllo della trasmissione
di organismi multifarmaco-resistenti7,8,12,71,72.
Varie
esperienze suggeriscono che indossare camici e guanti al momento
dell’ingresso nella stanza del paziente e gettarli prima di
uscirne è utile per controllare la diffusione
dell’infezione12,71,72. Tuttavia esistono dati
limitati riguardo l’impatto di precauzioni del contatto in
pazienti FC e l’evidenza dell’efficacia è scarsa.
Uno studio ha mostrato che pazienti per cui sono state adottate
precauzioni da contatto per MRSA hanno espresso molta insoddisfazione
rispetto al loro trattamento, hanno manifestato un maggior numero di
eventi avversi e hanno ricevuto un minor numero di trattamenti
rispetto ai pazienti controllo non sottoposti a isolamento73.
Le
infezioni da MRSA dovrebbero essere evitate per la possibile
riduzione nelle opzioni per il trattamento antibiotico e la
possibilità di deterioramento della funzione polmonare. Come
per altri patogeni, la possibilità di eradicare MRSA dalle vie
aeree in pazienti affetti da fibrosi cistica potrebbe teoricamente
portare un beneficio ai pazienti e ridurre la possibilità di
diffusione del germe4, ma mancano studi clinici al
riguardo.
Un’associazione
di acido fusidico e rifampicina per 6 mesi ha consentito di eradicare
dalle vie aeree il germe in 5 su 7 adulti fibrocistici68.
Schemi di trattamento con gli stessi farmaci, in associazione con
mupirocina al 2% applicata localmente nelle narici per 5 giorni, con
eventuale ripetizione del trattamento, hanno portato a analoghi
risultati74,75. La vancomicina nebulizzata, associata a
trattamenti locali, si dimostrata efficace nel determinare la
clearance del germe11. L’uso della
vancomicina per via inalatoria appare tuttavia criticabile per la
possibile emergenza di ceppi resistenti al farmaco76 e
tale via di somministrazione non è inclusa nelle Guidelines
relative all’impiego del farmaco. Recentemente, esperienze
aneddotiche segnalano la possibilità di eradicazione del germe
con trattamento per via orale con linezolid, un agente
batteriostatico della famiglia degli oxazolidinoni11.
Per
quanto invece riguarda il trattamento delle esacerbazioni polmonari
acute in pazienti affetti da FC è necessario il trattamento
per via parenterale e la vancomicina è considerata la molecola
di scelta7,8. In maniera analoga a quanto suggerito per la
terapia di altri tipi di infezione sostenute da MRSA, è
consigliato usare la vancomicina in associazione con altri farmaci,
come gentamicina o la rifampicina7,8,11,77. Altri farmaci
che potrebbero essere usati in alternativa alla vancomicina hanno una
minore attività nei confronti del germe e il loro uso dovrebbe
esser basato sui risultati delle prove di suscettibilità.
L’uso
dei chinolonici, in pazienti non FC, può essere considerato un
fattore di rischio per l’acquisizione di MRSA78. Il
loro uso empirico dovrebbe essere evitato, limitandone l’impiego
ai pazienti in ben definiti protocolli di trattamento di eradicazione
precoce di P. aeruginosa e a pazienti infettati cronicamente
da P. aeruginosa con lievi esacerbazioni respiratorie. La resistenza
ai chinolonici da parte di MRSA sembra svilupparsi con facilità
durante il trattamento. Altri antibiotici attivi nei confronti di
MRSA, come TMP-SMX e minociclina, possono essere usati in caso di
intolleranza o tossicità della vancomicina7 o nel
caso di lievi esacerbazioni. Il linezolid ha una biodisponibilità
paragonabile per via orale o parenterale. In pazienti affetti da FC
l’esperienza è limitata ma la possibilità di
poter utilizzare il farmaco per via orale appare una prospettiva
importante. Recentemente è stata segnalata l’emergenza
di resistenza al linezolid in un bambino trattato a lungo in
precedenza con questo tipo di farmaco12.
Non è
stata finora studiata l’utilità di trattamenti
antibiotici soppressivi cronici nei confronti dei pazienti che
albergano cronicamente MRSA nelle vie aeree in FC (Tabella
III).
Antibiotico |
Via
di somministrazione |
Dose
(mg/kg/die) |
Numero
di somministrazioni |
Acido
Fusidico* |
orale,
ev |
25-50 |
2-3 |
Rifampicina |
orale,
ev |
15 |
2 |
Vancomicina |
ev |
40 |
2 |
Teicoplanina |
ev |
10 |
1 |
Linezolid |
orale,
ev (< 5 anni) |
10 |
3 |
Linezolid |
orale,
ev (> 5 anni) |
20 |
3 |
Ciprofloxacina |
orale |
20-30 |
2 |
Tobramicina |
ev |
10
|
3** |
Gentamicina |
ev |
9-12 |
3 |
TMP-SMX
|
orale |
trimethoprim
8-10 |
2 |
TMP-SMX
|
ev |
trimethoprim
10-20 |
4 |
Minociclina |
orale,
ev |
4 |
2 |
Doxiciclina |
orale |
4.4 |
2 |
Clindamicina |
orale
|
3-8 |
3-4 |
Tabella
III. Farmaci e dosi per le terapie anti-MRSA più
frequentemente usate in FC (presupponendo una normale funzione
renale).
*
In Italia non sono presenti in commercio specialità per uso
parenterale o per os a base di questo principio attivo.
**
Per la tobramicina esiste uno studio che suggerisce l’impiego
in monodose in FC (Smyth A, et al. Once versus three-times daily
regimens of tobramycin treatment for pulmonary exacerbations of
cystic fibrosis a randomised controlled trial. Lancet
2005;365:573-8).
Questo
lavoro è stato supportato dalla Fondazione Italiana per la
Ricerca sulla Fibrosi Cistica (grant#11/2007) con il contributo della
famiglia Riggi.
Gruppo
di Studio su MRSA in fibrosi cistica:
Laboratori
Centro
FC, Laboratorio Microbiologia, Fondazione IRCCS, Ospedale Maggiore
Policlinico, Mangiagalli e Regina Elena Milano
Laboratorio
di analisi, Ospedale “Tatarella” Cerignola
Area
Funzionale di Microbiologia, Università “Federico II”
Napoli
Laboratorio
di Microbiologia, Ospedale “Civile Maggiore” Verona
Ospedale
Pediatrico “Bambino Gesù”- Roma
Laboratorio
di Patologia, Ospedale di Soverato
Laboratorio
di Microbiologia, Ospedale “Umberto I”, Ancona
Centri
di cura
Centro
Regionale di Riferimento per la Fibrosi Cistica della Regione
Lombardia, Istituto Clinico di Perfezionamento Divisione Pediatria
dell’Università di Milano
Centro
Regionale di Riferimento per la Fibrosi Cistica della Regione Marche,
Divisione Pediatria Ospedale dei Bambini G. Salesi, Ancona
Unità
Operativa Semplice Fibrosi Cistica, Ospedale Pediatrico Bambino Gesù
di Roma
Servizio
di Supporto per la Fibrosi Cistica, Divisione di Pediatria, Ospedale
di Livorno
Centro
Regionale di Riferimento per la Fibrosi Cistica della Regione
Calabria, Divisione Pediatria, Ospedale di Soverato
Centro
Regionale Pediatrico la Fibrosi Cistica della Regione Campania,
Azienda Universitaria Policlinico “Federico II”, Napoli
Servizio
di Supporto Fibrosi Cistica Ospedale “G.Tatarella”,
Cerignola
1.Casazza
G, Viviani L, Bossi A. The Italian cystic fibrosis registry
epidemiologic changes in 13 years. J Cyst Fibros 2001;1:254.
2.Ratjen
F, Doering G. Cystic fibrosis. Lancet 2003;361:681-9.
3.Rowe
SM, Miller S, Sorscher EJ. Cystic Fibrosis: mechanism of disease. N
Engl J Med 2005;352:1992-2001.
4.Doering
G, Hoiby N. Early intervention and prevention of lung disease in
cystic fibrosis: a European Consensus. J Cyst Fibros 2004;3:67-91.
5.Cystic
Fibrosis Foundation, Patient Registry 2006 Annual Report, Bethesda
Maryland.
6.Boucher
HW, Corey GR, Epidemiology of methicillin-resistant Staphylococcus
aureus. Clin Infect Dis 2008;46:344-349.
7.Lowy
FD. Staphylococcal Infections. In: Fauci AS, Braunwald E, Kasper DL,
Hauser SL, Longo DL, Jameson JL, Loscalzo J, eds Harrison’s
Principles of internal Medicine 17 th ed. New York: McGraw Hill
2008:872-881.
8.American
Academy of Pediatrics. Staphylococcal Infections. In Pickering LK,
Baker CJ, Kimberlin DW, Long SS, eds. Red Book 2009 Report of the
Committee on Infectious Disease. 28th ed. Elk Grove Village, IL:
American Academy of Pediatrics 2009:601-615.
9.David
MZ, Glikman D, Crawford SE, et al. What is community-associated
methicillin-resistant Staphylococcus aureus? J Infect Dis
2008;197:1235-43.
10.Flynn
N, Cohen SH, The continuing saga of MRSA. J Infect Dis
2008;197:1217-19.
11.Cystic
Fibrosis Trust, Methicillin-resistant Staphylococcus aureus
(MRSA), Report of the UK Cystic Fibrosis Trust Infection Control
Working Group, Cystic Fibrosis Trust. Available at the
http://www.cftrust.org.uk/aboutcf/publications/consensusdoc/Accessed
29 October 2009.
12.Stone
A, Saiman L. Update on the epidemiology and management of
Staphylococcus aureus, including methicillin-resistant
Staphylococcus aureus, in patients with cystic fibrosis. Curr
Opin Pulm Med 2007;13:515-21.
13.Sakoulas
G, Moellering RC, Increasing antibiotic resistance among
methicillin-resistant Staphylococcus aureus strains. Clin
Infect Dis 2008;46:360-67.
14.Diekema
DJ, BootsMiller BJ, Vaughn TE, et al. Antimicrobial resistance trends
and outbreaks frequency in Ubited States hospitals. Clin Infect Dis
2004;38:78-85.
15.Borer
A, Gilad J, Yagupsky P, et al. Community-acquired
methicillin-resistant Staphylococcus aureus in
institutionalized adults with developmental disabilities. Emerg
Infect Dis 2002;8:966-70.
16.Chambers
HF, The changing epidemiology of Staphylococcus aureus. Emerg
Infect Dis 2001;7:178-82.
17.Vandenesch
F, Naimi T, Enright MC, et al. Community-acquired
methicillin-resistant Staphylococcus aureus carrying
Panton-Valentine leukocidin genes: worldwide emergence. J Emerg
Infect Dis 2003;9:978-84.
18.Fritz
SA, Garbutt J, Elward A, Shannon W, Storch GA, Prevalence of and risk
factors for community-acquired methicillin-resistant and
methicillin-sensitive Staphylococcus aureus colonization in
children seen in a practice-based research network. Pediatrics
2008;121:1090-98.
19.Crawford
SE, Boyle-Vavra S, Daum RS. Community-associated methicillin
resistant Staphylococcus aureus. In: Scheld WM, Hooper DC,
Hughes JM, eds. Emerging infections 2007. Washington DC: ASM press;
153-179.
20.Dasenbrook
EC, Merlo CA, Diener-West M, Lechtzin N, Boyle MP. Persistent
Methicillin-resistant Staphylococcus Aureus and Rate of FEV1
Decline in Cystic Fibrosis. Am J Respir Crit Care Med
2008;178:814-21.
21.Miall
LS, McGinley NT, Brownlee KG, Conway SP, Methicillin resistant
Staphylococcus aureus (MRSA) infection in cystic fibrosis.
Arch Dis Child 2001;84:160-162.
22.Campana
S, Cocchi P, Döring G, Taccetti G, Moroney SM. Emergence of an
epidemic clone of community-associated methicillin-resistant
panton-valentine leucocidin-negative Staphylococcus aureus in
cystic fibrosis patient populations. J Clin Microbiol 2007;45:3146.
23.Elizur
A, Orscheln RC, Ferkol TW, et al. Panton-valentine
leucocidin-positive methicillin resistant Staphylococcus aureus
lung infection in patients with cystic fibrosis. Chest
2007;131:1718-25.
24.Community
Associated MRSA information for Clinicians, Infection control topics,
Centers for Disease Control and Prevention, last modified February 3,
2005. Available at the
http://www.cdc.gov/ncdod/dhqp/ar_mrsa_ca_clinicians.html. Accessed 1
November 2008.
25.Enright
MC, Day NP, Davies CE, Peacock J, Spratt G. Multilocus sequence
typing for characterization of methicillin-resistant and
methicillin-susceptible clones of Staphylococcus aureus. J Clin
Microbiol. 2000;38:1008-15.
26.Oliveira
DC, de Lencastre H. Multiplex PCR strategy for rapid identification
of structural types and variants of the mec element in
methicillin-resistant Staphylococcus aureus. Antimicrob Agents
Chemother 2002;46:2155-61.
27.Zhang
K, McClure JA, Elsayed S, Louie T, Conly JM. Novel multiplex PCR
assay for characterization and concomitant subtyping of
staphylococcal cassette chromosome mec types I to V in
methicillin-resistant Staphylococcus aureus. J Clin Microbiol
2005;43:5026-33.
28.Ito
T, Katayama Y, Asada K, et al. Structural comparison of three types
of staphylococcal cassette chromosome mec integrated in the
chromosome in methicillin-resistant Staphylococcus aureus. Antimicrob
Agents Chemother 2001;45:1323-36.
29.Ito
T, Ma XX, Takeuchi F, Okuma K, Yuzawa H, Hiramatsu K. Novel type V
Staphylococcal cassette chromosome mec driven by a
novel cassette chromosome recombinase, ccrC. Antimicrob Agents
Chemother 2004;48:2637-51.
30.Ma
XX, Ito T, Tiensasitorn C, et al K. Novel type of staphylococcal
cassette chromosome mec identified in community-acquired
methicillin-resistant Staphylococcus aureus strains.
Antimicrob Agents Chemother 2002;46:1147-52.
31.Chongtrakool
P, Ito T, Ma XX, Kondo Y, Trakulsomboon S, Tiensasitorn C, Jamklang M
Chavalit T, Song JH, Hiramatsu K. Staphylococcal cassette chromosome
mec (SCCmec) typing of methicillin-resistant Staphylococcus aureus
strains isolated in 11 Asian countries: a proposal for a new
nomenclature for SCCmec elements. Antimicrob Agents Chemother.
2006;50:1001-12.
32.Oliveira
DC, Milheriço C, de Lencastre H. Redefining a structural
variant of Staphylococcal cassette chromosome mec, SCCmec type
VI. Antimicrob Agents Chemother.2006;50:3457-59.
33.David
MZ, Glikman D Crawford SE, et al. What is community-associated
methicillin-resistant Staphylococcus aureus? J Infect Dis
2008;197(9):1235-43.
34.Okuma
K, Iwakawa K, Turnidge JD, et al. Dissemination of new
methicillin-resistant Staphylococcus aureus clones in the
community. J Clin Microbiol 2002;40:4289-94.
35.Berglund
C, Ito T, Ikeda M, Ma XX, Söderquist B, Hiramatsu K. Novel type
of staphylococcal cassette chromosome mec in a
methicillin-resistant Staphylococcus aureus strain isolated in
Sweden. Antimicrob Agents Chemother 2008;52:3512-6.
36.Denis
O, Deplano A, De Beenhouwer H, et al. Polyclonal emergence of
community-associated methicillin-resistant Staphylococccus aureus
strains harbouring Panton-valentine luecocidin genes in Belgium. J
Antimicrob Chemother 2005;56:1103-06.
37.Kilic
A, Li H, Stratton CW, Tang YW. Antimicrobial susceptibility patterns
and staphylococcal cassette chromosome mec types of, as well as
Panton-Valentine leukocidin occurrence among, methicillin-resistant
Staphylococcus aureus isolates from children and adults in
middle Tennessee. J Clin Microbiol 2006;44:4436-40.
38.Baba
T, Takeuchi F, Kuroda M et al. Genome and virulence determinants of
high virulence community-acquired MRSA. Lancet
2002;359:1819-27.
39.King
M, Humphrey B, Wang Y, Kourbatova EV, Ray SM, Blumberg HM. Emergence
of community-associated methicillin-resistant Staphylococccus
aureus USA300 clone as the predominant cause of skin and
soft-tissue infections. Ann Intern Med 2006;114:309-17.
40.Hidron
AI, Low CE, Honig EG, Blumberg HM. 2009. Emergence of
community-acquired meticillin-resistant Staphylococcus aureus
strain USA300 as a cause of necrotising community onset pneumonia.
Lancet Infect Dis 2009;9:384-92.
41.Goodrich
JS, Sutton-Shields Tn, Kerr A, Wedd JP, Miller MB, Gilligan PH.
Prevalence of community-associated methicillin-resistant
Staphylococcus aureus in patients with cystic fibrosis. J Clin
Microbiol. 2009;47:1231-33.
42.Kourbatova
E, Halvosa J, King M, Ray SM, White N, Blumberg HM. Emergence of
community-associated methicillin-resistant Staphylococcus aureus
USA300 clone as a cause of health care-associated infections among
patients with prosthetic joint infections. Am J Infect Control.
2005;33:385-91.
43.Larsen
A, Stegger M, Goering R, et al. Emergence and dissemination of the
methicillin-resistant Staphylococcus aureus USA300 clone in
Denmark. (2000-2005). Euro Surveill 2007;12:22-4.
44.Lina
G, Piemont Y, Godail-Gamot F, Bes M, Marie-Odile P, Gauduchon V,
Vandenesch F, Etienne J. Involvement of Panton-Valentine
leukocidin-producing Staphylococcus aureus in primary skin
infections and pneumonia. Clin Infect Dis 1999;29:1128-32.
45.Wannet
W, Spalburg JB, Heck E, et al. Emergence of virulent
methicillin-resistant Staphylococcus aureus strains carrying
Panton-Valentine leucocidin genes in the Netherlands. J Clin
Microbiol. 2005;43:3341-45.
46.Rubistein
E, Kollef MH, Nathwani D. Pneumonia caused by methicillin-resistant
Staphylococcus aureus. Clin Infect Dis, 2008;46:378-385.
47.Stryjewski
ME, Chambers HF, Skin and soft-tissue infections caused by
community-acquired methicillin-resistant Staphylococcus aureus.
Clin Infect Dis, 2008;46:368-377.
48.Harbarth
S, Francois P, Schrenzel J, et al. Community-associated
methicillin-resistant Staphylococcus aureus, Switzerland.
Emerg Infect Dis, 2005;11:962-5.
49.Gorwitz
RJ, Kruszon-Moran D, McAllister SK, et al. Changes in the prevalence
of nasal colonization with Staphylococcus aureus in the United
States, 2001-2004. J Infect Dis 2008;197:1226-34.
50.Rossney
AS, Shore AC, Morgan PM, Fitzgibbon MM, O’Connell B, Coleman
DC. The emergence and importation of diverse genotypes of
methicillin-resistant Staphylococcus aureus (MRSA) harboring
the Panton-Valentine leukocidin gene (pvl) reveal that pvl is a poor
marker for community-acquired MRSA strains in Ireland. J Clin
Microbiol 2007;45:2554-63.
51.Saiman
L, Siegel J. Infection control recommendations for patients with
cystic fibrosis: microbiology, important pathogens,and infection
control practices to prevent patient-to-patient transmission.Cystic
Fibrosis Foundation. Infect Control Hosp Epidemiol. 2003;24(5 Suppl):
S6-52.
52.Popovich
KJ, Weinstein RA, Hota B. Are community-associated
methicillin-resistant Staphylococcus aureus (MRSA) starins
replacing traditional nosocomial MRSA strains? Clin Infect
Dis.2008;46:787-94.
53.Diekema
DJ, BootsMiller BJ, Vaughn TE, et al. Antimicrobial resistance trends
and outbreaks frequency in Ubited States hospitals. Clin Infect Dis.
2004;38:78-85.
54.Goering
RV, Ribhi MS, Scangarella NE, et al. Molecular epidemiology of
methicillin–resistant and methicillin–susceptible
Staphylococcus aureus isolates from global clinical trials. J
Clin Microbiol 2008;46:2842-47.
55.Seybold
U, Kourbatova EV, Johnson JG, et al. Emergence of
community-associated methicillin-resistant Staphylococcus aureus
USA300 genotype as a major cause of health care-associated blood
stream infections. Clin Infect Dis. 2006;42:647-56.
56.Karchmer
AW, Bayer AS. Methicillin resistant Staphylococcus aureus: an
evolving clinical challenge. Clin Infect Dis 2008;46 (suppl 5).
57.Methicillin-resistant
Staphylococcus aureus (MRSA) infections. Fact sheet for
healthcare providers (update 2/19/08), Health Care Agency Pubblic
Health Services, Epidemiology and Assesment.
58.Taccetti
G, Neri AS, Festini F,Galici V, Cocchi P, Campana S. Methicillin
resistant Staphylococcus aureus in cystic fibrosis. Pediatr
Pulmonol 2008;43:309.
59.Glikman
D, Siegel JD, David MZ, et al. Complex molecular epidemiology of
methicillin resistant Staphylococcus aureus isolates from
children with cystic fibrosis in the era of epidemic
community-associated methicillin resistant S. aureus. Chest
2008;133:1381-87.
60.Vergison
A, Denis O, Deplano A, et al. National survey of molecular
epidemiology of Staphylococcus aureus, colonization in Belgian
cystic fibrosis patients. J Antimicrob Chemother 2007;59:893-899.
61.Campana
S. Project Title: “Community acquired-MRSA and hospital
acquired MRSA in Cystic fibrosis patients: a multicenter study
regarding national and global epidemiology, antibiotic
susceptibility, natural history and clinical relevance”.
Project FFC #11/2007 Available at
http://www.fibrosicisticaricerca.it/ Accessed 20 October 2009.
62.Tenover
FC McDougal LK, Goering RV, et al. Characterization of
community-associated methicillin-resistant Staphylococcus aureus 2006
widely disseminated in the United States. J Clin Microbiol
2006;44:108-18.
63.Taccetti
G, Neri A, Cocchi P et al. Methicillin-resistant S. aureus (MRSA) in
cystic fibrosis patients:prevalence and clinical findings. Pediatr
Pulmonol 2008;S31:343.
64.Sawicki
GS, Rasouliyan L, Pasta DJ, et al. Investigators and Coordinators of
the Epidemiologic Study of Cystic Fibrosis. The impact of incident
methicillin resistant Staphylococcus aureus detection on pulmonary
function in cystic fibrosis. Pediatr Pulmonol 2008;43:1117-23.
65.Boyle
MP, Ross T, Casewell MW et al. Molecular epidemiology of MRSA
infection in cystic fibrosis and its clinical implications. Pediatr
Pulmonol 2005;Suppl 28:288. Abstract 286.
66.Ren
CL, Morgan WJ, Konstan MW, et al. Presence of methicillin-resistant
Staphylococcus aureus in respiratory cultures from cystic fibrosis
patients is associated with lower lung function. Pediatr Pulmonol
2007;42:513-518.
67.Solis
A, Brown D, Hughes J, Van Saene HK, Heaf DP. Methicillin-resistant
Staphylococcus aureus in children with cystic fibrosis: an
eradication protocol. Pediatr Pulmonol 2003;36:189-195.
68.Garske
LA, Kidd TJ, Gan R, et al. Rifampicin and sodium fusidate reduces the
frequency of methicillin-resistant Staphylococcus aureus (MRSA)
isolation in adults with cystic fibrosis and chronic MRSA infection.
J Hosp Infect 2004;56:208-14.
69.Thomas
RS, Gyi HG, Hodson ME, Methicillin-resistant Staphylococcus aureus,
impact at a national cystic fibrosis centre. J Hosp Infect
1998;40:203-209.
70.Orens
JB, Estenne M, Arcasoy S, et al. Pulmonary Scientific Council of the
International Society for Heart and Lung Transplantation.
International guidelines for the selection of lung transplant
candidates: 2006 update- a consensus report from the pulmonary
scientific council of the International Society for Heart and Lung
Transplantation. J Heart Lung Transplant 2006;25:745-55.
71.Siegel
JD, Jackson L, Chiarello M. Management of Multidrug-Resistant
Organisms In Healthcare Settings, 2006 CDC. Available at the
http://www.cdc.gov/ncidod/dhqp/pdf/ar/mdroguideline2006.pdf Accessed
29 October 2009.
72.Festini
F, Buzzetti R, Bassi C, et al. Isolation measures for prevention of
infection with respiratory pathogens in cystic fibrosis: a systematic
review. J Hosp Infect 2006;64:1-6.
73.Pittet
D, Hugonnet S, Harbarth S, et al. Effectiveness of a hospital-wide
programme to improve compliance with hand hygiene. Lancet
2000;356:1307-12.
74.Macfarlane
M, Leavy A, McCaughan J, Fair R, Reid AJM, Successfull decolonization
of methicillin-resistant Staphylococcus aureus in paediatric
patients with cystic fibrosis (CF) using a three-step protocol. J
Hosp Infect 2007;65:231-36.
75.Maiz
L, Cantòn R, Mir N, Baquero F, Escobar H, Aerolized vancomycin
for the treatment of methicillin-resistant Staphylococccus aureus
infection in cystic fibrosis. Pediatric Pulmonology 1998;26:287-89.
76.Recommendations
for preventing the spread of vancomycin resistance. Recommendations
of the Hospital Infection Control Practices Advisory Committee
(HICPAC). MMWR Recomm Rep. 1995 Sep 22;44(RR-12):1-13.
77.Moellering
RC. Current treatment options for community-acquired
methicillin-resistant Staphylococcus aureus infection. Clin
Infect Dis. 2008;46:1032-37.
78.LeBlanc
L, Pépin J, Toulouse K, et al. Fluorochinolones and risk for
methicillin-resistant Staphylococcus aureus, Canada. Emerg
Infect Dis 2006;12:1398-1405.
Vuoi citare questo contributo?
