Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Ottobre 2009 - Volume XII - numero 8
M&B Pagine Elettroniche
Il punto su
Coronary
fistula in paediatric age
Keywords Coronaryfistula,
diagnosis,
symptom, treatment, sport.
Summary
Coronary
fistula is the most common hemodinamically significant coronary
malformation. It is a rare form of heart disease in which a
coronary artery and a cardiac chamber or another vascular
structure communicate.
Clinical
features depend on the amount of coronary steal and the related
patho-physiological involvement: a significant coronary steal may
cause arrhythmias or myocardial dysfunction. No symptoms are
usually associated with most fistulae.
Anatomic
and functional aspects of fistula may change in time; symptoms
may develop and a treatment may be necessary.
No
pharmacological treatment (to reduce coronary steal and symptoms)
is available. When the shunt through the fistula is high, when
symptoms or complications are evident, a surgical or percutaneous
treatment is necessary. |
- ANOMALIE DI ORIGINE E DECORSO
- Tipo “ostio coronarico in sede anomala, ma comunque all’interno della radice aortica”
- Tipo “ostio coronarico posizionato fuori della radice aortica”
- Tronco comune di coronaria sinistra assente
- Coronaria singola
ANOMALIE DELL’ANATOMIA INTRINSECA- Tipo “duplice coronaria”
- Tipo “stenosi – atresia” coronarica
- Tipo “assenza” di una coronaria
- Tipo “ectasie – aneurismi” coronarici
- Da decorso coronarico intra-murale
- Da decorso coronarico sub-endocardico
ANOMALIE DELLO SBOCCO- Fistola coronarica
- Ridotto numero di ramificazioni arteriolo-capillari
COLLATERALI ANOMALI---------------------------------------------------------------------------------------------------------Semplificata da Angelini P. et al. Circulation 2002; 105: 2449-54
- TIPO
- Coronario-camerale
- Artero-venosa
NUMERO- Singola
- Multipla
FORMA- Isolata
- Associata
SIGNIFICATO CLINICO- Asintomatica
- Sintomatica
SIGNIFICATO EMODINAMICO- Nessuno
- Con sequele (aritmiche, meccaniche, etc.)
GENESI- Nota
- Non nota
CORONARIA D’ORIGINE- Sinistra
- Destra
- Entrambe
SEDE DI SBOCCO
- Durante lo sviluppo fetale precoce, il primitivo miocardio è poco compatto ed è nutrito da sinusoidi (protrusioni endoteliali localizzate negli spazi inter-trabecolari) che comunicano con le cavità cardiache. Al 32° giorno di gestazione circa, il miocardio diventa più compatto e i sinusoidi scompaiono lasciando il posto a una ricca rete di arterie epicardiche, che solo successivamente si connettono al tronco arterioso; la mancata regressione dei sinusoidi può essere la causa di fistole “coronario-camerali”, che, in genere, appaiono come multiple micro-fistole. Nel periodo embrionale, le coronarie epicardiche possono avere connessioni con altri vasi mediastinici; la mancata regressione di queste anastomosi può essere la causa delle fistole “artero-venose”. Per spiegare le fistole coronariche “artero-venose” che drenano nel tronco polmonare è stata proposta anche un’altra teoria5: il primitivo tronco arterioso avrebbe, in corrispondenza dei seni, sei bottoni (tre “aortici” e tre “polmonari”), dei quali solo due daranno origine alle due coronarie, mentre gli altri andranno incontro a un’involuzione progressiva. La mancata involuzione dei bottoni “polmonari” potrebbe portare allo sviluppo di vasi che poi si connettono al sistema coronarico come fistole.L’osservazione personale di una fistola coronarica “artero-venosa”, isolata, drenante nel tronco polmonare in due fratelli gemelli dizigoti, suggerisce l’esistenza di fattori ambientali, attivi durante la gravidanza, nel determinismo di questa condizione. Al contrario, la descrizione in gemelli monozigoti di fistole coronariche tipo “coronario-camerali”10, può suggerire che, almeno in queste, un fattore ambientale ancora non definito, agendo su un substrato genetico comune, può determinare lo sviluppo di un’anomalia con caratteri anatomici simili.
- FISIOPATOLOGIATipo di flusso Il flusso che attraversa la fistola coronarica ha caratteri molto differenti da quello che attraversa le coronarie normali. Il flusso coronarico è prevalentemente diastolico, modulato dalla resistenza offerta dalle arteriole e dal circolo capillare10, e dalla contrazione sistolica miocardica. Nella fistola artero-venosa, invece, il flusso è continuo, ma prevalentemente sistolico15-16: sia in sistole che in diastole, la pressione della sede di sbocco è inferiore alla pressione coronarica. La connessione tra le due strutture avviene senza un letto capillare interposto, per cui la resistenza al flusso è scarsa o nulla e la contrazione miocardica non causa limitazione al flusso. Anche il flusso nella fistola coronario-camerale che drena in un atrio è continuo: la pressione intra-atriale è la più bassa del sistema circolatorio e favorisce un ampio drenaggio della fistola sia in sistole che in diastole; inoltre, la contrazione atriale non è tale da ostruire in sistole la sede di sbocco della fistola. Nella fistola coronario-camerale che termina in un ventricolo il flusso è esclusivamente diastolico perché in sistole viene interrotto dalla contrazione miocardica.Effetti emodinamici Dipendono dall’entità del flusso ematico che attraversa la fistola.Sinteticamente si può affermare che il flusso sottratto da una fistola è significativo se:la comunicazione è ampia e lo sbocco non è stenotico;il canale di comunicazione è breve o assente;è molto basso il regime pressorio della sede di sbocco fistolare: lo shunt è maggiore quando lo sbocco è negli atri o nelle vene piuttosto che nel ventricolo sinistro (dove le pressioni sistoliche sono elevate e la contrazione miocardica determina chiusura funzionale, pressocchè completa, dello sbocco fistolare).Nella maggior parte dei pazienti, le comunicazioni fistolari sono piccole e il flusso che le attraversa è privo di significato emodinamico, compatibile con un normale sviluppo miocardico post-natale. Le piccole fistole possono evolvere verso la chiusura spontanea13: in particolare, è possibile la chiusura spontanea della fistola coronario-camerale, specie se acquisita. Meno frequente è la chiusura spontanea della fistola coronarica artero-venosa.In alcuni casi, tuttavia, è possibile osservare un peggioramento emodinamico in quanto il flusso ematico “preferenziale” e ad alta velocità attraverso la fistola (perché senza resistenza), può determinare una progressiva dilatazione del tramite fistoloso con un ulteriore aumento della quota di sangue che l’attraversa. Con il trascorrere degli anni inoltre, l’aumento delle resistenze coronariche contribuisce ulteriormente a questo fenomeno10.Quando il flusso attraverso la fistola è emodinamicamente significativo, ne possono conseguire:dilatazione compensatoria della coronaria che dà origine alla fistola per aumentare la quota di flusso che l’attraversa e la perfusione miocardica.un aumentato ritorno venoso sistemico con secondario aumento della portata cardiaca. Raramente e solo se la sede di drenaggio è una camera sinistra si può arrivare a un’insufficienza cardiaca ad alta portata.un furto di sangue dal circolo coronarico con ischemia nei segmenti miocardici a valle del punto di origine della fistola.progressiva ipertensione polmonare e stasi epatica, quando lo sbocco della fistola è ampio ed è in una camera cardiaca destra.Le conseguenze del furto coronarico sono frequenti perché:le arteriole coronariche si comportano come rami terminali: in realtà, tra le ramificazioni coronariche sono presenti ampie anastomosi, ma i vasi che vi partecipano sono molto esili, per cui, pur se documentate anatomicamente, le anastomosi sono funzionalmente inefficienti1.l’irrorazione miocardica, in particolare del ventricolo sinistro, è pressoché limitata al periodo diastolico in quanto in sistole le arteriole coronariche vengono chiuse dalla contrazione miocardica. Durante l’esercizio fisico con l’aumento della frequenza cardiaca e la riduzione del tempo diastolico, il tempo di irrorazione miocardica si riduce ulteriormente.può realizzarsi una progressiva degenerazione parietale del tramite fistoloso con successive estasia, e/o trombosi;è possibile un restringimento di tipo aterosclerotico della coronaria nativa secondario alla turbolenza di flusso in corrispondenza dell’origine della fistola15.Un furto coronarico significativo, tale cioè da superare la riserva di flusso del vaso stesso e la sua capacità di compenso, determina un’ischemia miocardica non solo durante lo sforzo, ma anche a riposo, con disfunzione ventricolare (inizialmente diastolica e successivamente anche sistolica), ed aritmie.
- Elettrocardiogramma È normale nei pazienti con fistola piccola e isolata. Nei pazienti con fistola di grosso calibro o con fistole multiple o con condizioni ischemizzanti aggiuntive (tipo cardiomiopatia ipertrofica), l’esame può mostrare segni di ischemia miocardica, quali depressione del tratto ST, onde T invertite, ed extrasistoli ventricolari, oppure segni di sovraccarico ventricolare.
- RX torace Nei pazienti con insufficienza cardiaca e cardiomegalia da significativo furto coronarico, si evidenzia una prominenza dell’arco inferiore sinistro del profilo cardiaco (componente ventricolare), un sollevamento della punta del cuore e segni di congestione polmonare. Nelle fistole grandi drenanti in vena cava superiore può essere presente una prominenza dell’arco superiore destro.
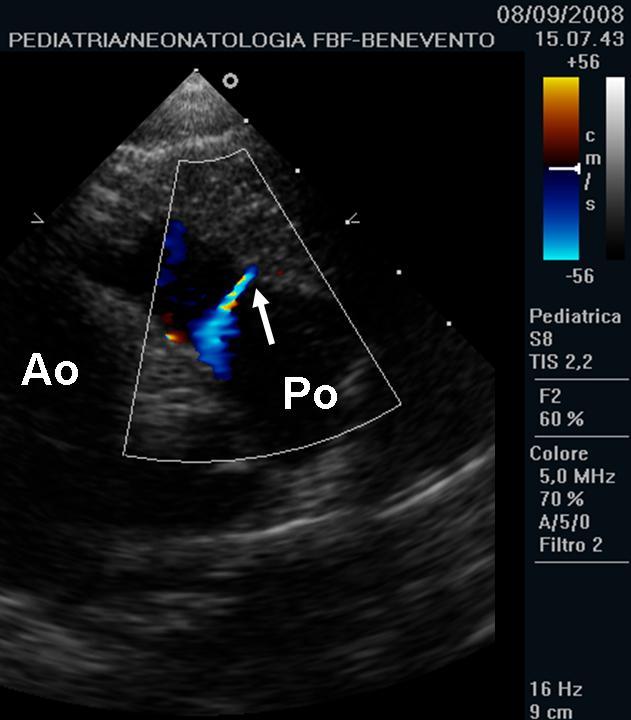
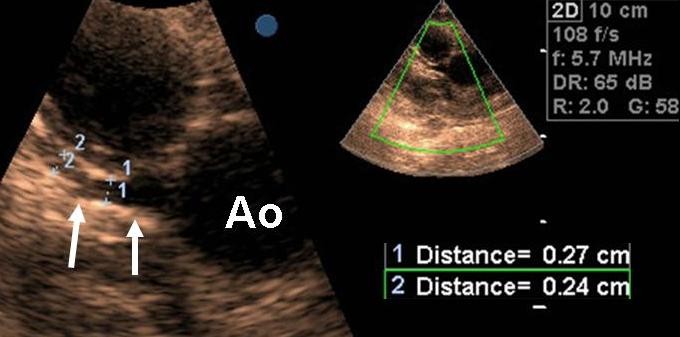
- Ecocardiografiacolor-Doppler È tra le indagini strumentali più importanti. Fondamentale per la diagnosi e la definizione anatomo-funzionale (sede e aspetto dello sbocco del tramite fistoloso, entità di shunt; Figura 2), per la valutazione delle sequele (dimensioni delle camere cardiache, efficacia della funzione di pompa ventricolare, asinergie di contrazione del ventricolo sinistro, disfunzione diastolica, dilatazione coronarica, etc; Figura 3), e la individuazione delle eventuali lesioni cardiache associate (congenite o acquisite). Essa è estremamente utile nel follow-up del paziente asintomatico e per il management terapeutico. Raramente è necessario ricorrere all’esame ecocardiografico trans-esofageo, da alcuni considerato una guida fondamentale per la chiusura percutanea della comunicazione e il follow-up successivo19-20.
- Angio-risonanza magnetica È uno strumento diagnostico alternativo all’esame ecocardiografico. Consente di studiare, in maniera accurata e non invasiva, anatomia e flusso coronarico21. Il limite principale è la definizione del decorso distale delle coronarie, in particolare della discendente posteriore.
- Angio-TAC coronarica La TAC spirale multidetettore è capace di una notevole risoluzione temporale e spaziale e consente una ricostruzione tridimensionale con la visualizzazione non invasiva e di alta qualità di arterie e vene coronariche, del loro decorso, calibro e profilo parietale22.
- Test da sforzo Nelle forme lievi-moderate è un utile completamento diagnostico in quanto fornisce una valutazione funzionale della tolleranza all’esercizio del paziente e consente di escludere l’inducibilità, durante esercizio, di ischemia miocardica e di aritmie. Quando il test è positivo per segni o sintomi di ischemia o aritmie, il paziente deve essere avviato a indagini invasive10. È necessario tener presente che l’esercizio, determinando dilatazione coronarica e aumento del flusso miocardico, potrebbe migliorare il flusso nella coronaria a valle dell’origine della fistola15 con un risultato falsamente negativo in un paziente che invece potrebbe avere dei periodi di ischemia a riposo. Per slatentizzare i segni di ischemia in un paziente con una fistola significativa, che, come già detto, è responsabile di un furto coronarico continuo, sisto-diastolico, è necessario eseguire un test da sforzo prolungato, in maniera da ridurre in maniera critica il tempo di perfusione miocardica (diastolico).
- ECG dinamico secondo Holter Registrando l’attività elettrica cardiaca nelle 24 ore, consente di accertare, nelle attività quotidiane, l’eventuale presenza di ischemia miocardica e di aritmie ventricolari secondarie alla fistola. È un completamento diagnostico fondamentale, da associare all’esame ecocardiografico e al test da sforzo. È particolarmente utile nei primi anni di vita, non potendo, i piccoli pazienti, effettuare un test da sforzo.
- Ecostressfarmacologico Può essere un utile completamento diagnostico nei casi dubbi. Alle informazioni ottenibili con un test da sforzo ben condotto, aggiunge, infatti, la possibilità di valutare la cinesi miocardica regionale quando aumenta il lavoro cardiaco. Nel paziente con fistola coronarica, è preferibile utilizzare la dobutamina che ha effetto inotropo e cronotropo positivo; se il test è condotto con l’adenosina e risulta negativo, potrebbe essere un “falso negativo” perché il farmaco induce dilatazione per lo più coronarica e non fistolare23-24.
- Scintigrafiamiocardica per evidenziare o meno deficit di perfusione a riposo o durante esercizio. È di certo più sensibile del test da sforzo, ma più costosa e utilizza un mezzo radio-isotopico. Potrebbe essere un utile completamento negli adolescenti, in particolare in quelli con evidenza anatomica di fistola di media ampiezza25-27.
- Cateterismocardiaco Si rende necessario nei pazienti con fistola coronarica di grosse dimensioni, in quelli con significativa dilatazione coronarica, in quelli con segni clinici (angina, palpitazioni, dispnea, etc.) o strumentali (aritmie ventricolari complesse, ischemia inducibile) di ridotta perfusione miocardica o di dilatazione – sovraccarico cardiaco da significativo furto coronarico. L’esame consente di definire in maniera accurata l’anatomia coronarica, l’origine, le dimensioni, lo sbocco del tramite fistoloso ed eventuali anomalie coronariche concomitanti. In alcuni laboratori di emodinamica, in corso di cateterismo, è possibile effettuare anche un’analisi quantitativa con tecnica Doppler del furto coronarico17. La decisione interventistica deve essere multi-parametrica e la determinazione della quota di sangue sottratta alla perfusione miocardica è tra i parametri da considerare. L’esame coronarografico è invasivo e prevede l’utilizzo di mezzi di contrasto potenzialmente nefrotossici o allergenici.
- la profilassi dell’endocardite batterica (alcuni consigliano la profilassi per almeno un anno dalla chiusura del tramite fistolare o comunque fino alla normalizzazione del calibro coronarico46);
- la dilatazione coronarica residua: i pazienti trattati quando è già presente una dilatazione coronarica significativa, possono non avere un recupero completo del calibro coronarico, anche se il trattamento chirurgico o percutaneo è stato ottimale, senza shunt residui46. Anche se non sono disponibili informazioni sul rischio trombotico di questi pazienti, potrebbe essere prudente l’utilizzo di antiaggreganti come l’acido acetilsalicilico. Nei pazienti in cui la dilatazione coronarica è marcata dovrebbe essere utilizzata una terapia anticoagulante orale46;
- lo shunt residuo, che deve essere valutato per il suo significato emodinamico. In genere, il paziente operato non ha residui del trattamento della fistola artero-venosa. Nei pazienti trattati per fistola coronario-camerale può residuare un lieve shunt;
- il rischio di emolisi va considerato nei pazienti trattati in maniera percutanea, in particolare, se con impianto di coils e con shunt residuo; è transitorio.
- Ecocardiografia con color-Doppler Consente di definire il risultato del trattamento, di precisarne le eventuali sequele, di seguire la funzione di pompa bi-ventricolare, il calibro coronarico e di diagnosticare una possibile endocardite, rara complicanza di una chiusura percutanea parziale del tramite fistoloso.
- Test da sforzo Consente una valutazione funzionale e della tolleranza allo sforzo dei pazienti operati.
- ECG dinamico secondo Holter Consente di accertare la presenza – persistenza di aritmie ventricolari.
- Cateterismo cardiaco In alcuni casi, soprattutto in quelli in cui persiste la dilatazione coronarica o è evidente uno shunt residuo attraverso la fistola o vi sono segni persistenti di ischemia–sovraccarico ventricolare sinistro, potrebbe essere utile ripetere l’esame coronarografico per valutare direttamente l’efficacia del trattamento44.
- età inferiore ai trenta anni;
- asintomatici;
- con aspetto ecocolorDoppler di shunt fistolare lieve;
- con buona funzione ventricolare, in assenza di aree di asinergia di contrazione;
- senza dilatazione coronarica;
- con normali ECG Holter e test da sforzo massimale.
- asintomatici;
- con un aspetto ecocolorDoppler di shunt fistolare residuo lieve o assente;
- con buona funzione ventricolare, in assenza di aree di asinergia di contrazione;
- senza dilatazione coronarica;
- con normali ECG Holter e test da sforzo massimale.
- Le fistole coronariche sono anomalie rare; è probabile, però, che la reale incidenza della patologia sia sottostimata per il mancato riconoscimento di forme lievi, a decorso asintomatico.
- L’età di diagnosi dipende dalla severità dell’alterazione funzionale determinata; la maggior parte delle fistole è piccola, con conseguenze emodinamiche non significative (compatibili con un normale sviluppo miocardico post-natale), per cui, spesso rappresentano solo un riscontro occasionale. Anche le fistole piccole, però, possono determinare la comparsa di un soffio (in particolare se lo sbocco è stenotico).
- La maggior parte dei pazienti con fistola raggiunge l’età adulta senza aver avuto bisogno di una procedura correttiva.
- Le caratteristiche anatomiche e funzionali delle fistole possono modificarsi nel tempo e questo può comportare una sintomatologia ingravescente e la necessità di un trattamento.
- Le fistole coronariche possono essere motivo di dolore toracico, dispnea, palpitazioni, sincope, aritmie ventricolari, morte improvvisa; il loro riconoscimento, dunque, è fondamentale, in particolare nei giovani atleti.
- La combinazione di più esami diagnostici cardiologici consente di ottenere una definizione anatomica e una stratificazione funzionale adeguate.
- I pazienti non trattati, perché con fistola non emodinamicamente significativa, vanno comunque sottoposti a valutazioni cardiologiche periodiche.
- Lambertini G, Mezzogiorno V. Anatomia dell’uomo. Piccin Nuova Libraria, 1986.
- Angelini P, Velasco JA, Flamm S. Coronary anomalies: incidence, pathophysiology, and clinical relevance. Circulation 2002; 105: 2449-54.
- Anderson RH. Cardiologia pediatrica. Mc Graw Hill, 1990.
- Sherwood MC, Rockenmacher S, Colan SD, Geva T. Prognostic significance of clinically silent coronary artery fistulas. Am J Cardiol 1999; 83:407-11.
- Vaidyanathan KR, Theodore SAC, Sankar MN, Cherian KM. Coronary artery to pulmonary artery fistula with dual origin – embryological, clinical and surgical significance. Eur J Cardiothoracic Surg 2007; 31: 318-19.
Burns KE, Ferguson KA, Spouge A, Brown JE. Massive congenital coronary arteriovenous malformation presenting with exertional dyspnea and desaturation in an adult: a case report and review of the literature. Can J Cardiol 2001;17: 85-89.
- Caputo S, Capozzi C, Santoro G, et al. Multiple right coronary artery fistulae in a patient with diffuse hypertrophic cardiomyopathy: a case report. J Am Soc Echocardiogr 2005; 18: e19-21.
Kardos A, Babai L, Rudas L, Gaal T, Horvath T, Talosi L, Tóth K, Sárváry L, Szász K. Epidemiology of congenital coronary artery anomalies: a coronary arteriography study on a central European population. Catheter Cardiovasc Diagn 1997; 42: 270-75.
- Capozzi G, Caputo S, Pizzuti R, et al. Congenital heart disease in live born children: incidence, distribution and yearly changes in Campania Region. J Cardiovasc Med 2008; 9:368-74.
Haas GE, Parr GV, Trout RG, Hargrove WC III. Traumatic coronary artery fistula. J Trauma 1986; 26: 854-57.
- Hoffman, JI. Congenital anomalies of the coronary vessels and the aortic root. In: Heart disease in infants, children and adolescents, 5th ed, Emmanoulides, GC, Riemenschneider TA, Allen HD, Gutgesell, HP (Eds), Williams and Wilkins, Baltimore 1995. p.780.
- Moss & Adams. Heart disease in infants, children and adolescents. Lippincott, Williams and Wilkins, 2001.
- Schanzenbacher P, Bauersachs J. Acquired right coronary artery fistula draining to the right ventricle: angiographic documentation of first appearance following reperfusion after acute myocardial infarction, with subsequent spontaneous closure. Heart 2003; 89: e22.
- Itoi T, Satou H, Hamaoka K. Coronary flow characteristics of multiple coronary artery-left ventricular microfistulae in young monozygotic twins. Circ J 2007;71:1492–95.
- Angelini P. Coronary-to-pulmonary fistulae. What are they? What are their causes? What are their functional consequences? Tex Heart Inst J 2000; 4:327-29.
- Kochiadakis GE, Vardakis KE, Vardas PE. Coronary-pulmonary artery fistulae: blood flow pattern and effect on myocardial perfusion. Heart 2002; 88: 400.
Kamiya H, Yasyda T, Nagamine H, et al Surgical treatment of congenital coronary artery fistulas: 27 years’ experience and a review of the literature. J Card Surg 2002; 17: 173-177.
Guo H, You B, Lee JD. Dilated cardiomyopathy caused by a coronary – pulmonary fistula treated successfully with coil embolization. Circ J 2006;70:1223-25.
- McElhinney DB, Burch GH, Kung GC, Villegas MD, Silverman NH, Moore P. Echocardiographic guidance for transcatheter coil embolization of congenital coronary arterial fistulas in children. Pediatr Cardiol 2000; 21:253-58.
- Vitarelli A, De Curtis G, Conde Y, Colantonio M, Di Benedetto G, Pecce P, De Nardo L, Squillaci E. Assessment of congenital coronary artery fistulas by transesophageal color Doppler echocardiography. Am J Med 2002; 113: 127-133.
- Parga JR, Ikari NM, Bustamante LNP, Rochitte CE, de Avila LFR, Oliveira SA. MRI evaluation of congenital coronary artery fistulae. Br J Radiol 2004; 77: 508-511.
- Early SA, Meany TB, Fenlon HM, Hurley J. Coronary artery fistula; coronary computed tomography. The diagnostic modality of choice. J Card Surg 2008; 3: 41.
- Angelini P. Questions on coronary fistulae and microfistulae. Tex Heart Inst J 2005; 32: 53-54.
- Elhendy A, Nierop PR, Roelandt JR, Fioretti PM. Myocardial ischemia assessed by dobutamine stress echocardiography in a patient with bicoronary to pulmonary artery fistulas. J Am Soc Ecocardiogr 1997;10:189-91.
Glynn TP, Fleming RG, Haist JL, Hunterman RK. Coronary arteriovenous fistula as a cause for reversible Thallium-201 perfusion defect. J Nucl Med 1994;35:1808-10.
- Heper G, Kose S. Increased myocardial ischemia during nitrate therapy caused by multiple coronary artery–left ventricle fistulae? Tex Heart Inst J 2005;32:50-2
Sunder KRS, Balakrishnan KG, et al. Coronary artery fistula in children and adults: a review of 25 cases with long term observations. Int J Cardiol 1997; 58: 47-53.
- Carrel T, Tkebuchava T, Jenni R, Arbenz U, Turina M. Congenital coronary fistulas in children and adults: diagnosis, surgical technique and results. Cardiology 1996; 87: 325-330.
Meissner A, Lins M, Herrmann G, Simon R. Multiple coronary artery – left ventricular fistulae: haemodynamic quantification by intracoronary Doppler ultrasound. Heart 1997; 78: 91-3.
Mavroudis C, Backer CL, Rocchini AP, Muster AJ, Gevitz M. Coronary artery fistulas in infants and children: a surgical review and discussion of coil embolization. Ann Thorac Surg 1997; 63: 1235-42.
Schumacher G, Roithmaier A, Lorenz HP, et al. Congenital coronary artery fistula in infancy and childhood: diagnostic and therapeutic aspects. Thorac Cardiovasc Surg 1997; 45: 287-94.
Angelini P. Coronary fistulae: which ones deserve treatment and what kind of treatment do they need? Tex Heart Inst J 2007; 34: 202-03.
- Hackett D, Hallidie-Smith KA. Spontaneous closure of coronary artery fistula. Br Heart J 1984; 52: 477-479.
- Griffiths SP, Ellis K, Hordof AJ, Martin E, Levine OR, Gersony WM. Spontaneous complete closure of a congenital coronary artery fistula. J Am Coll Cardiol 1983;2:1169-73.
- Armsby LR, Keane JF, Sherwood MC, Forbess JM, Perry SB, Lock JE. Management of coronary artery fistulae. Patient selection and results of transcatheter closure. J Am Coll Cardiol 2002; 39: 1026-1032.
- Spaedy TJ, Wilensky RL. Coronary artery fistulas: clinical implications. ACC Current Journal Review 1994; 3: 24.
- Reul RM, Cooley DA, Hallman GL, Reul GJ. Surgical treatment of coronary artery anomalies. Report of a 37½-year experience at the Texas Heart Institute.Tex Heart Inst J 2002; 29: 299-07
- Urrutia-S CO, Falaschi G, Ott DA, Cooley DA. Surgical management of 56 patients with congenital coronary artery fistulas. Ann Thorac Surg 1983;35:300-07.
- Cheung DL, Au WK, Cheung HH, Chiu CS, Lee WT. Coronary artery fistulas: long-term results of surgical correction. Ann Thorac Surg 2001; 71: 190-95.
Sun S, Li JY, Hu PY, Wu SJ. Starfish – assisted off-pump obliteration of massive coronary arteriovenous fistulae. Tex Heart Inst J 2005; 32: 595-97.
- Okubo M, Nykanen D, Benson LN. Outcomes of transcatheter embolization in the treatment of coronary artery fistulas. Cathet Cardiovasc Intervent 2001; 52: 510-517.
- Ogoh Y, Akagi T, Abe T, Hashino K, Hayabuchi N, Kato H. Successful embolization of coronary arteriovenous fistula using an interlocking detachable coil. Pediatr Cardiol 1997; 18: 152-155.
- Hakim F, Madani A, Goussous Y, Cao QL, Hijazi ZM. Transcatheter closure of a large coronary arteriovenous fistula using the new Amplatzer duct occluder. Cathet Cardiovasc Diagn 1998; 45: 155-157.
- Kassaian SE, Mahmoodian M, Salarifar M, Alidoosti M, Abbasi SH, Rasekh A. Stent graft exclusion of multiple symptomatic coronary artery fistulae. Tex Heart Inst J 2007; 34: 199-203.
- Alphonso N, Anagnostopoulos PV, Azakie A, Karl TR. Undiagnosed coronary fistula causing low cardiac output syndrome after pediatric heart surgery. Eur J Cardiothoracic Surg 2006; 30: 397-399.
- McMahon CJ, Nihill MR, Kovalchin JP, Mullins CE, Grifka RG. Coronary artery fistula. Management and intermediate outcome after transcatheter coil occlusion. Tex Heart Inst J 2001; 28: 21-25.
- Liberthson RR, Sagar K, Berkoben JP, Weintraub RM, Levine FH. Congenital coronary arteriovenous fistula. Report of 13 patients, review of the literature and delineation of management. Circulation 1979; 59: 849-854.
- Protocolli cardiologici per il giudizio di idoneità allo sport agonistico 2003. Casa Editrice Scientifica Internazionale. Terza Edizione 2003.
Vuoi citare questo contributo?
