Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Gennaio 2008 - Volume XI - numero 1
M&B Pagine Elettroniche
Il punto su
Gli
antiossidanti nello stress ossidativo della talassemia e dell'anemia
falciforme.
A
che punto siamo?
Clinica
Pediatrica, Dipartimento di Medicina Clinica e Sperimentale,
Università degli Studi di Ferrara
Indirizzo
per corrispondenza: bre@unife.it
Summary
Under
normal conditions the organism is equipped with antioxidant systems
capable of neutralizing endogenous free radicals.
When the
production of reactive species exceeds the defense mechanisms, a
condition called oxidative stress occurs.
Thalassemia
and sickle cell disease are two hereditary disorders with high
potential for oxidative damage due to both physiopathological
mechanisms of the diseases and iron overload.
We
described main antioxidant agents used both in healthy individuals
and iron overloaded patients in order to prevent and limit oxidative
damage.
Riassunto
In
condizioni fisiologiche nell'organismo vi è uno stato di
equilibrio tra la produzione endogena di radicali liberi e la
capacità di neutralizzarli da parte dei sistemi antiossidanti.
Quando la
produzione di specie reattive incrementa a tal punto da superare i
meccanismi di difesa endogeni, si instaura una condizione definita
comunemente “stress ossidativo”.
Questo
fenomeno è particolarmente spiccato in alcune anemie
ereditarie quali la talassemia e l'anemia falciforme, ed è
dovuto sia ai meccanismi fisiopatologici propri della malattia sia al
sovraccarico di ferro (Fe).
In questo
articolo abbiamo preso in considerazione i principali agenti
antiossidanti noti, alcuni dei quali vengono utilizzati,
somministrati a soggetti sani e a individui esposti a sovraccarico di
Fe, nel tentativo di prevenire o quantomeno limitare, i danni da
radicali liberi.
I
radicali liberi sono specie chimiche che hanno un singolo elettrone
spaiato nell'orbitale più esterno. L'energia creata da
questa configurazione instabile viene liberata durante la reazione
con molecole organiche ed inorganiche (proteine, lipidi,
carboidrati), in particolare con molecole chiave nelle membrane e con
gli acidi nucleici1. La continua esposizione a radicali
liberi derivanti sia da fonti esogene (luce solare, radiazioni,
inquinamento) sia endogene, dà il via ad una cascata di
processi dannosi per l'organismo 2.
Essendo
implicati nella patogenesi dell'invecchiamento e di molte malattie,
tra cui l'aterosclerosi, il diabete e il cancro, l'importanza
delle specie reattive dell'ossigeno (ROS) ha assunto sempre
maggiore rilievo nel corso degli ultimi anni.
In
condizioni fisiologiche vi è uno stato di equilibrio tra la
produzione endogena di radicali liberi e la loro neutralizzazione da
parte dei meccanismi antiossidanti di difesa (Figura 1). Quando la
produzione delle specie radicaliche eccede la capacità del
nostro organismo di eliminarle si determina una condizione definita
stress ossidativo.
Gli
antiossidanti endogeni interagiscono con i radicali liberi e, donando
loro un elettrone, li neutralizzano. Le sostanze antiossidanti
assunte con la dieta agiscono invece da “spazzino” o scavenger,
per usare il termine inglese, aiutando così a prevenire il
danno cellulare e tissutale2.
Lo stress
ossidativo determina un aumento dei livelli plasmatici dei prodotti
di perossidazione lipidica quali la malondialdeide (MDA), l'esanale
e il 4-idrossinonenale3.
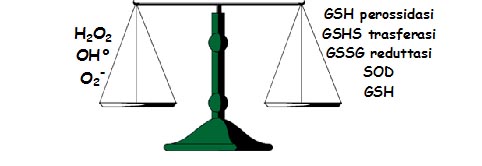
Figura
1. Equilibrio fisiologico tra produzione di ROS e loro
eliminazione attraverso gli enzimi antiossidanti endogeni
Anche le
proteine possono subire modificazioni covalenti indotte dai ROS o
prodotti intermedi dello stress ossidativo. In particolare, tra tutti
gli aminoacidi, la cisteina e la metionina, risultano essere quelli
più suscettibili all'ossidazione.
In alcune
anemie ereditarie, quali la talassemia e l'anemia falciforme , è
presente un notevole stress ossidativo in parte legato alla
fisiopatologia della malattia stessa, in parte secondario al
sovraccarico di Fe trasfusionale. Nella beta-talassemia, le catene
alfa-globiniche non appaiate tendono a precipitare nella cellula
causando eritropoiesi inefficace e contribuendo anche ad aumentare la
formazione di sostanze ossidanti4.
Il Fe che
si accumula per effetto delle trasfusioni e dell'aumentato
assorbimento intestinale, in particolare la frazione di Fe non legata
alla transferrina (NTBI), dà il via ad una serie di reazioni
redox autoamplificantesi (Haber-Weiss, Fenton reaction) che
determinano la produzione di ROS, quali il radicale idrossilico
(OH°), l'anione superossido (O2-) e il perossido d'idrogeno
(H2O2) (Figura 2). Queste inibiscono il potenziale riducente delle
cellule, tra cui ad esempio il glutatione, provocano l'ossidazione
dell'emoglobina ed accelerano la distruzione degli eritrociti
ossidando le componenti proteiche e lipidiche delle loro membrane5.
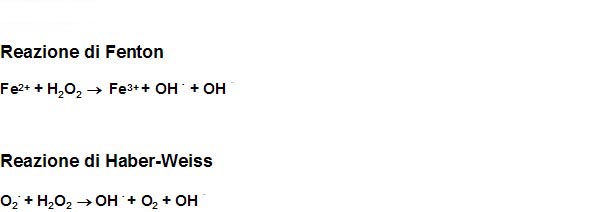
Figura
2. Reazione di Fenton e Haber -Weiss
Lo stress
ossidativo produce una marcata elevazione dei livelli di lipidi e
proteine perossidati. L'aumento delle lipoproteine a bassa densità
(LDL) ossidate è, nell'individuo normale, un importante
fattore nell'insorgenza e nella progressione di lesioni
aterosclerotiche6. Come accennato, alti livelli di MDA
sono una conferma della presenza di ROS.
Nei
soggetti talassemici questo prodotto di perossidazione lipidica è
correlato con i livelli di Fe sierico e del Fe non legato alla
trasferrina. Uno studio del 2006, condotto su cinquanta bambini
talassemici trasfusione-dipendenti, ha rilevato alti livelli sia dei
markers di danno ossidativo sia di tutti gli enzimi antiossidanti ad
eccezione della glutationperossidasi, a conferma del tentativo da
parte dei sistemi antiossidanti endogeni di compensare il danno
ossidativo indotto dal sovraccarico di Fe7.
A
completamento del quadro, è stato evidenziato che le ROS nei
pazienti talassemici, ossidando le piastrine, determinano
un'attivazione delle stesse favorendo pertanto l'insorgenza di
fenomeni tromboembolici8. Allo stesso modo, anche i
granulociti neutrofili, risentendo dello stress ossidativo cronico,
finiscono con il vedere ridotta la loro funzione antibatterica e la
loro risposta al burst respiratorio9.
Nell'anemia
falciforme l'emoglobina S si lega alla membrana dei globuli rossi
innescando la reazione di Fenton con produzione di radicali liberi10.
L'aumento di sostanze ossidanti e l'emolisi intravascolare
causano inoltre consumo dell'ossido nitrico e riduzione della
attività antiossidante11. Il danno da riperfusione
a livello del microcircolo determina a sua volta la liberazione di
citochine infiammatorie che stimolano l'accumulo di Fe nel sistema
reticoloendoteliale12. Quando la produzione di ROS è
eccessiva, gli antiossidanti endogeni non riescono a contrastarne gli
effetti. Pertanto, da tempo si ipotizza l'utilità di un
trattamento con antiossidanti esogeni, da soli o in combinazione.
Principali
sostanze antiossidanti
L'elenco
delle sostanze antiossidanti potenzialmente utilizzabili in terapia è
assai lungo (Tabella 1).
Il primo
antiossidante proposto per il trattamento dei fenomeni ossidativi da
sovraccarico di Fe è stato l'alfa-tocoferolo o vitamina E.
Tale vitamina sembra giocare un ruolo importante nel determinare la
resistenza delle LDL all'ossidazione. Infatti, uno studio condotto
su 30 pazienti affetti da talassemia intermedia ha messo in evidenza
livelli di alfa tocoferolo nel plasma e nelle LDL significativamente
più bassi che nei controlli e una maggiore suscettibilità
delle LDL stesse all'ossidazione. La resistenza delle LDL
all'ossidazione è strettamente correlata con i livelli
plasmatici di vitamina E13. Dosi di 600 mg/die di
alfa-tocoferolo per 9 mesi sembrano avere un effetto positivo
sull'equilibrio ossidativo nel plasma, nelle LDL e sui globuli
rossi talassemici, ma sono necessarie ulteriori conferme per
l'esiguità della casistica14. Bassi livelli di
alfa tocoferolo, legati non tanto ad una scarsa assunzione, quanto al
suo consumo come “radical scavenger”, sono stati registrati anche
nei pazienti con anemia falciforme, in particolare nelle forme più
gravi 15, con conseguente maggiore suscettibilità degli
eritrociti alla perossidazione lipidica. Anche Rachmilewitz ha
riscontrato che la somministrazione di vitamina E può ridurre
lo stress ossidativo nei globuli rossi e in altri tessuti nei
pazienti con talassemia e anemia falciforme16,17.
Pertanto, la somministrazione di vitamina E, da sola o in
associazione con la vitamina C, viene spesso utilizzata anche in
assenza di prove di efficacia15.
Sostanza
antiossidante |
Azione
svolta |
Alfa-tocoferolo
o vitamina E |
Resistenza
LDL a ossidazione
Protezione
della membrana degli eritrociti dalla perossidazione lipidica |
N-acetilcisteina |
Antiossidante
proteico
crescono
livelli
di glutatione in eritrociti ossidati
scende
produzione
NO
scende
in
vitro stress ossidativi piastrinico e ipercoagulabilità |
Resveratrolo |
Effetti
benefici, protettivi su apparato cardiovascolare
rischio
trombotico
down
regulation della risposta antinfiammatoria
azione
antiteratogena
|
Polifenoli
del the |
Protezione
eritrociti da danno ossidativi
scende
assorbimento
del Fe a livello intestinale e concentrazione NTBI
scendono
markers
aterosclerosi e perossidazione lipidica (LDL-ossidate, MDA in
vitro e su animali
|
Cacao |
Effetto
positivo sul sistema cardiovascolare
scende
suscettibilità
di LDL a ossidazione
cresce
HDL
migliora
capacità antiossidativa sierica totale inibisce
attivazione e aggregazione delle piastrine,
induzione
NO-sintetasi endoteliale |
Flavonoide
semisintetico 7-monoidrossietilrutoside.
|
scende
danno
ossidativo su eritrociti di topi affetti da talassemia intermedia |
AGE
(Aged Garlic Extract) |
Inibizione
disidratazione dei globuli rossi falciformi
scende
stress
ossidativo, formazione di corpi di Heinz e ‚ glutatione
ridotto
migliora
deformabilità globuli rossi normali |
Taurina |
nei
topi con sovraccarico di ferro:
scende
stress
ossidativo miocardio
preservazione
funzionalità cardiocircolatoria
cresce
sopravvivenza.
previene
diminuzione
glutatione ridotto (GSH) e
aumenta
glutatione ossidato (GSSG)
|
Chelanti
del Ferro |
scende
perossidazione
lipidica di epatociti, cardiomiociti e macrofagi
scende
formazione
di MDA, rilascio di lattato deidrogenasi
protezione
nei confronti del danno da ipossia-riossigenazione |
Tabella
1. Principali sostanze antiossidanti e azione svolta.
Il
glutatione è un tripeptide formato da cisteina, glicina
e acido glutammico che si trova sostanzialmente in tutte le cellule
del corpo umano. E' deputato alla protezione del danno indotto
dalle radiazioni o dall'ossidazione, alla detossificazione di
metaboliti xenobiotici reattivi e alla rigenerazione delle vitamine
antiossidanti18. Esso gioca un ruolo cruciale nel normale
bilancio tra lo stato ossidato e quello ridotto della cellula.
Permette così l'adeguata regolazione di molte funzioni
vitali come la sintesi e la riparazione del DNA, la sintesi delle
proteine, l'attivazione e la regolazione degli enzimi. Ha anche un
importante ruolo nel proteggere il globulo rosso dai fenomeni
ossidativi che ne causerebbero l'emolisi. Sebbene, è già
stato introdotto in commercio sotto forma di glutatione ridotto (sale
sodico) iniettabile per via endovenosa o intramuscolare. Al momento,
non vi sono in letteratura evidenze che ne giustifichino l'uso.
L'ubichinone
(coenzima Q10-CoQ10) è il maggiore antiossidante endogeno.
Agisce sulla catena di trasporto degli elettroni all'interno dei
mitocondri. Insieme al tocoferolo, rappresenta uno dei più
importanti antiossidanti membrana-associati 18. Studi recenti hanno
riscontrato che il CoQ10 è molto basso nei pazienti
talassemici. La valutazione dello stress ossidativo e dei livelli di
antiossidanti in questi soggetti prima e dopo la somministrazione di
100 mg/die di CoQ10 per 6 mesi ha dimostrato oltre a un significativo
aumento di CoQ10 plasmatico, una riduzione dello stress ossidativo
testimoniato dalla riduzione dei livelli di MDA. L'assunzione di
questa molecola organica conduce ad un miglioramento dei livelli
sierici degli enzimi antiossidanti19.
L'N-acetilcisteina
è un antiossidante proteico, che riduce i livelli dei radicali
liberi e migliora i livelli di glutatione negli eritrociti ossidati
20. E' in grado di ridurre la sintesi di ossido nitrico, di
sopprimere l'espressione e il rilascio di citochine e di inibire
l'espressione di molecole di adesione e del fattore nucleare kB 21.
Quest'ultimo è un fattore di trascrizione che controlla
l'attività di numerosi geni che generano citochine, fattori
di crescita, chemochine, molecole di adesione e proteine della fase
acuta. Il trattamento in vitro delle piastrine di pazienti
talassemici con N-acetilcisteina ha ridotto lo stress ossidativo
riducendo anche lo stato di ipercoagulabilità8.
Il
cosiddetto “paradosso francese”, ossia la supposta minore
incidenza di malattie cardiache in Francia, nonostante la dieta ricca
di grassi saturi, fu descritto per la prima volta dal fisico
irlandese Samuel Black nel 1819. Con grande soddisfazione di
produttori di vino e buongustai, questo fenomeno è stato a
lungo attribuito al resveratrolo, un fenolo non flavonoide presente
nella buccia dell'acino d'uva e quindi nel vino, in particolare
rosso, nelle noci e nelle bacche. A conferma di questa ipotesi, studi
recenti ne hanno documentato gli effetti benefici e protettivi
sull'apparato cardiovascolare (diminuzione del rischio trombotico)
e un'azione antiteratogena. Anche se non è del tutto chiaro
il meccanismo d'azione, si ipotizza un effetto di down regulation
della risposta antinfiammatoria22.
Sfortunatamente,
le ricerche disponibili ad oggi non hanno dimostrato in modo
conclusivo un rapporto di causa-effetto tra il consumo di vino (un
bicchiere)23 e la prevenzione di malattie cardiovascolari.
Resta pertanto da stabilire la validità di questa arma
facilmente reperibile e gradevole contro gli effetti nefasti dei
radicali liberi.
Si
ritiene da tempo che anche i polifenoli del the (Camellia
sinensis), componenti del the verde e del the nero, svolgano
un'azione protettiva nei confronti dell'ossidazione degli
eritrociti24. Il the ha, inoltre, la capacità di
ridurre l'assorbimento del Fe a livello intestinale25.
Estratti del the verde, ricco in catechine antinfiammatorie e
antiossidanti, in special modo l'epigallocatechingallato (EGCG),
diminuiscono in maniera dose e tempo-dipendente la concentrazione
dell'NTBI e contrastano l'aumento dello stress ossidativo nel
plasma umano e negli eritrociti26. Riduzione dei markers
di aterosclerosi e di perossidazione lipidica, in particolare della
concentrazione di LDL-ossidate e della MDA, è stata dimostrata
in numerosi studi in vitro e su animali26. Altri effetti
protettivi comprendono la riduzione del rischio trombotico, la
promozione di una normale funzione endoteliale e la riduzione
dell'espressione di molecole d'adesione cellulare. Studi
epidemiologici suggeriscono che l'assunzione abituale di bevande a
base di the verde riduca l'incidenza di eventi cardiovascolari.
Sembrerebbe che l'assunzione giornaliera da 1 a 3,5 tazze di the
possa determinare effetti benefici a breve e lungo termine27
(Figura 3).

Figura
3. "E' meglio stare tre giorni senza cibo che uno senza thè"
recita un antico proverbio cinese. In effetti sembra che l'assunzione
giornaliera da 1 a 3,5 tazze di the determini effetti benefici
sull'organismo.
Anche il
cacao rappresenta una fonte ricca di flavonoidi, in
particolare della sottoclasse di flavonoidi oligomerici, noti come
procianidine. La polvere di cacao e il cioccolato fondente sembrano
avere un effetto positivo sul sistema cardiovascolare, riducendo la
suscettibilità delle LDL all'ossidazione, aumentando la
concentrazione di colesterolo HDL e migliorando la capacità
antiossidativa sierica totale28. Il cacao, inoltre,
inibisce l'attivazione e l'aggregazione delle piastrine29,30,31
e, attraverso l'induzione dell'ossido nitrico-sintetasi
endoteliale, migliora la funzione degli endoteli favorendone la
vasodilatazione32. Recenti studi hanno messo in evidenza
una riduzione del rapporto leucotrieni/prostacicline nel plasma umano
e nelle cellule endoteliali aortiche. Nei soggetti più
giovani, che in genere preferiscono il cioccolato al the, e nei paesi
in cui il the è poco consumato, il cioccolato potrebbe
rappresentare pertanto un'importante fonte di catechine e
procianidine. Il contenuto di flavonoidi è estremamente
variabile da 0,09 a 4 mg/g di procianidine. Approssimativamente, per
avere un effetto antiossidante in acuto e a lungo termine sarebbe
necessario introdurre rispettivamente 38 e 125 g al giorno di
cioccolato ad alto contenuto di flavonoidi27 (Figura
4).

Figura
4. Il cacao e la cioccolata rappresentano una fonte ricca di
flavonoidi. La loro assunzione determina un miglioramento della
funzionalità cardiaco-vascolare e migliora la capacità
antiossidante sierica.
De
Franceschi33 ha messo in evidenza una riduzione
significativa del danno ossidativo su eritrociti di topi affetti da
talassemia intermedia trattati con il flavonoide semisintetico
7-monoidrossietilrutoside.
Di
recente è stata evidenziata un'attività antiossidante
anche dell'aglio (Allium sativum) e in particolare dell'AGE
(Aged Garlic Extract)34. Quest'ultimo, in vitro,
inibisce la disidratazione dei globuli rossi falciformi bloccando
probabilmente il trasporto anionico negli eritrociti35.
Uno studio condotto su un piccolo gruppo di pazienti affetti da
anemia falciforme sottoposti ad assunzione per 4 settimane di AGE
alla dose di 5 ml/die, ma non di altri estratti, ha messo in evidenza
una riduzione dello stress ossidativo con diminuzione della
formazione di corpi di Heinz e aumento del glutatione ridotto. La
capacità dell'AGE di migliorare la deformabilità dei
globuli rossi normali è stata dimostrata34; sono
necessari invece ulteriori studi per dimostrarne l'efficacia nelle
emazie falciformi36.
Secondo
alcuni Autori, la somministrazione giornaliera combinata di 6 grammi
di AGE, 4-6 grammi di vitamina C e 800-1200 IU di vitamina E potrebbe
avere effetti benefici nei pazienti con anemia falciforme37.
La
taurina o acido 2-amminoetanosulfonico è una sostanza chimica
acida abbondante in molti tessuti di diversi animali. Essa si trova
anche nelle piante, nei funghi, e in qualche specie batterica, ma in
quantità più modeste. Oudit ha dimostrato che il
trattamento con taurina, nei topi con sovraccarico di Fe, riduce lo
stress ossidativo miocardico, preserva la funzionalità
cardiocircolatoria, e aumenta la sopravvivenza.
Inoltre
previene la riduzione di glutatione ridotto (GSH) e l'aumento di
glutatione ossidato (GSSG), normalizzando l'equilibrio GSH-GSSG e
provvedendo alla parziale protezione dello stato redox cellulare38.
La
supplementazione della dieta con indicaxantina determina, in maniera
dose-dipendente, la resistenza all'emolisi degli eritrociti beta
talassemici esposti in vitro all'emolisi ossidativa; previene
l'ossidazione dei lipidi e dell'emoglobina, e previene la
riduzione di vitamina E e glutatione39.
La
curcumina si ottiene per estrazione con solvente dal rizoma
della pianta di Curcuma longa (Curcuma domestica valeton)
seguita da purificazione per cristallizzazione. E' un colorante
alimentare usato per impartire alle preparazioni un colore giallo
simile a quello dello zafferano. A temperatura ambiente si presenta
come una polvere cristallina di colore giallo-arancione intenso.
L'assorbimento orale è relativamente scarso. La curcumina
vanterebbe attività antiossidante, coleretica e colagoga,
antinfiammatoria, antitumorale, pancreoprotettrice e Fe-chelante.
Uno
studio recente in vitro ha cercato di dimostrarne l'attività
NTBI-chelante in plasma di pazienti talassemici e la potenziale
capacità di aumentarne la rimozione se somministrata con altri
chelanti, quali desferoxamina (DFO) e/o deferiprone (DFP). La
curcumina cattura il Fe3+ e forma il complesso curcumina-Fe3+, il cui
legame è dose e tempo-dipendente ed è più
specifico per il Fe3+, rispetto al Fe2+. A dosi equivalenti, DFO, DFP
e curcumina riducono l'NTBI plasmatico. Nell'ordine, il DFP è
più efficace del DFO, a sua volta più efficace della
curcumina. Nessuno di questi chelanti elimina completamente l'NTBI,
ma la combinazione curcumina più DFP sembrerebbe essere più
efficace40. Un ruolo determinante nel proteggere le
cellule dagli effetti deleteri dell'NTBI e quindi dei ROS è
naturalmente quello dei chelanti del Fe. In particolare, si ritiene
che gli effetti benefici che i chelanti esercitano a livello
cardiaco, siano per la maggiore parte da attribuirsi al loro effetto
protettivo nei confronti del Fe libero e del Fe labile plasmatico e
cellulare e quindi dei ROS.
Il DFP ha
determinato, in studi condotti in vitro, una riduzione della
perossidazione lipidica di epatociti e macrofagi41,42,
della formazione di MDA43 e del rilascio di lattato
deidrogenasi42,43. Esso aumenta la protezione nei
confronti del danno da ipossia-riossigenazione44 e induce
la normalizzazione dei parametri di danno alcolico epatico45.
Inoltre il deferiprone protegge i miociti dei ratti neonati dalla
citotossicità doxorubicina-indotta46. Il
trattamento a lungo termine dei pazienti talassemici con DFP o DFO
porta alla riduzione dei livelli plasmatici di aldeide citotossica e
il ripristino dell'attività della glutatione perossidasi nei
globuli rossi47.
A
concentrazioni terapeutiche, la DFO riduce la produzione dei ROS solo
dopo lunga esposizione. Al contrario, il DFP e il nuovo chelante
orale deferasirox (ICL670) riducono la produzione di ROS
mitocondriali dopo breve e lunga esposizione. Anche se questi
risultati indicano che i due chelanti orali riducono il pool di Fe
labile cellulare, non è ancora possibile estendere al setting
clinico le conclusioni e le implicazioni fisiologiche dei dati di
estrazione del Fe radiomarcato, dato che la farmacocinetica è
influenzata dal legame dei farmaci con le proteine plasmatiche, non
valutabile in vitro48.
E'
stato ipotizzato che l'uso combinato di antiossidanti lipidici
(vitamina E) e proteici (N-acetilcisteina) associati ai chelanti del
Fe sia più efficace di ciascuna sostanza da sola 20.
Controverso
è il discorso riguardo la vitamina C. Infatti, se è
vero che nei pazienti trasfusi l'acido ascorbico, espandendo il
pool chelabile di Fe, ne incrementa l'escrezione ottenibile con
DFO49, è altrettanto vero che a basse
concentrazioni accelera la perossidazione lipidica Fe-indotta e
altera la funzione delle cellule miocardiche di ratto in coltura. Non
ne è quindi raccomandata la supplementazione nei pazienti con
emosiderosi, se non in presenza di dimostrato deficit, e sempre
durante terapia chelante con DFO. Al contrario, la vitamina C non è
efficace nell'aumentare l'escrezione di Fe indotta da DFP o da
deferasirox.
Conclusioni
La
supplementazione con sostanze antiossidanti potrebbe limitare o
almeno ritardare i danni dovuti allo stress ossidativo in persone
sane o affette da sovraccarico di Fe, quando i meccanismi fisiologici
rappresentati dagli scavenger endogeni non sono più
sufficienti.
Nonostante
queste sostanze abbiano mostrato degli effetti positivi in studi in
vitro sugli eritrociti, il loro utilizzo in pazienti talassemici non
ha determinato un miglioramento dei livelli di emoglobina. Una
eccezione è naturalmente rappresentata dalla terapia chelante
che è in grado di ridurre il sovraccarico di ferro e di
limitare la produzione di ROS. Il miglioramento della sopravvivenza
dei pazienti verificatosi in anni recenti è una evidenza
indiretta della sua efficacia.
Per le
restanti sostanze i dati che abbiamo a nostra disposizione sono
ancora incompleti e ottenuti su casistiche limitate. Pertanto la
prescrizione non è opportuna e l'automedicazione, assai
diffusa tra i pazienti anche per effetto delle informazioni diffuse
in interne, non va incoraggiata. Ulteriori studi sarebbero necessari,
ma un end point clinico non è facilmente identificabile.
Bibliografia
- Robbins F. Le basi patologiche delle malattie. Piccin 2000; VI edizione. Vol I:14-5.
- Flora SJ. Role of free radicals and antioxidants in health and disease. Cell Mol Biol (Noisy-le-grand) 2007;53(1):1-2.
- Esterbauer H, Schaur RJ, Zollner H. Chemistry and biochemistry of 4-hydroxynonenal, malonaldehyde and related aldehydes. Free Radic Biol Med 1991;11(1):81-128.
- Scott MD, van der Berg JJ, Repka T, et al. Effect of excess alpha-hemoglobin chains on cellular and membrane oxidation in model beta-thalassemic erythrocytes. Journal of Clinical investigation 1993;91:1706-12.
- Scott MD, Eaton JW. Thalassaemic erythrocytes: cellular suicide arising from iron and glutathione-dependent oxidation reactions? Br J Haematol 1995;91(4):811-9.
- Araujo JA, Romano EL, Brito BE, et al. Iron overload augments the development of atherosclerotic lesions in rabbits. Arterioscler Thromb Vasc Biol 1995;15(8):1172-80.
- Naithani R, Chandra J, Bhattacharjee J, Verma P, Narayan S. Peroxidative stress and antioxidant enzymes in children with beta-thalassemia major. Pediatr Blood Cancer 2006;46(7):780-5.
- Amer J, Fibach E. Oxidative status of platelets in normal and thalassemic blood. Thromb Haemost. 2004; 92 (5): 1052-9
- Amer J, Fibach E. Chronic oxidative stress reduces the respiratory burst response of neutrophils from beta-thalassaemia patients. Br J Haematol 2005;129 (3):435-41.
- Repka T, Hebbel RP. “Hydroxyl radical formation by sickle erythrocyte membranes: role of pathologic iron deposits and cytoplasmic reducing agents” Blood 1991;15;78(10):2753-8.
- Gladwin MT, Schechter AN, Ognibene FP, Coles WA, Reiter CD, Schenke WH, Csako G, Waclawiw MA, Panza JA, Cannon RO “Divergent nitric oxide bioavailability in men and women with sickle cell disease” Circulation 2003;107(2):271-8.
- Ludwiczek S, Aigner E, Theurl I, Weiss G. Cytokine-mediated regulation of iron transport in human monocytic cells Blood 2003;101(10):4148-54.
- Tesoriere L, D'Arpa D, Maggio A, Giaccone V, Pedone E, Livrea MA. Oxidation resistance of LDL is correlated with vitamin E status in beta-thalassemia intermedia. Atherosclerosis 1998;137(2):429-35.
- Tesoriere L, D'Arpa D, Butera D, et al. Oral supplements of vitamin E improve measures of oxidative stress in plasma and reduce oxidative damage to LDL and erythrocytes in beta-thalassemia intermedia patients Free Radic Res 2001;34(5):529-40.
- Ray D, Deshmukh P, Goswami K, Garg N. Antioxidant vitamin levels in sickle cell disorders. Natl Med J India 2007;20(1):11-3.
- Amer J, Ghoti H, Rachmilewitz E, Koren A, Levin C, Fibach E. Red blood cells, platelets and polymorphonuclear neutrophils of patients with sickle cell disease exhibit oxidative stress that can be ameliorated by antioxidants. Br J Haematol 2006;132 (1):108-13.
- Rachmilewitz EA, Kornberg A, Acker M. Vitamin E deficiency due to increased consumption in beta-thalassemia and in Gaucher's disease. Ann N Y Acad Sci 1982;393:336-47.
- Chan AC, Chow CK, Chiu D. Interaction of antioxidants and their implication in genetic anemia. Proc Soc Exp Biol Med 1999; 222(3):274-82.
- Kalpravidh RW, Wichit A, Siritanaratkul N, Fucharoen S. Effect of coenzyme Q10 as an antioxidant in beta-thalassemia/Hb E patients. Biofactors 2005;25(1-4):225-34.
- Pace BS, Shartava A, Pack-Mabien A, Mulekar M, Ardia A, Goodman SR. Effects of N-acetylcysteine on dense cell formation in sickle cell disease. American Journal of Haematology 2003;73:26-32.
- Caglikulekci M, Dirlik M, Pata C, Plasse M, Tamer L, Ogetman Z, Ercan B. Effect of N-acetylcysteine on blood and tissue lipid peroxidation in lipopolysaccharide induced obstructive jaundice. Journal of Investigative Surgery 2006;19:175-84.
- Das S, Das DK. Anti-inflammatory responses of resveratrol. Inflamm Allergy Drug Targets 2007;6(3):168-73.
- Spaak J, Merlocco AC, Soleas GJ, et al. Dose-related effects of red wine and alcohol on hemodynamics, sympathetic nerve activity and arterial diameter. Am J Physiol Heart Circ Physiol 2007.
- Srichairatanakool S, Ounjaijean S, Thephinlap C, Khansuwan U, Phisalpong C, Fucharoen S. Iron-chelating and free-radical scavenging activities of microwave-processed green tea in iron overload. Hemoglobin 2006;30(2):311-27.
- de Alarcon PA, Donovan ME, Forbes GB, Landaw SA, Stockman JA Iron absorption in the thalassemia syndromes and its inhibition by tea. N Engl J Med 1979;300(1):5-8.
- Basu A, Lucas EA. Mechanisms and effects of green tea on cardiovascular health. Nutr Rev 2007;65(8 Pt 1):361-75.
- Kris-Etherton PM, Keen CL. Evidence that the antioxidant flavonoids in tea and cocoa are beneficial for cardiovascular health. Curr Opin Lipidol 2002;13(1):41-9.
- Wan Y, Vinson JA, Etherton TD, Proch J, Lazarus SA, Kris-Etherton PM. Effects of cocoa powder and dark chocolate on LDL oxidative susceptibility and prostaglandin concentrations in humans. Am J Clin Nutr 2001;74(5):596-602.
- Flammer AJ, Hermann F, Sudano I, et al. Dark Chocolate Improves Coronary Vasomotion and Reduces Platelet Reactivity. Circulation 2007.
- Rein D, Paglieroni TG, Pearson DA, Wun T, Schmitz HH, Gosselin R, Keen CL. Cocoa and wine polyphenols modulate platelet activation and function. J Nutr. 2000;130(8S Suppl):2120S-6S.
- Rein D, Paglieroni TG, Wun T, et al. Cocoa inhibits platelet activation and function. Am J Clin Nutr 2000;72(1):30-5.
- Karim M, McCormick K, Kappagoda CT. Effects of cocoa extracts on endothelium-dependent relaxation. J Nutr. 2000;130(8S Suppl):2105S-8S.
- de Franceschi L, Turrini F, Honczarenko M, et al. In vivo reduction of erythrocyte oxidant stress in a murine model of beta-thalassemia. Haematologica 2004;89(11):1287-98.
- Moriguchi T, Takasugi N, Itakura Y. The effects of aged garlic extract on lipid peroxidation and the deformability of erythrocytes. J Nutr 2001;131(3s):1016S-9S.
- Ohnishi ST, Ohnishi T, Ogunmola GB. Green tea extract and aged garlic extract inhibit anion transport and sickle cell dehydration in vitro. Blood Cells Mol Dis 2001;27(1):148-57.
- Takasu J, Uykimpang R, Sunga MA, Amagase H, Niihara Y. Aged garlic extract is a potential therapy for sickle-cell anemia. J Nutr 2006;136(3 Suppl):803S-805S.
- Ohnishi ST, Ohnishi T, Ogunmola GB. Sickle cell anemia: a potential nutritional approach for a molecular disease. Nutrition 2000;16(5):330-8.
- Oudit GY, Trivieri MG, Khaper N, et al. Taurine supplementation reduces oxidative stress and improves cardiovascular function in an iron-overload murine model. Circulation 2004 20;109(15):1877-85.
- Tesoriere L, Allegra M, Butera D, Gentile C, Livrea MA. Cytoprotective effects of the antioxidant phytochemical indicaxanthin in beta-thalassemia red blood cells. Free Radic Res 2006;40(7):753-61.
- Srichairatanakool S, Thephinlap C, Phisalaphong C, Porter JB, Fucharoen S. Curcumin contributes to in vitro removal of non-transferrin bound iron by deferiprone and desferrioxamine in thalassemic plasma. Med Chem 2007;3(5):469-74.
- Mostert LJ, van Dorst JA, Koster JF, van Eijk HG, Kontoghiorghes GJ. Free radical and cytotoxic effects of chelators and their iron complexes inthe hepatocyte. Free Radic Res Commun 1987;3:379-388.
- Morel I, Sergent O, Cogrel P, et al. EPR study of antioxidant activity of the iron chelators pyoverdin and hydroxypyrid-4-1 in iron-loaded hepatocyte culture: comparison with that of desferrioxamine. Free Radic Biol Med 1995:18:303-310.
- Morel I, Cillard J, Lescoat G, et al. Antioxidant and free radical scavenging activities of the iron chelators pyoverdin and hydroxypyrid-4-1 in ironloaded hepatocyte culture: comparison of their mechanism of protection with that of desferrioxamine. Free Radic Biol Med 1992;13:499-508.
- Moridani MJ, O'Brien PJ. Iron complexes of deferiproneand dietary plant cathecols as cytoprotective superoxide radical scavengers. Biochem Pharmacol 2001;62:1579-85.
- Tsukamoto H, Lin M, Ohata M, Giulivi C, French SW, Brittenham G. Iron primes hepatic macrophages for NF-kappaB activation in alcoholic liver injury. Am J Physiol 1999;277:G1240-G1250.
- Barnabe N, Zastre JA, Venkataram S, Hasinoff BB. Deferiprone protects against doxorubicininduced myocyte cytotoxicity. Free Radic Biol Med 2002;33:266-75.
- Bartfay WJ, Lehotay DC, Sher GD, et al. Erythropoiesis: comparison of cytotoxic aldehyde generation in beta-thalassemia patients chelated with deferoxamine or deferiprone (L1) versus NO chelation. Hematology 1999;4:67-76.
- Glickstein H, El RB, Link G, Breuer W, Konijn AM, Hershko C, Nick H, Cabantchik ZI. Action of chelators in iron-loaded cardiac cells: Accessibility to intracellular labile iron and functional consequences. Blood 2006;108(9):3195-203.
- Murray JA. Survival and desferrioxamine in thalassaemia major. Br Med J (Clin Res Ed) 1982;284(6326):1401.
Vuoi citare questo contributo?
