Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Aprile 2001 - Volume IV - numero 4
M&B Pagine Elettroniche
Il punto su
L'asma
(Parte
Prima)
Una
recente messa a punto sull'asma, pubblicata sul New England Journal
of Medicine (Busse WW, Lamanske RF, 2001, 344:350-62) permette
di ripercorrere la catena patogenetica della malattia, alla luce
delle più recenti scoperte. Questa occasione offre anche
l'opportunità di riprendere in esame l'”ipotesi
igienistica” per l'identificazione dei fattori favorenti il
fenotipo Th1 versus Th2.
La
trattazione riguarda anche le numerosissime chemochine e citochine
che partecipano a vari livelli alla funzionalità delle vie
aeree.
Vengono
riportate due tabelle con l'elenco completo delle citochine e delle
chemochine.
L'asma
è una sindrome complessa, caratterizzata da vari gradi di:
- ostruzione delle vie aeree
- iperreattività bronchiale
- infiammazione delle vie aeree
In molti
casi la malattia inizia nell'infanzia, legata a fattori genetici
(atopia) e ambientali (virus, allergeni, fattori legati
all'occupazione).
Immuno-istopatologia
dell'asma
Le prove
che l'infiammazione è una componente fondamentale dell'asma,
scaturiscono, fin dai primi studi, dai reperti autoptici in ammalati
di asma. I clinici, pediatri compresi, hanno tuttavia tardato a
considerare l'importanza delle reazioni infiammatorie locali nella
genesi dell'asma, finché una decina di anni fa sono comparse
pubblicazioni che ne hanno definitivamente sottolineato l'interesse,
soprattutto per il versante terapeutico.
Le vie
aeree sono infiltrate di neutrofili e di eosinofili, di mast cellule
degranulate, di ispessimento della membrana basale e di occlusione
del lume bronchiale da parte del muco. A carico dei muscoli lisci dei
bronchi si nota iperplasia e ipertrofia, insieme a ipertrofia delle
cellule caliciformi. Questi reperti sono caratteristici anche delle
forme lievi di asma, pur variando a seconda della gravità
della malattia. La maggior parte delle cellule delle vie aeree sono
attivate e rilasciano mediatori chimici preformati o di recente
sintesi, sostanze che hanno tutte un diretto ruolo nell'asma.
Vi è
infatti abbondanza di citochine che mediano l'infiammazione e di
chemochine chemiotattiche nel liquido di lavaggio bronco-alveolare e
nelle secrezioni bronchiali.
Citochine
= termine generico con il quale si indicano proteine non
anticorpali, rilasciate da una popolazione cellulare (soprattutto
linfociti T, ma anche macrofagi) quando questi vengano in
contatto con l'antigene; esse agiscono come mediatori
intercellulari e come generatori di una risposta immune
Chemochine
= un gruppo di citochine a basso peso molecolare, come
l'interleuchina-8, identificate sulla base della loro capacità
d'indurre chemiotassi e chemocinesi nei leucociti (o in
particolari popolazioni di leucociti) nell'infiammazione; il
gruppo viene suddiviso in 4 sottogruppi sulla base di criteri
genetici, strutturali e funzionali. Esse agiscono come
regolatrici del sistema immune e giocano un ruolo nel sistema
circolatorio e nel sistema nervoso centrale. |
Poiché
chemochine e citochine sono elaborate da cellule infiammatorie delle
vie aeree e nello stesso tempo hanno molti effetti su queste stesse
cellule, si viene a creare una rete autocrina, paracrina ed
endocrina, responsabile dell'asma.
I fattori
di trascrizione interessati nell'infiammazione asmatica
comprendono:
il
fattore nucleare kBla proteina-1 attivatriceil fattore nucleare delle
cellule T attivatela proteina che si lega all'elemento di risposta
dell'AMP ciclico vari membri della famiglia dei fattori di
trascrizione attivati dal sistema di transduzione
Tabella
n. 1 - Citochine che possono avere un ruolo nella genesi dell'asma
Citochine | Cellule
produttrici | Cellule
bersaglio | Funzione |
Fattore
di crescita dei fibroblasti basali | Cellule
endoteliali | Fibroblasti,
matrice | -
Produzione di fibroblasti, formazione della matrice |
Fattore
stimolante le colonie di granulociti | Monociti,
fibroblasti, cellule epiteliali | Precursori
dei neutrofili | -
Maturazione e differenziazione delle cellule bersaglio |
Fattore
stimolante le colonie di granulociti-macrofagi | Macrofagi
attivati e cellule T | Eosinofili,
neutrofili, macrofagi | -
Proliferazione, differenziazione, attivazione, e prolungata
sopravvivenza delle cellule bersaglio, aumentata produzione di
citochine, degranulazione degli eosinofili |
Interferon-a | Monociti,
macrofagi | Cellule
infettate dal virus | -
Inibizione della moltiplicazione virale |
Interferon-b | Monociti,
macrofagi | Cellule
infettate dal virus | -
Inibizione della moltiplicazione virale |
Interferon-g | Th1
cellule CDE4+, linfociti, Cellule NK, Alcune cellule T CD8+ | Macrofagi
Cellule
T CD4+
Cellule
T CD8+
Cellule
natural killer | -
Differenziazione e attivazione dei macrofagi, con espressione dei
recettori Fcg, molecole MHC classe I e classe II, ossido nitrico
sintasi, interleuchina-1, tumor necrosis factor
-
Variazione nel profilo delle citochine da tipo Th2 a tipo Th1;
aumentata espressione dei recettori dell'interleuchina-2
-
Aumentata citotossicità delle cellule T CD8+
-
Attivazione delle cellule natural killer |
Interleuchina-1 | Monociti,
macrofagi | Cellule
Th2 CD4+
Cellule
T CD8+
Cellule
B | -
Produzione di citochine
-
Citotossicità cellulare; produzione di citochine
-
Differenziazione e proliferazione delle cellule B, produzione di
immunoglobuline |
Interleuchina-2 | Cellule
T CD4+ | Cellule
T | -
Espansione clonale delle cellule antigene-specifiche;
differenziazione ed espressione di citochine; maturazione delle
cellule T CD8+ |
Interleuchina
3 | Cellule
T | Cellule
staminali ematopoietiche | -
Proliferazione e differenziazione delle cellule bersaglio |
Interleuchina
4 | CD4+,
cellule Th2 | Cellule
B
Cellule
Th1
Cellule
Th2
Cellule
NK | -
Crescita e attivazione delle cellule B; produzione di molecole
MHC classe II, interleuchina-6, tumor necrosis factor, CD23;
passaggio alla classe IgE; aumento delle IgE, delle IgG1 e IgG4 e
inibizione della produzione di IgM, IgG2 e IgG3
-
Inibizione della differenziazione delle ce3llujle Th1 e della
produzione di interferon g
-
Differenziazione delle cellule Th2
-
Inibizione della proliferazione |
Interleuchina
5 | Cellule
CD4 +, cellule CD8 + | Eosinofili | -
proliferazione, chemioattrazione, adesione, attivazione, aumento
della sopravvivenza e degranulazione degli eosinofili |
Interleuchina
6 | Monociti.
macrofagi | Cellule
B
Monociti,
macrofagi | -
-
-
Maturazione delle cellule B in plasmacellule; passaggio dalla
classe IgG1 a IgA
-
Inibizione del lipopolisaccaride; produzione di interleuchina-1 e
di tumor necrosis factor a |
Interleuchina
7 | Cellule
stremali del midollo osseo | Cellule
pre-B
Cellule
T | -
Proliferazione dei progenitori
-
Proliferazione delle cellule T attivate |
Interleuchina
8 | Macrofagi | Neutrofili | Migrazione
diretta dei neutrofili verso l'endotelio, ma inibizione
dell'adesione di queste cellule |
Interleuchina
9 | Cellule
CD4 + (specialmente Th2) | Cellule
B | Aumenta
le risposte all'interleuchina 4 |
Interleuchina
10 | CD4
+, cellule Th0, cellule Th1, cellule Th2, cellule CD8 + | Monociti
Macrofagi | -
Differenziazione a macrofagi
-
Inibizione della espressione delle molecole della MHC classe II e
della maggioranza delle molecole di adesione; inibizione della
produzione dell'interferon gamma e del tumor necrosis factor,
risultante nel passaggio della differenziazione cellulare da Th1
a Th2; inibizione dell'interleuchina 4 e dell'interferon
gamma da parte delle cellule Th2 |
Interleuchina
11 | Cellule
stromali del midollo osseo | Cellule
B e plasmacellule | -
Simile a quella dell'interleuchina 6 |
Interleuchina
12 | Monociti
e macrofagi | Cellule
NK
Cellule
Th0
Cellule
Th1
Cellule
Th21 | -
Attivazione delle cellule natural killer
-
Produzione e proliferazione dell'interleuchina 2
-
Produzione di interferon g e di tumore necrosi factor alfa
-
Inibizione della produzione di interleuchina 4,, 5 e 10 |
Interleuchina
13 | CD4 +
, cellule Th2 | Cellule
B
Monociti | -
Simile a quella dell'interleuchina 4
-
Aumento della produzione di molecole della classe MHC II e delle
integrine; inibizione della produzione d'interleuchina 1 e di
tumor necrosis factor |
Interleuchina
14 | Cellule
T attivate | Cellule
B attivate | -
Espansione dei cloni di cellule B e soppressione della secrezione
di immunoglobuline |
Interleuchina
15 | Monociti,
macrofagi | Cellule
T, cellule NK | -
Proliferazione e aumentata citotossicità delle cellule
bersaglio; espressione delle molecole 3 di adesione
intercellulare |
Interleuchina
16 | Cellule
CD8 + | Cellule
CD4 + | -
Chemioattrazione, fattore di crescita |
Interleuchina
17 | Celle
CD4 + della memoria | Cellule
CD4 + | -
Proliferazione e attivazione dei fattori autocrini |
Interleuchina
18 | Macrofagi | Cellule
B attivate | -
Simile a quella dell'interleuchina 12; inibizione della
produzione di IgE da parte dell'interferon gamma |
Fattore
stimolante le colonie di macrofagi | Monociti,
fibroblasti, cellule epiteliali | Precursori
ematopoietici multipotenziali | -
Differenziazione dei monociti |
Fattore
di crescita derivato dalle piastrine | Alfa
granuli delle piastrine, monociti, macrofagi | Fibroblasti
e cellule muscolari lisce | -
Proliferazione delle cellule bersaglio: chemioattrazione dei
fibroblasti, attivazione della guarigione delle ferite,
aterogenesi e rimodellamento delle vie aeree |
Fattore
delle cellule staminali (c-kit ligand) | Stroma
del midollo osseo, fibroblasti | Mast
cellule | -
Chemioattrazzione; con interleuchina 3, stimolazione della
crescita; induzione della liberazione d'istamina |
Questi
fattori di trascrizione agiscono sui geni che codificano le citochine
infiammatorie, le chemochine, le molecole di adesione e altre
proteine che inducono e perpetuano l'infiammazione. I
corticosteroidi modulano le risposte infiammatorie, inibendo questi
fattori di trascrizione.
La
capacità delle citochine d'indurre l'espressione delle
molecole di adesione, come la molecola-1 di adesione intracellulare,
la molecola-1 di adesione alla parete vascolare e le molecole di
adesione dei leucociti all'endotelio, forniscono un meccanismo per
l'adesione delle cellule infiammatorie all'endotelio e per la
loro migrazione dalla circolazione nella lamina propria,
nell'epitelio e in molti casi nel lume stesso delle vie aeree.
L'infiammazione
allergica
Osservazioni
sia epidemiologiche che cliniche hanno collegato gli anticorpi IgE
con la gravità dell'asma e le risposte, iniziali e
successive, delle vie aeree agli allergeni. Per iniziare la sintesi
di IgE, gli allergeni inalati debbono incontrare le cellule
dendritiche (che fanno parte delle “cellule presentanti
l'antigene”), che si trovano nelle vie aeree. Le cellule
dendritiche migrano nei linfonodi regionali, dove presentano
l'antigene modificato alle cellule T e B.
L'interazione
delle cellule dendritiche con le cellule T e B porta a risposte, che
sono influenzate dalle citochine e dalla presenza o assenza di
molecole co-stimolatrici. Per esempio il passaggio dalle cellule B
alla produzione di un particolare isotipo di immunoglobuline richiede
due segnali. Per passare alla sintesi di IgE:
il primo
segnale è legato all'interleuchina-4 o all'interleuchina-13,
che si legano ai recettori sulle cellule B; i recettori sono
rappresentati da una catena a comune e usano una stessa via di
trasmissione del segnale (STAT-6). I
l secondo
segnale deriva dal legame del CD40 della cellula B con il suo ligando
sulla cellula T
Accanto a
questi due segnali principali vi possono essere altri segnali fra
altre coppie di ligandi e recettori.
Dopo
essere state sintetizzati e liberati dalle cellule B, gli anticorpi
IgE circolano nel sangue prima di legarsi ai recettori ad alta
affinità (FceRI) sulla superficie delle mast cellule nei
tessuti o sui basofili del sangue. Essi si legano anche ai recettori
delle IgE a bassa affinità (Fce RII o CD23), presenti sulla
superficie dei linfociti, degli eosinofili, delle piastrine e dei
macrofagi. Non è chiaro se il legame delle IgE ai recettori a
bassa attività attivi le cellule e contribuisca
all'infiammazione. Comunque sia, i recettori solubili FceRII sono
importanti per la regolazione della sintesi di IgE.
Anche il
legame molecolare dei recettori FceRI, che avviene quando l'allergene
interagisce con le molecole IgE legate al recettore, causa
attivazione della cellula e liberazione di mediatori, in precedenza
accumulati o di nuova sintesi.
E'
interessante notare che i basofili e le mast cellule possono
secernere interleuchina 4 e interleuchina 13 ed esprimere ligandi
CD40; tuttavia, poiché la liberazione di citochine dipende dal
legame dell'IgE con l'allergene, queste cellule è più
facile che amplifichino piuttosto che inducano la sintesi di IgE.
Le
mast cellule
Le mast
cellule originano dal midollo osseo, entrano in circolo come cellule
mononucleate CD34 +, positive inoltre per il fattore delle cellule
staminali e FceRI, viaggiano verso le sedi della mucosa e della
sottomucosa nelle vie aeree e sottostanno alla maturazione specifica
di tessuto. Il legame delle IgE sulle mast cellule con l'allergene
induce l'attivazione delle vie membranosa e citosolica, che causano
rilasciamento dei mediatori preformati, come l'istamina, e iniziano
la sintesi dei metaboliti dell'acido arachidonico (leucotrieni).
Esistono
due popolazioni di mast cellule:
a) quelle
con triptasi e
b) quelle
con triptasi e chimasi
Non è
ancora chiaro il ruolo dell'uno e degli altri enzimi, comunque gli
inibitori delle triptasi modulano la risposta delle vie aeree agli
allergeni.
Le mast
cellule contengono anche protidoglicani con diverse funzioni e
proprietà biologiche. Esse produco inoltre molte citochine,
come IL-1, IKL-2, IL-3, IL-4, IL-5, il fattore stimolante le colonie
di granulociti e macrofagi, l'interferon g, e il tumor necrosis
factor a. La potenzialità di queste citochine rende possibile
che le mast cellule contribuiscano all'infiammazione allergica, sia
acuta che cronica.
Nei
pazienti con asma l'allergene inalato induce l'ostruzione acuta
delle vie aeree, iniziando la liberazione da parte della mast cellule
di istamina e leucotrieni, che causano la costrizione della
muscolatura liscia. Questa reazione precoce si risolve in un'ora.
4-6 ore più tardi, si sviluppa una reazione tardiva,
prolungata con ostruzione delle vie aeree, come conseguenza delle
citochine e delle chemochine, prodotte dalle cellule infiammatorie
locali, cioè dalle stesse mast cellule, dai macrofagi e dalle
cellule epiteliali, e dalle cellule infiammatorie accorse in situ
(linfociti ed eosinofili).
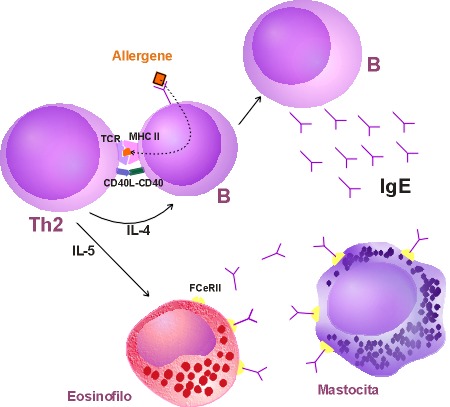
Figura
n.1: Interazione fra cellule T CD4+ e cellule B, importanti per la
sintesi di IgE
L'interleuchina-4
e l'interleuchina-13 forniscono il primo segnale alle cellule B,
che passano alla produzione di IgE. Il secondo segnale è
offerto dalle coppie accessorie delle molecole, come le integrine
aLb2 e la molecola 1 di adesione intercellulare, e CD40 e sua
ligandina. L'assunzione dell'allergene da parte del complesso,
recettore della cellula T e CD3 sull'MHC di classe II del complesso
maggiore di istocompatibilità delle cellule B, porta alla
rapida espressione della ligandina CD40. Quando formato, l'anticorpo
IgE circola nel sangue, eventualmente legato sia ai recettori ad alta
affinità (FceRI) che a quelli a bassa affinità (FceRII
o CD23). Dopo aver incontrato l'antigene, il legame ai recettori ad
alta affinità produce la liberazione di mediatori già
formati o prodotti ex novo. Una volta presenti nei vari tessuti, i
mediatori producono vari effetti fisiologici, a seconda dell'organo
bersaglio.
Gli
eosinofili
La
formazione degli eosinofili inizia nel midollo osseo ed è
regolata dall'interleuchina-2, IL-5 e dal fattore stimolante le
colonie di granulociti e macrofagi. L'interleuchina 5 porta alla
differenziazione finale degli eosinofili immaturi. L'eosinofilo
maturo ha nel citoplasma granuli densi, dai quali derivano le
proteine infiammatorie, inclusa la proteina basica maggiore, la
neurotossina derivata dagli eosinofili e la proteina cationica. La
proteina basica maggiore in particolare può danneggiare
direttamente le vie aeree, aumentando la reattività bronchiale
e causando la degranulazione dei basofili e delle mast cellule.
Questi effetti aumentano la gravità dell'asma. Gli
eosinofili inoltre sono una fonte importante di leucotrieni,
particolarmente del cysteinyl-leucotriene C4, che fa contrarre la
muscolatura liscia delle vie aeree, aumenta la permeabilità
vascolare e può portare la maggioranza degli eosinofili nelle
vie aeree.
Numerose
citochine regolano la funzione degli eosinofili e delle altre cellule
nell'asma. L'IL-5 stimola la liberazione degli eosinofili in
circolo e prolunga la loro sopravvivenza. Il carico di allergeni
nelle vie aeree aumenta la concentrazione locale di Il-5, che si
correla immediatamente con un aumento di eosinofili nelle vie aeree.
Per
partecipare alle risposte infiammatorie allergiche l'eosinofilo
deve migrare dal torrente circolatorio alle vie aeree. Il primo passo
è rappresentato dal “rotolamento” cellulare, mediato dalla
P-selectina sulla superficie degli eosinofili. Il rotolamento attiva
eosinofili e richiede la partecipazione delle classi b1 e b2 delle
integrine sulla superficie degli eosinofili. L'interazione fra le
integrine b2 sugli eosinofili e la molecola 1 di adesione
intracellulare del tessuto vascolare sembra essere importante per la
migrazione transendoteliale degli eosinofili. E' vero che le b1 e
b2 integrine si ritrovano di norma sulla superficie degli eosinofili,
ma la loro attività è regolata da diverse citochine e
chemochine.
La
chemochina RANTES, una proteina infiammatoria 1a dei macrofagi, e le
eotassine giocano un ruolo centrale nell'afflusso di eosinofili
alle vie aeree.
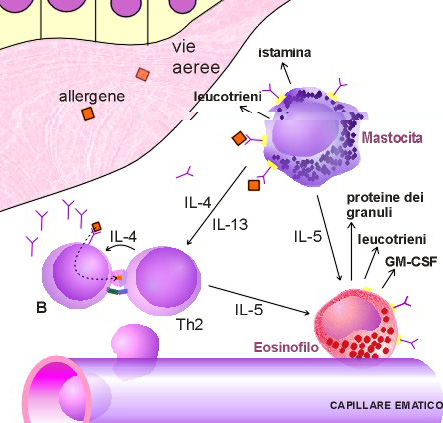
Figura
n.2 - Il ruolo degli eosinofili nell'infiammazione allergica
L'antigene
inalato attiva le mast cellule e i linfociti Th2 nelle vie aeree.
Esso inoltre induce la produzione dei mediatori dell'infiammazione
(istamina e leucotrieni) e di citochine, inclusa l'IL-4 e IL-5.
L'interleuchina-5 raggiunge il midollo osseo e determina la
differenziazione finale degli eosinofili. Gli eosinofili circolanti
entrano nell'area dell'infiammazione allergica e iniziano a
migrare verso il polmone rotolando, attraverso l'interazione delle
selectine ed eventualmente aderendo all'endotelio con il legame
delle integrine con i membri della superfamiglia delle proteine di
adesione: la molecola 1 di adesione delle cellule vascolari (VCAM-1)
e la molecola 1 di adesione intercellulare (ICAM-1). Quando gli
eosinofili entrano nella matrice delle vie aeree, grazie all'azione
di diverse citochine e chemochine, , la loro sopravvivenza è
prolungata dalla IL-5 e dal fattore stimolante le colonie di
granulociti e macrofagi (GM-CSF). Quando attivato l'eosinofilo
libera mediatori dell'infiammazione, come i leucotrieni e le
proteine dei granuli che ledono i tessuti delle vie aeree. Inoltre
gli eosinofili possono produrre GM-CSF per prolungare e potenziare la
loro sopravvivenza e contribuire alla persistenza dell'infiammazione
delle vie aeree. Con la sigla MCP-1 viene indicata la proteina
chemiotattica dei monociti e con la sigla MIP-1a la proteina
infiammatoria dei macrofagi.
Vuoi citare questo contributo?
