Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Aprile 2009 - Volume XII - numero 4
M&B Pagine Elettroniche
Appunti di Terapia
Il
topiramato nell'emicrania dell'adolescente
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza:bartolozzi@unifi.it
L’emicrania
è abbastanza frequente nel bambino e nell’adolescente,
nonostante che essa sia di regola poco diagnosticata e spesso
scambiata per altre situazioni.
La
prevalenza dell’emicrania aumenta con l’aumentare
dell’età: dal 10,6% nei bambini e negli adolescenti in
età fra 5 e 15 anni si passa al 28% di adolescenti fra i 15 e
i 19 anni, con un netto incremento per il sesso femminile durante
l’adolescenza (Abu-Arefeh I, Russell G. BMJ 1994;309:765-9).
Spesso
l’emicrania si associa a un evidente peggioramento della
qualità della vita: in uno studio su 1932 adolescenti fra gli
11 e i 18 anni, con emicrania, è stato visto che il maggior
numero di attacchi insorge fra le 6 del mattino e le 18 del
pomeriggio, con conseguenti ripercussioni sul rendimento scolastico.
La Food
and Drug Administration (FDA) (il corrispettivo per gli Stati
Uniti dell’EMEA per l’Europa) non ha riconosciuto nessun
farmaco per la profilassi dell’emicrania in pazienti in età
pediatrica per la mancanza di studi clinici controllati, contro
placebo, con una adeguato disegno sperimentale. Il topiramato è
stato approvato dalla FDA per la profilassi dell’emicrania
dell’adulto. È stato osservato in molti studi clinici,
randomizzati, in doppio cieco, controllati contro placebo, che il
topiramato alla dose di 100 mg al giorno è efficace, sicuro e
ben tollerato per la profilassi dell’emicrania dell’adulto.
In alcuni di questi studi erano compresi adolescenti da 12 a 17 anni
e bambini/ragazzi da 6 a 15 anni.
La
pubblicazione di cui si parla riporta uno studio randomizzato, in
doppio cieco, in parallelo, controllato contro placebo per valutare
l’efficacia e la sicurezza di due dosaggi di topiramato (50 e
100 mg/die) per la prevenzione dell’emicrania in adolescenti da
12 a 17 anni (Lewis D, Winner P, Saper J, et al. Randomized,
double-blind, placebo-controlled study to evaluate the efficacy and
safety of topiramate for migraine prevention in pediatrics subjects
12 to 17 years of age. Pediatrics 2009;123:924-34).
Il
disegno dello studio
Adolescenti
(12-17 anni) con una storia di ≥ 6 mesi di emicrania, sono stati
assegnati a caso (randomizzazione) a uno di due gruppi:
- Soggetti che hanno ricevuto per 16 settimane 50 o 100 mg al giorno di topiramato;
- Soggetti che hanno ricevuto il placebo.
La misura
dell’efficacia principale del trattamento è stata
giudicata sulla base della percentuale di riduzione degli attacchi
mensili di emicrania, con l’uso della “regola 48 ore”,
durante il periodo base di almeno 12 settimane nella fase doppio
cieco. La “regola 48 ore” definisce come singolo episodio
di emicrania tutti gli eventuali sintomi di ripresa dell’emicrania
entro le 48 ore dall’inizio: regola molto opportuna per una
precisa valutazione dell’effetto di un farmaco contro
l’emicrania, perché esclude d’interpretare come
più attacchi, le riprese o le riacerbazioni del dolore di una
singola crisi, per la durata di 48 ore. La definizione di questa
regola può sembrare arbitraria in qualche caso: ma importante
è applicare questa regola sia nel gruppo dei soggetti trattati
che nel gruppo placebo.
Accanto
alla valutazione dell’efficacia principale (primaria) sono
stati valutati altri end point secondari, come la riduzione mensile
dei giorni di emicrania. Sono state inoltre valutate la sicurezza e
la tollerabilità.
Per una
migliore comprensione del disegno dello studio riporto lo schema,
dal quale si rileva che vi è stata una fase di pretrattamento
(9 settimane: 1 per lo screening, 4 per la sospensione di qualunque
precedente tipo di trattamento e 4 di osservazione), una fase
successiva di trattamento in doppio cieco (suddiviso in una prima
parte di 4 settimane e in una successiva di 12) e infine in una fase
posttrattamento di 6 settimane.
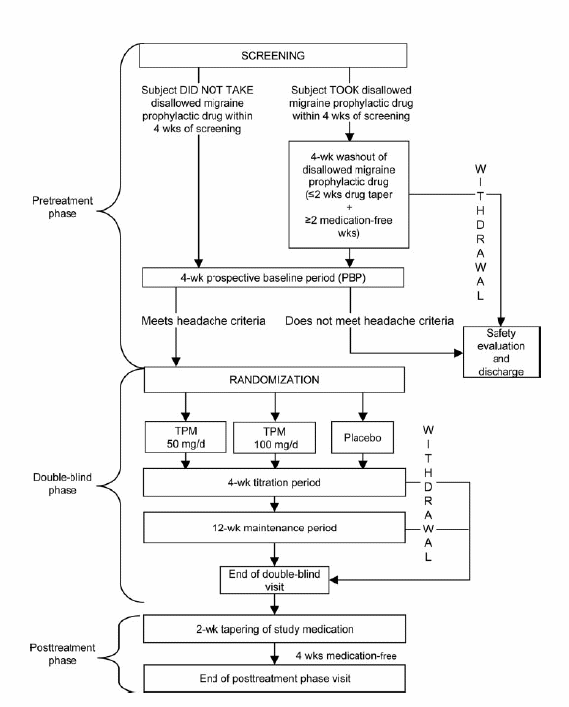
Durante
la prima fase (4 settimane) del periodo di trattamento con topiramato
è stata usata una dose di 25 mg/die, dopo la quale il soggetto
a caso era assegnato, a caso, al gruppo dei 50 mg o al gruppo dei 100
mg. E’ stato ottenuto in tutte le sedi dello studio il consenso
informato da parte dei familiari dei partecipanti e da parte dei
diretti interessati.
Nella
terza fase (quella posttrattamento), il farmaco venne ridotto
gradualmente nella quantità di 25 mg ogni 3 giorni, di
topiramato o di placebo. In 102 soggetti è stato eseguito un
controllo per la ricerca del farmaco (prova di Mann-Whitney 2-sides).
Lo studio
è stato eseguito in 31 sedi diverse, negli Stati Uniti e al di
fuori., fra il 10 agosto 2005 a l’11 novembre 2006. Degli 11
autori, i primi 3 hanno dichiarato di aver ricevuto fondi da un gran
numero di Aziende farmaceutiche, gli altri 8 sono impiegati della
Johnson & Johnson.
I criteri
per la diagnosi di emicrania sono riportati nella Tabella
1
Tabella
1. Criteri per la diagnosi di emicrania pediatrica (proposti
dalla International Headache Society) (Cephalalgia 2004,
24(Suppl 1):1-151.
Emicrania
senza aura:
≥ 5
attacchi che rispondano ai seguenti criteri |
-durata
da 1 a 72 ore
-attacco
con ≥ 2 dei seguenti aspetti:
-localizzazione
bilaterale o unilaterale (frontale/temporale)
-di
tipo pulsante
-d’intensità
da moderata a grave
-aggravamento
in seguito alle attività fisiche routinarie
-≥
una delle seguenti manifestazioni:
-nausea
e/o vomito
-fotofobia
o fonofobia (che possano interferire con il comportamento del
soggetto) |
Emicrania
con aura,
≥ 2
attacchi che rispondano ai seguenti criteri |
-≥
3 delle seguenti caratteristiche:
-≥
insorgenza di un episodio reversibile di aura, indicante una
disfunzione corticale e/o del tronco
-≥
insorgenza di un episodio di aura che si sviluppi gradualmente >
4 minuti o ≥ 2
sintomi
che si sviluppino in successione
-nessun
sintomo di aura deve durare > 60 minuti
-cefalea
deve insorgere entro 60 minuti. |
I
risultati
29 di 35
soggetti (83%) trattati con topiramato alla dose di 50 mg al giorno,
30 di 35 soggetti (86%), trattati con 100 mg/die di topiramato e 26
(79%) di 33 soggetti, trattati con placebo hanno completato il
trattamento in regime di doppio cieco.
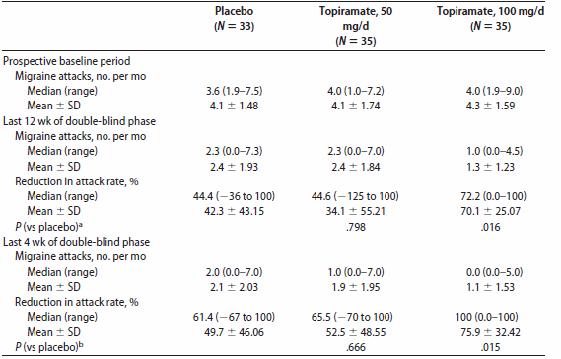
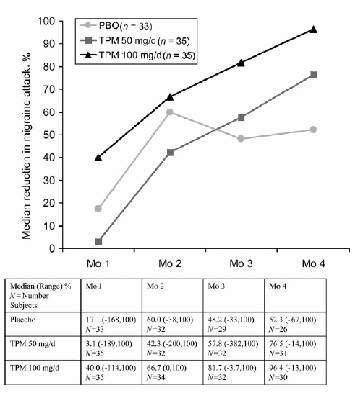
Il
topiramato, alla dose di 100 mg al giorno, ma non alla dose di 50 mg
al giorno, ha determinato una riduzione, statisticamente
significativa, degli attacchi di emicrania in confronto al placebo
(72,2 % contro 44,4%) durante le ultime 12 settimane di trattamento
in doppio cieco.
I
risultati del trattamento con topiramato da 100 mg/die sono risultati
statisticamente significativi per quanto riguarda la riduzione degli
attacchi nei confronti del gruppo placebo:
- P = 0,002 nelle 12 settimane del trattamento in doppio cieco
- P = 0,015 nelle ultime 4 settimane della fase in doppio cieco
Infezioni
delle vie aeree superiori, parestesie, vertigini, anoressia sono
insorte più frequentemente nel gruppo topiramato che nel
gruppo placebo. La proporzione dei soggetti con una o più
segnalazioni di eventi avversi sono state del 74% per ciascuno dei
due gruppi, ai quali è stato somministrato topiramato, contro
il 48% del gruppo placebo.
Nel
gruppo trattato con 50 mg di topiramato 3 soggetti sospesero il
trattamento: uno per stanchezza, uno per “nervosismo” e
uno per labilità emotiva/depressione. Nel gruppo trattato con
100 mg di topiramato due soggetti sospesero il trattamento: uno per
stanchezza e uno per la presenza di calcolosi renale.
Le
conclusioni
La
somministrazione di topiramato alla dose di 100 mg al giorno dimostra
di essere efficace nella prevenzione dell’emicrania negli
adolescenti. Inoltre il trattamento con topiramato è sicuro e
ben tollerato.
Considerazioni
personali
Uno degli
Autori della pubblicazione sopracitata (Paul Winner del Centro
Cefalee di Palm Beach), insieme ad altri studiosi hanno pubblicato
circa 3 anni fa uno studio sull’uso del topiramato come
preventivo dell’emicrania del bambino (Winner P, Pearlman EM,
Linder SL, et al. Topiramato for migraine prevention in children: a
randomized, double-blind, placebo-controlled trial. Headache
2005;45:1304-12).
Lo studio
è stato condotto su 112 bambini da 6 a 15 anni, iniziando con
la dose di 15 mg/die e aumentando da 2 a 3 mg al giorno, fino a una
dose massima di 200 mg, per 12 settimane: la dose media giornaliera
di topiramato durante il periodo di mantenimento fu di 2 mg/kg/die.
Il gruppo placebo prevedeva 50 soggetti. È stato osservato che
il topiramato è efficace nel trattamento preventivo
dell’emicrania del bambino. Esso è risultato ben
tollerato, anche nei bambini. Nonostante questi buoni risultati gli
autori consigliano l’esecuzione di ulteriori studi per
stabilire definitivamente l’utilità del topiramato nella
prevenzione dell’emicrania del bambino. La pubblicazione
recentissima di Pediatrics, di cui ho parlato all’inizio, fa
proprio parte di questo approfondimento.
La
speranza è che anche ricercatori italiani (in particolare
neurologi pediatri) affrontino questi problemi per poter disporre,
anche nel bambino e nell’adolescente di un farmaco efficace per
la prevenzione degli attacchi.
Il
topiramato appartiene al grande gruppo dei farmaci
antiepilettici; è venduto in Italia dall’azienda
Janssen-Cilag, con il nome internazionale di Topamax.
Esso
viene rapidamente assorbito quando somministrato per via orale, si
lega poco alle proteine plasmatiche (10-20%) ed è escreto
immutato nelle urine. Il rimanente viene metabolizzato per
idrossilazione, idrolisi e glicuronoconiugazione: nessun metabolita
da solo supera la cifra del 5% della dose orale. La sua emivita è
di un giorno. Riduce la concentrazione plasmatica di estradiolo, per
cui viene consigliato di aumentare la dose di anticoncezionale orale
quando venga somministrato insieme al topiramato. Il topiramato
sembra essere equivalente come efficacia al valproato e alla
carbamazepina nel trattamento dei bambini e adulti con epilessia
parziale e con epilessia primaria generalizzata di nuova diagnosi.
Non induce aumento del citocromo P450, né della
uridin-difosfato-glicuroniltransferasi, inibisce il citocromo 2C19 e
non inibisce l’uridin-difosfato-glicuroniltransferasi.
In
generale il topiramato è ben tollerato; gli effetti
collaterali più comuni sono:
- Sonnolenza
- Stanchezza
- Disturbi cognitivi
- Perdita di peso
- Irritabilità
- Calcolosi renale, dovuta all’inibizione dell’anidrasi carbonica (come è avvenuto in uno degli adolescenti trattati e riportati nella pubblicazione iniziale)
- Alterazioni nel gusto di bevande, contenenti anidride carbonica
Nell’eventuale
trattamento dell’emicrania del bambino con la somministrazione
per lunghi periodi di tempo di topiramato va tenuto conto dei
sopraricordati disturbi cognitivi in un’epoca della vita nella
quale questa componente intellettiva ha enorme importanza. Nessun
timore invece nei confronti di un aumentato metabolismo della
vitamina D (come avviene con altri antiepilettici) per induzione del
citocromo P450 epatico, perché il topiramato manca di questa
induzione (Goodman & Gilman 11° edizione, pag. 509).
L’assunzione
del farmaco viene consigliata alla sera, in una sola dose
giornaliera.
Queste
sono le preparazioni a disposizione in Italia:
- Compresse rivestite con film da 25 mg, 50 mg, 100 mg e da 200 mg
- Capsule rigide da 15 mg e da 25 mg
Le
compresse non possono essere spezzate. Le capsule possono essere
deglutite intere o possono essere aperte per disperdere il contenuto
in una minima quantità di cibo semisolido (un cucchiaino). La
miscela del farmaco deve essere inghiottita subito dopo la
preparazione, senza masticare. La somministrazione di Topomax non è
influenzata dai pasti. Nella confezione delle compresse è
scritta l’indicazione “Profilassi dell’emicrania”.
Tutte le preparazioni sono in fascia A (Informatore Farmaceutico
2008, pag. 2273).
È
prevista per il trattamento dell’epilessia, la somministrazione
in bambini in età ≥ due anni.
Concludendo,
è possibile affermare che abbiamo oggi a disposizione un
farmaco per il trattamento dell’emicranica dell’adolescente:
tuttavia questa indicazione non è ancora riconosciuta dalla
Food and Drug Administration o da altre Agenzie.
È
probabile che il topiramato sia utile anche nella prevenzione
dell’emicrania del bambino, ma in questo caso, oltre alla
mancanza di un riconoscimento ufficiale da parte delle diverse
Agenzie, è necessario sapere la frequenza e l’entità
dei riconosciuti effetti cognitivi (ricordo la sospensione della
prevenzione delle convulsioni febbrili con fenobarbital, abbandonata
anche per questa ragione). In altre parole bisogna essere sicuri che
“il gioco valga la candela”.
Vuoi citare questo contributo?
