L'attivazione della cascata del complemento e dei recettori toll-like porta alla sintesi e alla liberazione dei mediatori dell'infiammazione che hanno un'azione immediata sui capillari e sugli altri piccoli vasi: la vasodilazione localizzata, l'aumentata permeabilità cellulare, la fuoriuscita dai vasi delle proteine plasmatiche e la migrazione dei leucociti nel tessuto colpito dall'infezione, determinano i segni classici dell'infiammazione: calor, dolor, rubor, tumor e functio laesa. Inizia così la produzione di nuove citochine infiammatorie che attivano i leucociti, accorsi nel tessuto interessato dall'infezione. I meccanismi omeostatici anti-infiammatori contrastano con questi processi, contemporaneamente all'eliminazione dell'agente infettivo da parte dell'immunità innata e adattiva. L'asse ipotalamo-ipofisi surrene e in particolare i glicocorticoidi sono essenziali nel limitare e annullare il processo infiammatorio (Rhen T, Cidlowski JA. Antiinfiammatory action of glucocorticoids - New mechanisms for old drugs. N.Engl J Med 2005, 353:1711-23).
I glicocorticoidi, insieme ai mineralocorticoidi, fanno parte dei corticosteroidi: essi costituiscono le due classi di steroidi che vengono sintetizzate fisiologicamente dalla corteccia surrenale. Di norma il corticosurrene sintetizza ogni giorni 10 mg di idrocortisone (cortisolo), di cui la maggior parte nelle ore del mattino o la parte minore nel pomeriggio. Il cortisone, così diffuso in terapia umana, non è sintetizzato dal corticosurrene, cioè esso è un ormone, preparato in periferia a partire dall'idrocortisone.
Nei meccanismi fisiologici del nostro organismo i glicocorticoidi occupano un posto di rilievo in quanto si dimostrano essenziali per controbilanciare gli effetti pro-infiammatori di citochine, chemochine e altri, formati in risposta a un attacco infettivo o di altra natura; la loro azione regolatrice viene quindi ad essere analoga a quella di molti altri sistemi, attivanti e inibenti, presenti negli umani: fattori favorenti la coagulazione e fattori trombolitici, fattori adatti alla digestione endocellulare delle proteine (tripsine) e fattori antitripsina e così via.
Mentre l'infiammazione localizzata è per lo più benefica, l'infiammazione eccessiva o persistente può portare alla distruzione di tessuto e alla malattia. Insieme ad altri disordini, come l'asma e altre malattie allergiche, le malattie autoimmunitarie e le sepsi, essa è una causa importante di malattia e di morte. I glicocorticoidi sono indicati per la maggior parte di queste affezioni; la loro efficacia nel curare i disordini infiammatori deriva dall'effetto pleiotropico del recettore dei glicocorticoidi su una molteplicità di vie metaboliche. Ma questo effetto molteplice dei glicocorticoidi può determinare, oltre agli effetti favorevoli, anche degli effetti contrari, come il ritardo di crescita nei bambini, l'immunosoppressione, l'ipertensione, l'inibizione della guarigione delle ferite, l'osteoporosi e le alterazioni metaboliche. Tutte queste attività possono alla lunga divenire pericolose per l'organismo, per cui esse complessivamente controindicano l'uso prolungato dei glicocorticoidi.
Di seguito verranno presi in considerazione i meccanismi, con i quali i glicocorticoidi inibiscono l'infiammazione e insieme le limitazione di questi ormoni in terapia.
Il recettore dei glicocorticoidi è un membro della famiglia delle proteine che legano gli ormoni steroidei. Esso si lega fortemente all'idrocortisone e promuove il distacco dai recettori degli “chaperon” molecolari, incluse le proteine heat-shock.
- il complesso recettore-cortisolo muove verso il nucleo, dove si lega, come un omodimero (un complesso di due proteine identiche, legate da un ponte non covalente), alle sequenze del DNA, chiamate elementi glucocorticoidi-respondenti. Il risultante complesso agisce come attivatore o repressore di proteine che iniziano la trascrizione di alcuni geni da parte della RNA polimerasi II.
- la stimolazione di altri geni riguarda l'interazione fra il complesso recettore-cortisolo e altri fattori di trascrizione, come il fattore-kB. Questa ultima azione avviene a bassi livelli di cortisolo.
- il terzo meccanismo interessa i recettori, presenti sulla membrana cellulare e un secondo messaggero, chiamato “via non genomica”, perché agisce attraverso la stimolazione di parti, non corrispondenti a componenti nucleari.
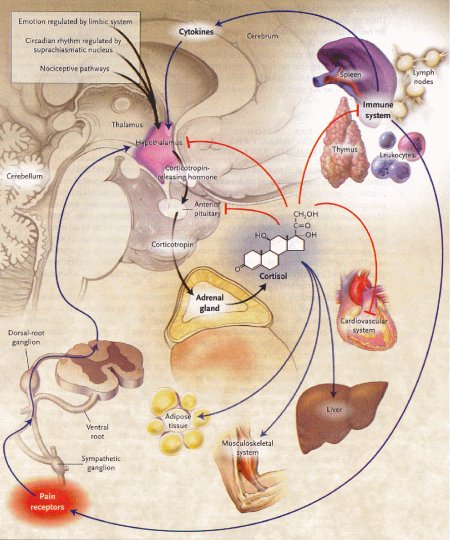
I glicocorticoidi, che vengono così sintetizzato, inibiscono a loro volta la sintesi di citochine e di mediatori dell'infiammazione, venendo così a formare un ansa feedback negativa. Le citochine possono agire anche sul cervello, attivando direttamente l'asse diencefalo-ipofisi-surrene. Una cattiva regolazione di questa ansa neuroendocrina determina modificazioni generali nell'infiammazione e nell'immunità.
L'iperattività dell'asse ipotalamo-ipofisi-surrene in assenza d'infiammazione, come avviene nella sindrome di Cushing, determina immunosoppressione e aumenta quindi la suscettibilità alle infezioni. Il dolore fisico, il trauma emotivo e la restrizione calorica attivano l'asse ipotalamo-ipofisi-surrene e causano immunosoppressione. Anche la diminuzione dell'attività dell'asse ipotalamo-ipofisi-surrene e bassi livelli di glicocorticoidi aumentano la suscettibilità alle infezioni e la gravità stessa dell'infiammazione. I pazienti con malattia di Addison, per esempio, necessitano della somministrazione di glicocorticoidi durante le infezioni e l'infiammazione per prevenire l'effetto dannoso delle citochine. La cattiva regolazione dell'asse ipotalamo-ipofisi-surrene da parte dell'infiammazione si associa a una cattiva prognosi in pazienti con sindrome da difficoltà respiratoria acuta. Analogamente la resistenza acquisita ai corticosteroidi è un evento comune nei pazienti con artrite reumatoide cronica per una diminuita espressione del recettore _ dei glicocorticoidi, per un'aumentata espressione del recettore _ o per in attivazione della chinasi proteica attivata dai fitogeni (MAPK), che fosforilizza il recettore dei glicocorticoidi e inibisce quindi la capacità segnalante di questi ormoni.
(fonte: Rhen T, Cidlowski JA. N.Engl J Med 2005, 353:1711-23)
- induzione e attivazione dell'annessina 1
- induzione della fosfatasi 1 MAPK
- repressione della trascrizione della cicloossigenasi 2.
(fonte: Rhen T, Cidlowski JA. N.Engl J Med 2005, 353:1711-23)
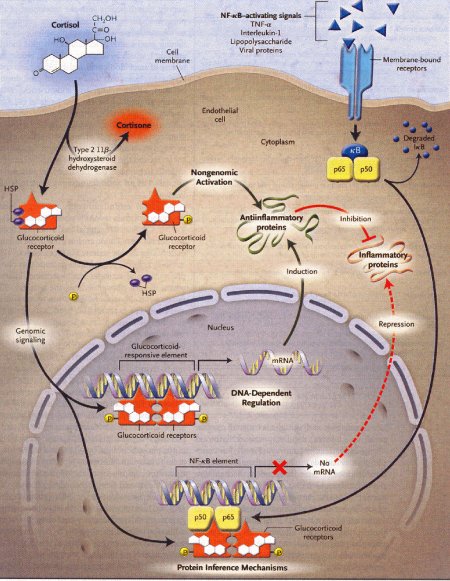
HSP = heat-shock protein
mRNA = RNA messaggero
P = fosfati
Le frecce nere indicano attivazione, le frecce rosse invece inibizione, il segno X indica mancanza di produzione (blocco), cioè non produzione di mRNA.
(fonte: Rhen T, Cidlowski JA. N.Engl J Med 2005, 353:1711-23)
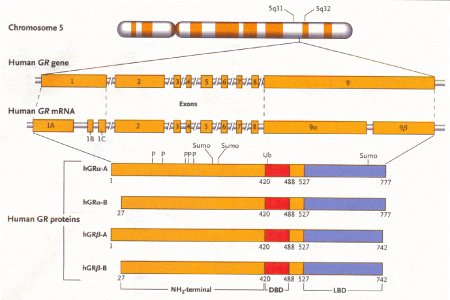
DBP = indica il dominio legante il DNA
LBD = indica il dominio legante il ligando
hGR = recettore umano dei glicocorticoidi
Una seconda proteina anti-infiammatoria, indotta dai glicocorticoidi è la fosfatasi 1 MAPK. Le citochine, le infezioni batteriche e virali e la luce ultravioletta sono alcuni segnali infiammatori che attivano la cascata MAPK. La fosfatasi MAPK defosforila e inattiva tutti i membri della famiglia delle proteine MAPK, inclusa la chinasi Jun N-terminale, le chinasi 1 e 2, dei segnali extracellulari, e la chianasi p38. Di conseguenza la fosfatasi 1 MAPK può inibire anche l'attività cPLA2_ bloccando la fosforilazione da parte della chinasi MAPK e MAPK interagente. Inoltre i glicocorticoidi e il loro recettore interferiscono direttamente con la trascrizione c-Jun mediata.
(fonte: Rhen T, Cidlowski JA. N.Engl J Med 2005, 353:1711-23)
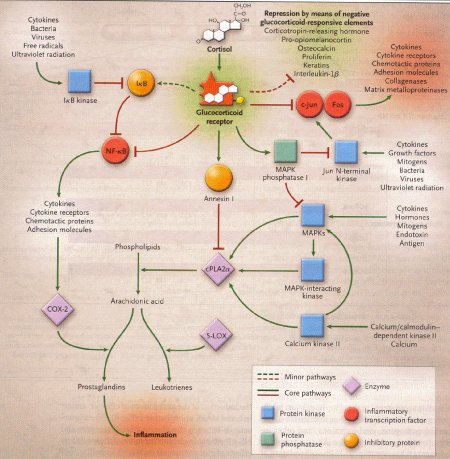
5-LOX = 5-lipodssigenasi; COX-2 = cicloossigenasi 2. Le linee rosse significano inibizione e le frecce rosse attivazione.
Recenti pubblicazioni suggeriscono che i glicocorticoidi possono avere un rapido effetto sull'infiammazione, anche senza determinare cambiamenti nell'espressione dei geni. Il meccanismo non genomico, meglio descritto, interessa l'attivazione della sintetasi dell'ossido nitrico endoteliale (eNOS). I glicocorticoidi stimolano l'attività della fosfatidilinositol-3-idrossichinasi (PI3K) in un recettore corticoido-dipendente, ma non trascrizione-indipendente, presente sulle cellule endoteliali umane. L'attivazione del PI3K porta alla fosforilazione dell'Akt. L'Akt fosforilato fosforilizza e attiva eNOS, con la conseguente produzione di ossido nitrico. Questo reperto è sorprendente perché la produzione di ossido nitrico è generalmente associata a vasodilatazione e infiammazione. Molte ricerche saranno necessarie per chiarire il ruolo dei meccanismi non-transcrizionali nell'inibizione della vasodilatazione, della permeabilità vascolare e della migrazione dei leucociti attraverso l'endotelio.
Risulta evidente da tutto questo che i glicocorticoidi agiscono a diversi livelli mediante meccanismi multipli per controllare l'infiammazione.
Tessuto | Effetti
collaterali |
Surrene | Atrofia
surrrenalica. Sindrome di Cushing |
Sistema
cardio-vascolare | Displipidemia,
ipertensione, trombosi, vasculite |
Sistema
nervoso centrale | Modificazioni
del comportamento, dell'apprendimento, della memoria e
dell'umore (cioè psicosi), atrofia cerebrale |
Apparato
gastro-intestinale | Sanguinamento
gastro-intestinale, pancreatine, ulcera peptica |
Sistema
immune | Ampia
immunosoppressione, attivazione di virus latenti, |
Cute | Atrofia,
guarigione ritardata delle ferite, eritema, ipertrricosi,
dermatite periorale, petecchie, acne indotta dai glicocorticoidi,
strie rubre, teleangectasie |
Sistema
muscolo-scheletrico | Necrosi
ossea, atrofia muscolare, osteoporosi, ritardo di crescita
longitudinale delle ossa |
Occhi | Cataratta,
glaucoma |
Rene | Aumentata
ritenzione di sodio e aumentata escrezione di potassio |
Sistema
riproduttivo | Pubertà
ritardata, ritardo di crescita fetale, ipogonsadismo |
- la ritenzione renale di sodio e quindi l'aumento del volume ematico
- il potenziamento delle risposte vasopressorie all'angiotensina II e alle catecolamine.
I glicocorticoidi hanno un effetto deleterio anche sull'osso dell'adulto. Osteoporosi e aumentato rischio di fratture sono i principali effetti collaterali del trattamento con glicocorticoidi. L'osteoporosi in risposta ai glicocorticoidi è dovuta in parte all'inibizione della trascrizione della osteocalcina negli osteoblasti; l'osteocalcina è un'importante proteina della matrice extracellulare, che promuove la mineralizzazione delle ossa.
Riassumendo i glicocorticoidi aggravano l'osteoporosi inducendo l'apoptosi degli osteoblasti e aumentando l'attività degli osteoclasti.
I glicocorticoidi inibiscono anche la guarigione delle lesioni asettiche. Per esempio le fratture inducono l'infiammazione, mentre la produzione di citochine si ritiene sia essenziale per la guarigione e il rimodellamento dell'osso. Oltre a bloccare la sintesi delle citochine, i gloicocorticoidi inibiscono la sintesi delle metalloproteinasi e del collageno della matrice, fattori importanti per la guarigione delle ferite.
Inoltre i glicocorticoidi promuovono la gliconeogenesi nel fegato, la degradazione delle proteine in aminoacidi nel muscolo (atrofia) e la lipolisi. Non ci sono al momento mezzi per migliorare gli effetti collaterali della terapia prolungata con corticosterodi, sia a livello dei recettori che degli elementi steroidi.-responsivi. Spesso viene usato un trattamento con insulina per un diabete indotto dai glicocosrticoidi o con bifosfonati per l'osteoporosi.
L'esistenza di questi problemi ha indotto i ricercatori a identificare glicocorticoidi potenzialmente selettivi.
Uno studio recente (Schacke H et al, Proc Nat Acad Sci USA 2004, 101:227-32) ha descritto un nuovo cortisonico (ZK216348) con un quadro di repressione e attivazione della trascrizione, che è risultato dranmaticamente differente da quello dei vecchi glicocorticoidi. Il livello di glicocorticoide richiesto per reprimere l'interleuchina 8 nei monociti è da 8 a 12 volte superiore, quello richiesto per indurre la tiroxina.-aminotranferasi nelle cellule epatiche.
Esiste quindi la possibilità di sviluppare selettivi glicocorticoidi dotati di un migliore profilo terapeutico.
Come abbiamo visto tre meccanismi principali riguardano gli effetti dei corticosteroidi:
- il legame dei cortocosterodi ai recettori, localizzati sugli elementi glicocorticoidi-responsivi (come l'induzione dell'annessina 1 e della MAPK fosfatasi 1),
- gli effetti indiretti sull'espressione dei geni, attraverso l'interazione dei recettori dei glicocorticoidi su altri fattori di trascrizione (cioè NF-_B e attivatore della proteina 1)
- e gli effetti (non-genomici) mediati dai recettori dei glicocorticoidi sulla cascata del secondo messaggero (cioè la via PI3K-Akt-eNOS).
Vuoi citare questo contributo?
G. Bartolozzi. I MECCANISMI DI AZIONE DEI CORTICOSTEROIDI.
Medico e Bambino pagine elettroniche 2005; 8(10)
https://www.medicoebambino.com/_glicocorticoidi_infiammazione_recettori_mapk

