Gennaio 2001 - Volume IV - numero 1
M&B Pagine Elettroniche
Il punto su
Il
sistema immune
(Parte
quarta)
- 1° parte: la risposta immune
- 2° parte: i recettori per l'antigene e la selezione clonale
- 3° parte: risposte immuni acquisite B e T
- 4° parte: linfociti e tessuto linfoide
- 5° parte: i linfociti T e la regolazione della risposta immune
Linfociti
e tessuto linfoide
Poiché
solo pochi linfociti sono specifici per un dato antigene, si rende
necessario che le cellule T e B migrino attraverso tutto l'organismo
per aumentare le probabilità che esse incontrino un
particolare antigene. Nel loro viaggio nel sangue i linfociti
impiegano soltanto 30 minuti per percorrere un intero ciclo nel corpo
umano.
Le
risposte immuni verso gli antigeni solubili giunti attraverso il
sangue iniziano nella milza, mentre le risposte verso i microrganismi
presenti nei tessuti, sono iniziate a livello dei linfonodi.
Non
bisogna dimenticare tuttavia che la maggior parte degli antigeni
giungono all'uomo per inalazione o per ingestione. Gli antigeni che
entrano nell'organismo attraverso le membrane mucose attivano le
cellule del tessuto linfoide associato alla mucosa. Per esempio le
risposte agli antigeni giunti all'interno del naso avvengono
all'interno delle tonsille palatine e delle adenoidi. Gli antigeni
che arrivano attraverso l'intestino sono catturati da cellule
epiteliali specializzate, le cellule micropiega (o cellule M). Queste
cellule trasportano l'antigene, attraverso l'epitelio, alle placche
del Peyer, che rappresentano le sedi principali per l'induzione delle
risposte delle mucose agli antigeni ingeriti.
I
linfociti intraepiteliali, situati fra le cellule epiteliali
dell'intestino, incontrano l'antigene, trasportato dalle cellule
micropiega. La maggior parte di essi sono cellule T CD8 positive a/b,
con l'aspetto di grandi linfociti granulari, mentre il 15% sono
cellule T g/d. La funzione dei linfociti intraepiteliali non è
ancora chiaramente stabilita: le cellule T CD4 a/b possono
partecipare alla produzione delle IgA della mucosa, mentre alcune
cellule T g/d possono partecipare all'induzione della tolleranza
immunologica verso gli antigeni, a livello delle superficie mucose.
La maggior parte delle cellule T g/d presenti nell'intestino sembra
svolgere un ruolo di sentinella verso antigeni microbici.
Dopo che
una risposta immune è indotta a livello delle placche del
Payer, i i linfociti entrano nel torrente circolatorio e vanno nelle
sedi effettrici della mucosa, come la lamina propria, dove sono
prodotte grandi quantità di IgA. Ma i linfociti stimolati
raggiungono anche altre sedi del corpo, per cui l'esposizione
all'interno del naso a un antigene, porta alla produzione di IgA
anche nei tessuti mucosali per esempio delle vie genitali.
I
linfociti entrano nei linfonodi, nelle tonsille e nelle placche del
Peyer attraversando speciali venule postcapillari, chiamate venule
endoteliali.
Il
passaggio è mediato dalle molecole di adesione, alcune delle
quali sono naturalmente espresse, mentre altre sono attivate dalle
citochine. Per esempio la L-selectina, naturalmente espressa sui
linfociti, si lega a numerose molecole di adesione presenti nelle
venule endoteliali. Questa interazione induce l'espressione della
funzione linfocitaria, associata all'antigene 1 (LFA-1) dei
linfociti, che facilita l'adesione delle cellule: il passo successivo
è la migrazione dei linfociti attraverso l'endotelio delle
venule verso il tessuto linfoide.
I
linfociti dal sangue entrano soprattutto nella milza, che manca di
venule endoteliali, passando attraverso la zona marginale: le cellule
T vanno principalmente alle guaine linfatiche periarteriolari, mentre
le cellule B vanno nei follicoli linfoidi.
I
centri germinali, le sedi dove avvengono le ipermutazioni dei geni e
lo "switching" delle immunoglobuline e dove hanno origine i
precursori delle plasmacellule, sono una caratteristica dei follicoli
linfoidi secondari, che compaiono nel tessuto linfoide durante la
risposta immune (Vedi Figura n.8). In questo microambiente
l'incontro tra l'antigene presentato dalle cellule dendritiche e i
linfociti specifici è facilitato, la maturazione di questi si
attua in un unico quadro di cooperazione tra linfociti T e B che
porta infine alla selezione ed alla attivazione delle cellule dirette
contro l'antgene.
Figura
n. 8 - Il centro germinale
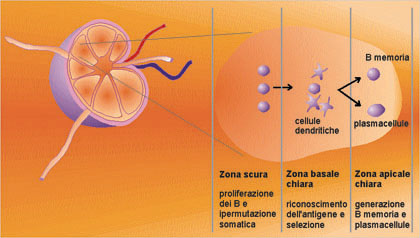
Durante
la preparazione delle risposte immuni acquisite, si formano nei
tessuti linfoidi secondari i centri germinali per creare un
microambiente dove possano interagire tutte le cellule necessarie,
antigene-specifiche e presentanti l'antigene. Molte citochine, come
l'interleuchina-2, 4, 6 e 10 e il fattore b, trasformante la
crescita, e varie molecole sulla superficie cellulare, come CD40,
CD19, CD21 e B7, sono importanti in modo determinante per queste
interazioni. La proliferazione delle cellule B, stimolata
dall'antigene, avviene nelle zone scure ed è accompagnata da
un elevato grado di specificità, risultante dall'ipermutazione
somatica dei geni delle regioni variabili delle immuno-globuline.
Raggiunta la regione basale chiara, le cellule antigene-specifiche ad
alta affinità sono selezionate positivamente, come risulta
dalla loro interazione con i complessi antigene-anticorpo sulla
superficie delle cellule dendritiche del follicolo. Le cellule B, che
non siano positivamente selezionate, vanno incontro all'apoptosi e
sono fagocitate dai macrofagi. Le cellule positivamente selezionate
migrano verso la zona apicale chiara, dove continuano a proliferare,
dove avviene il passaggio alle diverse classi di anticorpi e dove si
generano le cellule della memoria e le cellule precorritrici delle
plasmacellule.
Aspetto
molecolare della risposta immune
Un
antigene è riconosciuto in base alla forma: la forma di un
epitopo è complementare con il sito anticorpo-combinante e la
forma di un peptide del complesso MHC è complementare con la
forma del sito combinante sul recettore della cellula T. Le regioni
determinanti la complementarietà degli anticorpi secreti, e i
recettori sui linfociti si legano in modo non covalente con le
strutture che essi riconoscono.
Gli
anticorpi, sia nelle loro forma presente in circolo, sia come
recettori delle cellule B, possono nello stesso modo riconoscere una
sequenza continua di un peptide. Usualmente tuttavia essi riconoscono
epitopi discontinui, composti da aminoacidi che appaiono insieme non
perché posti nella molecola uno accanto all'altro, ma perché
presentati insieme per le pieghe presenti nella loro stessa struttura
primitiva. Alcuni epitopi, presenti sull'antigene, si adattano
particolarmente bene ai siti combinanti presenti nel repertorio delle
cellule B, per cui la popolazione degli anticorpi contro questi
epitopi tende a prevalere nelle risposte policlonali verso questo
antigene (Vedi Figura n.6).
Gli
epitopi riconosciuti dai recettori delle cellule T a/b, al contrario
sono peptidi lineari, derivati dalla proteolisi dell'antigene. Questi
peptidi sono trasportati alla superficie cellulare entro le pieghe,
leganti i peptidi, di una molecola MHC, come già visto in
precedenza.
Sebbene
sia gli anticorpi che i recettori sulle cellule T possano distinguere
con accuratezza fra antigeni molto vicini, essi talvolta
cross-reagiscono con antigeni, apparentemente non in relazione, sia
perché a volte due antigeni hanno epitopi in comune, sia
perché due differenti epitopi hanno forma e cariche simili.
Tali cross-reazioni costituiscono la base della somiglianza
molecolare, per cui epitopi presenti nei microrganismi stimolano la
produzione di anticorpi (o la proliferazione delle cellule T) capaci
di reagire con l'antigene stesso. Ma ugualmente la somiglianza
molecolare può essere causa di malattie autoimmunitarie: ne è
un esempio la malattia reumatica post-streptococcica, che è
determinata da anticorpi, indotti da un epitopo presente nella
proteina M che cross-reagisce con un epitopo simile, presente sulla
miosina del cuore.
Alcuni
antigeni, detti antigeni cellule T-indipendenti, possono stimolare le
cellule B, senza l'ausilio delle cellule T. Antigeni di questo tipo
sono i polisaccaridi di molti batteri o la flagellina, sostanze che
hanno molti epitopi ripetuti. Questi si legano avidamente ai
recettori delle cellule B e in connessione con segnali di
attivazione, forniti da una varietà di cellule, attivano le
cellule B senza la necessità di aiuto da parte delle cellule T
CD4. Ma, come è stato ben osservato con i vaccini
polisaccaridici contro l'Haemophilus influenzae tipo b, il
meningococco e lo pneumococco, essi non inducono la formazione dei
centri germinali e sono d'altra parte incapaci d'indurre cellule B
della memoria o ipermutazioni somatiche, che portino alla produzione
di anticorpi ad alta affinità. Inoltre il passaggio da
anticorpi della classe IgM ad altre classi di anticorpi è
fortemente limitato, in assenza della cooperazione con le cellule T
helper. Per questa ragione gli antigeni indipendenti dalle cellule T
danno soprattutto un aumento di anticorpi della classe IgM a bassa
affinità.
A
differenza dai polisaccaridi, la maggior parte degli antigeni è
incapace di stimolare le cellule B in assenza dell'aiuto delle
cellule T CD4 (helper), per cui essi sono anche chiamati antigeni
cellule T dipendenti. Quando questi antigeni si legano ai recettori
delle cellule B, essi penetrano all'interno (internalizzazione) e
sono elaborati, all'interno delle cellule B, in corti peptidi, che
sono portati sulla superficie della cellula B da parte delle molecole
MHC di classe II.
Le
cellule CD4 T vicine, che riconoscono questo complesso peptide-MHC,
vengono attivate ed esprimono molecole come CD154 (dette anche CD40
ligando) sulla loro superficie. Quando il CD154 sulla cellula T
attivata si lega al suo recettore CD40, presente sulla cellula B, si
genera un segnale che induce la cellula B a iniziare i processi di
ipermutazione somatica e a passare alle diverse classi di
immuno-globuline.
L'aiuto è
fornito da varie citochine, come l'interleuchina-2, 4 e 5, liberate
dalle cellule T helper. Anche le cellule dendritiche e i macrofagi,
presentanti i complessi peptide-MCH classe II, possono attivare le
cellule T CD4 helper e, attraverso questa via anche le cellule T
attivate esprimono molecole co-stimolanti e liberano citochine
immunostimolanti.
Un
po' di glossario su antigeni ed epitopi
Alcune
sequenze del DNA del microbo possono stimolare le cellule B
direttamente. Esse hanno proprietà adiuvanti, particolarmente
quelle contenenti motifs CpG non metilati (sequenze
dinucleotidiche citosina-guanosina, comprese fra due 5' purine e due
3' pirimidine).
Quando il
sistema immune è stimolato da un epitopo immunogenico, altri
epitopi dell'antigene possono essere coinvolti nella risposta. Questo
effetto, chiamato "diffusione dell'epitopo" può
riguardare altri antigeni che si trovino insieme al primo in
complessi macromolecolar. (diffusione intermolecolare). Questo è
quanto si verifica nel lupus eritematoso sistemico in cui gli
anticorpi diretti contro il DNA sono spesso accompagnati da antcorpi
contro proteine leanti il DNA (ed anzi è verosimile che senza
le risposte a queste ultime la risposta ad alta affinità
contro il DNA, privo in sé di parti peptidiche, non avrebbe
modo di verificarsi).
Epitopi
criptici, che di norma non sono riconosciuti efficientemente dal
sistema immune, possono essere rivelati da un cambiamento
nell'elaborazione dell'antigene, causato dalla stimolazione da parte
delle cellule presentanti l'antigene per mezzo delle citochine
proinfiammatorie, come può avvenire durante l'elaborazione
della proteina base della mielina. D'altra parte l'elaborazione
dell'antigene da parte delle cellule B può portare alla
formazione di peptidi che non sono prodotti dalle cellule dendritiche
e dai macrofagi.
La
continua mutazione dei microrganismi determina un fenomeno, chiamato
"drift" antigenico. I mutanti pongono problemi per
le cellule della memoria del sistema immune. Un rischio ancora più
grande deriva dallo scambio di materiale genetico fra agenti
infettivi vicini, causa di uno "shift" antigenico.
Molto poche, ammesso che ce ne siano, cellule della memoria, che sono
prodotte durante l'esposizione al nuovo agente, possono essere capaci
di riconoscere la nuova variante. Un esempio degli effetti devastanti
di uno shift antigenico è rappresentato dalle pandemie
d'influenza.
Attivazione
e regolazione dei linfociti
I
recettori delle cellule T sono associati sulla superficie delle
cellule con il complesso CD3, formato da molecole che trasmettono i
segnali di attivazione all'interno della cellula, quando il recettore
della cellula T leghi l'antigene. Questo complesso consiste di CD3g,
CD3d e di due molecole di CD3e, insieme con un disolfuro legato con
l'omodimero z catena (Vedi Figura n. 9). Il recettore della cellula B
è anch'esso associato a due molecole, Iga (CD79a) e Igb
(CD79b), che trasmettono segnali alla cellula.
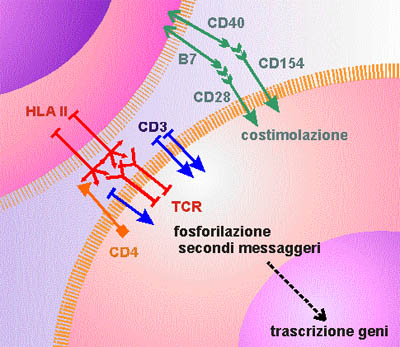
Figura
9. Rappresentazione schematica dei principali recettori coivolti
nell'attivazione dei linfociti T (cellula a destra in basso). Il
recettore dei linfociti T (TCR, in rosso) riconosce l'antigene
associato all'HLA. L'antigene CD4 (in arancione), riconoscendo l'HLA
classe II, "restringe" l'attività dei linfociti CD4
ala cooperazione con cellule specializzate nel presentare l'antigene
(le uniche dotate dell'HLA di classe II). Il complesso CD3 (in blu),
associato al TCR consente la trasmissione all'interno della cellula
del segnale di avvenuto riconoscimento dell'antigene, ma
l'attivazione del linfociti ha bisogno di altri segnali, detti
costimolatori, come ad esempio quelli forniti dalla molecola CD28 (in
verde). Queste stesse molecole sono responabili di fenomeni di
attivazine e maturazione anche nelle cellule che dall'altra parte
sono impegnate nella presentazione dell'antigene (cellule
dendritiche, linfociti B).
La
segnalazione soltanto attraverso i recettori dell'antigene, in
assenza di segnali di co-stimolazione, non attiva i linfociti. Quindi
tali segnali isolati portano ad anergia o ad apoptosi. I segnali
aggiuntivi, richiesti per l'attivazione dei linfociti, derivano da
varie molecole di co-stimolazione sulla superficie delle cellule
vicine e dai mediatori solubili, come le citochine. Le molecole sulla
superficie delle cellule T, che si legano alle molecole di
co-stimilazione sulle cellule presentanti l'antigene, includono le
CD28, la cui ligandina è B7; CD154 che si lega al CD40; e CD2,
che si lega al CD58. Essenzialmente le molecole costituiscono coppie
recettori-ligandine che sono richieste per attivare e regolare i
linfociti.
Le
cellule dendritiche attivate sono potenti stimolatori delle cellule T
nuove, perché esse esprimono grandi quantità delle
molecole co-stimolatrici B7 e CD40. La necessità per queste
molecole di partecipare all'attivazione della risposta immune può
essere spiegata clinicamente. Agenti come la molecola di fusione
CD28-immunoglobulina, che interferisce con l'interazione CD28-B7, ha
un grande potenziale nel limitare il rigetto di organi trapiantati,
interferendo con l'attivazione delle cellule T.
Il legame
del CD40 (espresso dalle cellule B) con il CD154 (indotto dalle
cellule T CD4, stimolate dall'antigene) attiva la protein-chinasi
nella cellula B, che media il passaggio da una classe di anticorpi a
un'altra. I difetti nel gene che codifica il CD154 sono presenti nei
pazienti con sindrome da iper-IgM, legata all'X, nella quale le
persone ammalate hanno livelli bassi o non dimostrabili di IgG, IgA e
IgE, con livelli normali o elevati di IgM.
L'attivazione
della cellula T interessa una serie, molto complessa, di eventi
integrati che derivano dal legame dell'antigene sul recettore
cellulare. Poiché i recettori degli antigeni hanno una
brevissima estroflessione citoplasmica, essi sono associati (nelle
cellule T) con le molecole CD3 e catena z, ambedue segnali di
trasduzione corrispondenti agli ITAM (Immunoreceptor Tirosine-based
Activation Motifs), che sono soggetti alla fosforilazione (P) dalla
protein-chinasi, come p56ick, p59fyn e ZAP-70 (per semplicità
viene mostrata soltanto una delle molecole CD3e). Gli stadi iniziali
dell'attivazione interessano anche il legame del p56ick all'estremità
citoplasmatica del CD4 (nelle cellule T helper) e del CD8 (nelle
cellule T citotossiche). Questi fatti portano alla segnalazione
successiva , interessante un numero di differenti vie biochimiche,
fino all'attivazione dei geni interessati alla proliferazione e alla
differenziazione cellulare. I segnali da parte dei recettori
co-stimolatori, come il CD28 e il CD 154, debbono inoltre essere
presenti per attivare i linfociti; nel caso che i segnali siano
avvertiti soltanto dalle molecole dei recettori degli antigeni, può
seguire anergia o apoptosi.
Un altro
recettore per la co-stimolazione è il CD45, un enzima
fosfatasi che ha un ruolo critico nell'attivazione sia delle cellule
B che T. Le molecole di co-stimolazione che attivano il CD45 non sono
ancora completamente conosciute, ma esse possono includere il CD22,
un recettore di adesione sulla superficie delle cellule B.
Le
citochine, inclusa l'interleuchina-1, l'interleuchina-6 e il fattore
a di necrosi tumorale, forniscono segnali di co-stimolazione. Ma non
tutti i segnali fra le citochine e le molecola della superficie
cellulare sono stimolanti. L'interleuchina-10 e il fattore b di
crescita trasformante spesso forniscono segnali negativi. Ugualmente
il legame della molecola CTLA-4 della superficie della cellula T, con
il B7, in contrasto con il legame del CD28 con il B7, fornisce un
segnale di regolazione verso il basso (down-regulation), come il
legame del recettore Fcg per l'IgG sulle cellule B.
Vuoi citare questo contributo?