Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Dicembre 2006 - Volume IX - numero 10
M&B Pagine Elettroniche
Seminari degli specializzandi
Il bambino con il batticuore
Clinica
Pediatrica, IRCCS “Burlo Garofolo”, Trieste
Indirizzo
per corrispondenza: zemira79@hotmail.com
Introduzione
Le
aritmie nel bambino possono presentarsi come disordine primitivo in
un soggetto per altri versi sano oppure possono insorgere
secondariamente ad una sottostante patologia cardiaca o sistemica in
atto.
Il
riconoscimento ed il trattamento dei diversi disordini del ritmo
cardiaco è materia certamente delicata e merita di essere
affrontata con il (provvidenziale) supporto dello specialista
cardiologo. E' fondamentale, comunque, per il pediatra disporre di
alcune nozioni “elementari” in materia di aritmie nel bambino;
nozioni mirate soprattutto all'identificazione del potenziale
bambino con il batticuore, al riconoscimento delle principali
alterazioni del ritmo e al trattamento in acuzie di alcune di esse.
L'abc
dell'e.c.g.
ovvero
alcune brevi note per renderlo meno oscuro.
Come è
noto, il principale strumento diagnostico in materia di aritmie è
rappresentato, certamente, dall' Elettrocardiogramma, strumento
ahimè tanto “nobile” quanto criptico.
La fine
decodifica di tale “misteriosa traccia grafica” necessita
indubbiamente della supervisione dello specialista cardiologo che
saprà identificare nello specifico (in qualche caso non con
poche difficoltà) le diverse alterazioni del ritmo.
Alcune
grossolane alterazioni, però, possono essere colte anche da un
occhio certamente meno esperto. Come dire: poche idee ma chiare.
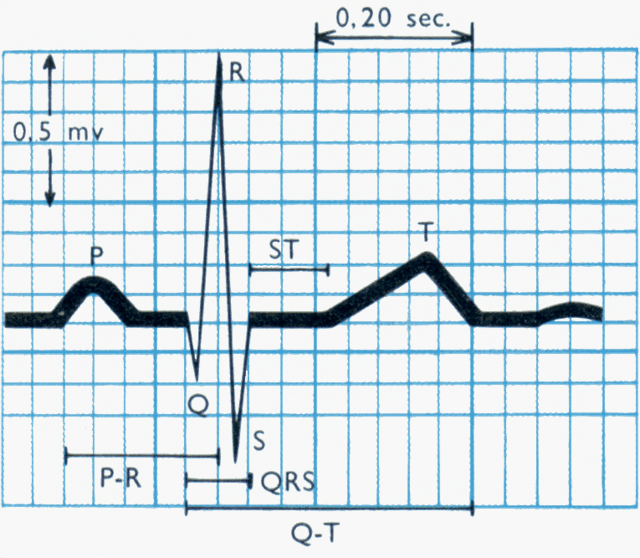
Fig.
1: Tracciato ECG di base con evidenza delle singole onde ed
intervalli.
Nell'ordine
le principali caratteristiche da identificare in un tracciato ECG
sono:
- FREQUENZA
- RITMO
- ASSE CARDIACO
- IPERTROFIA
- INFARTO
In
materia di aritmie il capitolo, certamente, più delicato è
quello del ritmo e ad esso verrà necessariamente dedicato
maggior spazio, ma procediamo con ordine…
I
punti di osservazione del cuore ovvero le derivazioni
Sostanzialmente
dobbiamo ricordare che l'attività elettrica del cuore viene
registrata in superficie da 12 elettrodi che vanno a definire le 6
derivazioni toraciche (V1-V6) e le 6 derivazioni degli arti
(I-II-III. aVR, aVL, aVF).
Fig.
2: Le 12 derivazioni di un tracciato ECG.
1. FREQUENZA
In
condizioni normali il nodo del seno (SA) agisce da pacemaker e regola
la frequenza cardiaca entro un range solitamente compreso tra 60-100/
min. Sappiamo che fisiologicamente nei bambini la frequenza cardiaca
si attesta su valori più elevati che nell'adulto.
Età |
Frequenza
cardiaca |
<2 |
110-160 |
2-5 |
95-140 |
6-12 |
80-120 |
>12 |
60-100 |
Tab.1:
Valori di normalità di frequenza cardiaca nelle varie età.
Quando il
SA impone un ritmo cardiaco inferiore o superiore alle frequenze
fisiologiche per età si parla rispettivamente di bradicardia o
tachicardia sinusale.
Se viene
meno l'attività di pacemaker del SA, altre zone del cuore
(pacemaker ectopici) possono vicariare la funzione del SA imponendo,
però, una frequenza differente a seconda della loro
collocazione:
- Focolaio ectopico atriale: 60-80/min
- Focolaio ectopico giunzionale: 40-60/min
- Focolaio ectopico ventricolare: 20-40/min
Una
tecnica molto rapida per identificare “grossolanamente” la
frequenza in un tracciato ECG consiste nel localizzare una onda R che
cade a livello di una linea marcata in neretto e successivamente
attribuire agli spazi che la separano dalla successiva onda R,
demarcati sempre dalle linee in neretto (distanti 5 mm), la seguente
sequenza di frequenze: 300 – 150 – 100 – 75 – 60 – 50.
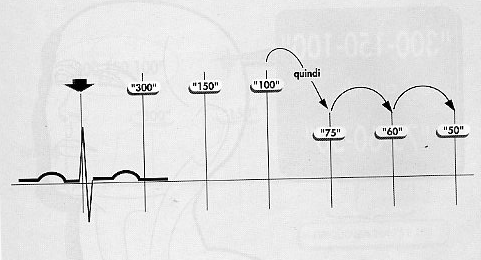
Fig.
3: Sequenza numerica di valutazione rapida della frequenza
cardiaca.
2.
RITMO
Tale
valutazione si dimostra cruciale nell'identificazione delle aritmie
cardiache e non può prescindere da un breve richiamo alle
normali vie della conduzione elettrica cardiaca.
Nodo SA
Depolarizzazione
atriale attraverso il Tratto internodale Anteriore, Medio, Posteriore
e fascio interatriale di Bachmann
Nodo AV
(quando l'impulso atriale raggiunge il nodo AV si genera una pausa
identificata dall'isoelettrica “vera” situata tra l'onda P
ed il complesso QRS)
Fascio di
His
Branche
dx. e sx.
Fibre del
Purkinje Depolarizzazione ventricolare.
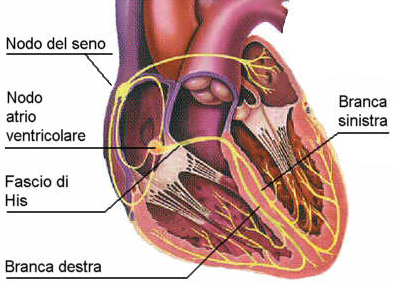
Fig.4:
Sistema di conduzione cardiaco.
Il
complesso QRS è prodotto dalla sola depolarizzazione
ventricolare, il passaggio dell'impulso elettrico attraverso il
nodo AV, il fascio di His e le branche dx. e sx. non viene registrato
dall'ECG.
Le
principali anomalie del ritmo cardiaco possono essere “smascherate”
verificando i seguenti elementi:
- Regolare distanza tra uno stesso tipo di onde (P e QRS).
- Presenza dell'onda P prima di ogni QRS e sua morfologia.
L'assenza
dell'onda P indica la sussistenza di un pacemaker ectopico
localizzato distalmente rispetto al distretto atriale. La morfologia
variabile dell'onda P indica, invece, la scarica di impulsi
provenienti da focolai atriali diversi (pacemaker migrante);
l'attivazione rapida continua e disorganizzata di questi multipli
focolai atriali genera la Fibrillazione atriale.
- Presenza del complesso QRS dopo ogni onda P e sua morfologia.
L'assenza
del QRS dopo un'onda P indica uno stimolo non condotto a livello
ventricolare. La morfologia anomala del complesso QRS identifica un
impulso di depolarizzazione ventricolare originato a livello di un
focolaio ectopico ventricolare che non segue l'abituale sistema di
conduzione ventricolare (fascio di His, branche dx e sx…)
decorrendo in modo rallentato. Si genera in questo caso un PVC
(Premature Ventricular Contraction) caratterizzato da un complesso
QRS più alto e profondo (slargato) in conseguenza di una
depolarizzazione ventricolare (dx e sx) che si realizza in modo non
contemporaneo.
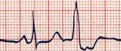
Fig.
5: PVC - il secondo complesso QRS si presenta slargato e più
profondo rispetto al precedente.
Peraltro,
l'assenza dell'onda P prima del PVC suggerisce l'evidenza di
una extrasistole ventricolare (vedi oltre).
- Intervallo P-R.
Un
intervallo maggiore di 0.2 sec. (ovvero 5 mm.) indica la presenza di
un blocco AV di vario grado.
- Ampiezza QRS.
Un QRS
di durata superiore a 0.12 sec. (ovvero 3 mm.) indica la presenza di
un blocco di branca. Per localizzarne la sede andranno valutate le
derivazioni toracice dx. (V1 e V2) e sx. (V5 e V6) alla ricerca di un
QRS con doppia onda positiva R-R' che identifica la mancanza di
depolarizzazione sincrona tra i due ventricoli. La camera
corrispondente alla branca “bloccata” si depolarizza in ritardo
poiché l'impulso verrà condotto solamente attraverso
il miocardio controlaterale.
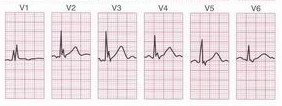
Fig.
6: Blocco di branca Dx; l'aspetto R-R' si identifica nelle
derivazioni di dx.
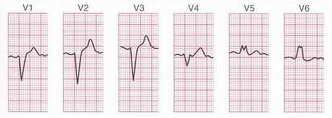
Fig.
7: Blocco di branca Sx; l'aspetto R-R' si identifica nelle
derivazioni di sx.
3.
ASSE
L'asse
cardiaco corrisponde alla direzione della depolarizzazione; sommando
tutti i singoli vettori parziali della depolarizzazione ventricolare
si ottiene il “vettore medio del QRS” che rappresenta la
direzione globale della depolarizzazione ventricolare che, in
condizioni normali, decorre verso il basso e a sx.
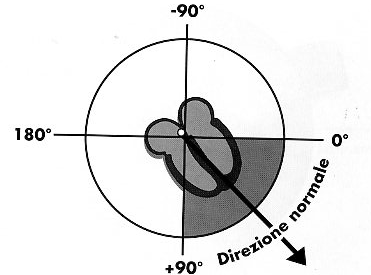
Immaginiamo
di dividere un cerchio in 4 quadranti: l'asse cardiaco
normalmente
cade nell'arco di circonferenza compreso tra 0° e 90°.
Per
valutare la direzione dell'asse cardiaco a partire dal tracciato
ECG vanno considerate le derivazioni I e aVF. Considerando le due
semicirconferenze in verticale, la metà dx. è
identificata da un QRS positivo in I derivazione (depolarizzazione
verso l'elettrodo ovvero verso il braccio sx.); per contro un QRS
negativo in I derivazione (vettore di depolarizzazione che si
allontana dall'elettrodo) identifica la metà sx. del
cerchio.
Riproponendo
lo stesso ragionamento alle semicirconferenze in orizzontale avremo
che la metà inferiore è descritta da un QRS positivo in
aVF, mentre la metà superiore è rappresentata da un QRS
negativo nella stessa derivazione.
In
sostanza valutando la direzione del QRS (positivo o negativo) in I
derivazione ed in aVF ed interpolando i due dati è possibile
identificare il quadrante entro cui ricade il vettore medio del QRS
ovvero l'asse cardiaco.
Tale dato
ci consente di identificare le seguenti condizioni:
I
der.;aVF |
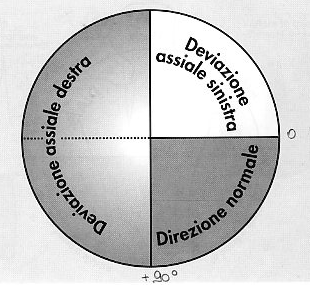 |
I
der. + ; aVF - |
I
der. - ; aVF + |
I
der. + ; aVF + |
Dopo aver
collocato il vettore medio del QRS in uno dei quadranti sarà
importante andare a valutare la derivazione in cui il QRS è
più isoelettrico (uguaglianza tra componenti positive e
negative delle onde) in modo da poter localizzare con precisione
l'asse cardiaco: esso si troverà, infatti, a circa 90°
dall'orientamento della deviazione più isoelettrica.
La
posizione media dell'asse cardiaco sul piano orizzontale si valuta
considerando le derivazioni toraciche (V1-V6), ricordando che in
condizioni normali esso è diretto posteriormente a causa della
posizione prevalentemente posteriore del ventricolo sx. L'asse di
rotazione si colloca, anche in questo caso, a 90° rispetto alla
derivazione toracica in cui il QRS appare isoelettrico.
In
condizioni normali l'isoelettricità del QRS si localizza in
V3-V4 (“zona di transizione”) generando, così, il fenomeno
della progressione del QRS : negativo in V1 e V2,
isoelettrico in V3 e V4, positivo in V5 e V6.
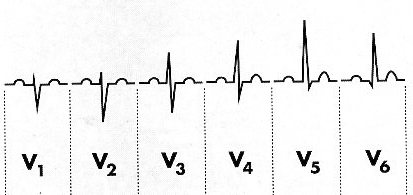
Fig.
8: la progressione del QRS.
Quando,
invece, il QRS isoelettrico si colloca in V1-V2 si genera una
rotazione a dx. ovvero in senso antiorario; in questo caso il vettore
medio del QRS (perpendicolare alla derivazione isoelettrica) si trova
ruotato verso l'avanti ed identifica una condizione di ipertrofia
ventricolare. Al contrario, un QRS isoelettrico in V5-V6 è
caratteristico di una rotazione a sx. ovvero in senso orario
corrispettiva di una rotazione all'indietro dell'asse cardiaco
che si verifica in condizioni di infarto.
4.
IPERTROFIA
L'ipertrofia
atriale si identifica valutando la presenza di un'onda P
difasica (sia positiva che negativa) in V1 che rappresenta il
migliore “punto di osservazione” della contrazione atriale.
Quando
prevale la componente iniziale (positiva) dell'onda P difasica si
tratta di una ipertrofia atriale dx. (ipertensione polmonare, stenosi
valvola tricuspide o polmonare…); quando, invece, la porzione
terminale, negativa, di un'onda P difasica appare ampia e slargata
si tratta di una ipertrofia atriale sx. (stenosi mitralica).
Peraltro,
una ipertrofia atriale va sempre sospettata in presenza di un'onda
P che supera i 2.5 mm di altezza in qualunque derivazione anche se
non difasica.
In
condizioni normali la componente di depolarizzazione del ventricolo
sx. prevale rispetto al dx., quindi, in V1 l'onda negativa S
(ventricolo sx.) si dimostra più profonda dell'onda positiva
R (ventricolo dx).
L'ipertrofia
ventricolare dx. è caratterizzata, invece, da un'aumentata
espressione della componente di depolarizzazione del ventricolo dx.
che determina la comparsa nel tracciato ECG di un'onda R in V1 di
alto voltaggio (rispetto all'onda S).
L'ipertrofia
ventricolare dx. fa aumentare l'entità dei vettori diretti
verso dx. per cui spesso si realizza una deviazione assiale dx. (QRS
negativo in I derivazione) e una rotazione del vettore verso dx. (QRS
isoelettrico in V1-V2).
Nell'ipertrofia
ventricolare sx. si realizza un' iperespressione delle normali
componenti vettoriali di depolarizzazione. In particolare, nelle
derivazioni toraciche si evidenzia un aumento di voltaggio dell'onda
S in V1 e dell'onda R in V5-V6. In dettaglio, si parla di ipetrofia
ventricolare sx. quando la somma dell'altezza di queste due onde
supera i 35 mm: Indice di Sokolow – Lion.
L'aumento
delle componenti vettoriali dirette verso sx. provoca, inoltre, una
deviazione assiale sx. (QRS positivo in I derivazione e negativo in
aVF) e una rotazione del vettore verso sx. (QRS isoelettrico in
V5-V6).
5.
INFARTO
Non si
tratta, certamente, di una evenienza di comune riscontro in età
pediatrica. In relazione ai quadri di aritmia dobbiamo, però,
ricordare che alcune condizioni predisponenti l'insorgenza di
anomalie del ritmo possono, talora, rappresentare un fattore di
rischio anche per l'insorgenza di lesioni ischemiche-infartuali.
Tra queste ricordiamo le cardiomiopatie (ipertrofica e dilatativa, in
particolare), i disordini metabolici, le miocarditi e le anomalie
cardiache congenite.
Le
alterazioni ECG che si possono evidenziare identificano le condizioni
di Ischemia, Lesione ed Infarto.
L'
ISCHEMIA si caratterizza per la comparsa di onde T invertire
(rispetto alla direzione media del QRS) nelle derivazioni toraciche
V1-V6.
La
LESIONE identifica la fase acuta di un infarto e si caratterizza per
la comparsa di uno livellamento del tratto ST che tende, poi, a
tornare alla linea di base. Tale alterazione si realizza, pertanto,
in condizioni di un infarto recente (associazione con onda Q) oppure
in presenza di un infarto di piccola entità (“infarto non
Q”). Il sopraslivellamento del tratto ST indica una condizione di
infarto dell'intero spessore della parete ventricolare, mentre il
sottoslivellamento si realizza in occasione di un infarto
sub-endocardico.
Lo
slivellamento del tratto ST non si realizza, però,
esclusivamente in presenza di infarto. Vanno ricordate, pertanto,
alcune condizioni in termini di diagnostica differenziale:
Sopraslivellamento
ST:
INFARTO A
TUTTO SPESSORE (tratto ST convesso)
PERICARDITE
(tratto ST piatto o concavo)
Sottoslivellamento
ST:
INFARTO
SUB-ENDOCARDICO (depressione piatta)
EFFETTO
DIGITALE (depressione concava)
L'INFARTO
vero e proprio si riconosce dalla presenza di onde Q patologiche
(ovvero ampie almeno 1 mm oppure alte almeno 1/3 rispetto all'intero
complesso QRS) nelle varie derivazioni ad eccezione di aVR. Nelle
derivazioni sx (I, II, V5 e V6) sono normalmente presenti delle
piccole onde Q espressione del vettore di depolarizzazione settale.
La
specifica localizzazione delle onde Q consente l'identificazione
dell'area infartuata ( ma tale competenza va certamente oltre la
volontà di voler richiamare alcune nozioni di base
dell'interpretazione ECG …).
IL
“VOLTO” CLINICO DELLE ARITMIE
L'espressione
clinica delle aritmie dipende fondamentalmente dagli effetti che
l'aritmia stessa produce sulla gittata cardiaca, dalla presenza di
una sottostante patologia cardiaca e dall'età del bambino.
Come
spesso accade nel corteo sintomatologico possiamo distinguere segni e
sintomi aspecifici (e quindi, spesso, subdoli) quali l'astenia, la
riduzione dell'appetito, la suzione inefficace, il dolore toracico…
ed altre manifestazioni, invece, più specifiche quali il
cardiopalmo, la sincope, l'arresto e l'insufficienza cardiaca.
Spesso,
però, anche di fronte a quelli che possono essere considerati
segni e sintomi di specifico indirizzo cardiologico ci troviamo a
fare i conti con una aspecificità eziologica “imbarazzante”.
Basti pensare, ad esempio, che sia le tachiaritmie che le
bradiaritmie severe possono manifestarsi con un quadro clinico molto
simile; ne deriva che la diagnosi eziologica specifica non può
prescindere, nella maggior parte dei casi, da una documentazione ECG
in corso di evento acuto.
Un simile
ragionamento vale anche per la sincope (improvvisa perdita di
coscienza con caduta a terra). Sappiamo che tale evento può
sottendere cause organiche di natura neurologica, respiratoria e
cardiaca. In riferimento alle cause cardiache, inoltre, va detto che
essa può associarsi sia a condizioni di assoluta benignità
(riflesso vago-vagale) che a eventi aritmici brevi ma potenzialmente
letali. In particolare, tra questi andranno valutate con attenzione
le seguenti ipotesi: patologie cardiache congenite, cardiomiopatie,
sindrome di Wolf-Parkinson-White, blocchi AV e la sindrome del QT
lungo.
LA
CLINICA DELLE BRADICARDIE
Nella
popolazione pediatrica è difficile osservare un quadro clinico
chiaramente correlabile alla bradicardia.
Nei
neonati e nei lattanti questa è spesso associata ad un evento
ipossico e/o alle apnee. Nei bambini più grandicelli la
bradicardia può rappresentare un segno indiretto di anoressia
nervosa o manifestarsi secondariamente ad alterazioni del SNC
(ipertensione cerebrale).
Una delle
principali bradiaritmie è certamente rappresentata dal blocco
AV di vario grado. I pazienti con blocco AV di primo e secondo grado
(si veda più avanti) si mantengono sostanzialmente
asintomatici fin tanto che sussiste un margine di aumento della
frequenza di contrazione ventricolare (sostenuta e dalla scarica
fisiologica del nodo del seno oppure dall'instaurarsi di pace-maker
ectopici) in condizioni di esercizio fisico o di stress di varia
natura. Nei pazienti con blocco AV completo le manifestazioni
cliniche più comuni sono date dal rallentamento-arresto di
crescita e dallo sviluppo di insufficienza cardiaca congestizia
(edema polmonare iperteso) nei bambini più piccoli mentre, nel
bambino più grandicello le principali manifestazioni cliniche
sono rappresentate dall'intolleranza allo sforzo e dalla sincope.
…E
DELLE TACHIARITMIE.
L'espressione
clinica delle tachiaritmie dipende da diversi fattori quali l'età
del bambino, la frequenza di scarica, la durata e la ripetitività
degli episodi e dalla presenza/assenza di patologie cardiache
sottostanti.
E'
importante ricordare come una tachiaritmia persistente ma non
sostenuta tendenzialmente può mantenersi asintomatica fino
all'istaurasi di un quadro di scompenso cardiaco congestizio (a
distanza di mesi o anni); le tachiaritmie parossistiche sostenute,
invece, tendono a manifestarsi precocemente con alterazioni
emodinamiche ad insorgenza acuta.
Nel feto
un quadro di tachiaritmia parossistica sostenuta si associa spesso
all'evidenza di idrope fetale o insufficienza cardiaca congestizia
acuta.
Nei
lattanti e nei neonati le tachiaritmie decorrono in modo
sostanzialmente asintomatico fino all'evidenza di una
compromissione emodinamica.
Nel
bambino più grandicello sintomi di sospetto sono: il
cardiopalmo, il dolore toracico, il pallore, la dispnea e la nausea.
Tali
manifestazioni cliniche spesso si evidenziano in presenza di
condizioni slatentizzanti quali la febbre, l'esercizio fisico e le
condizioni di stress in genere.
COSA
PUO' NASCONDERSI DIETRO UN'ARITMIA?
Sostanzialmente
tutte le aritmie riconoscibili nel bambino possono realizzarsi
primitivamente in un soggetto, quindi, per altri versi sano. A loro
volta, poi, tali aritmie possono divenire esse stesse causa di una
disfunzione cardiaca secondaria.
Più
spesso, però, le aritmie tendono a manifestarsi
secondariamente alla presenza di condizioni predisponenti quali
patologie cardiache o sistemiche. Per tale motivo, di fronte ad una
aritmia di recente insorgenza è sempre opportuno procedere ad
una valutazione delle condizioni potenzialmente sottostanti.
CAUSE
CARDIACHE:
- Cardiopatie congenite
Si
associano solitamente a blocchi AV e tachiaritmie ventricolari.
- Pregresso intervento cardiochirurgico
Le
aritmie insorgono secondariamente alla lesione iatrogena di strutture
anatomo-funzionali oppure rappresentano la naturale evoluzione della
stessa malattia di base. Possono, pertanto, realizzarsi sia
rapidamente (early onset) che a distanza di tempo dall'intervento
stesso (late onset).
- Cardiomiopatie
Soprattutto
le forme dilatative ed ipertrofiche.
- Anomalie valvolari
Soprattutto
le condizioni a cui consegue una dilatazione/stiramento atriale
(steno-insufficienza delle AV).
- Tumori cardiaci
In
particolare il Rabdomioma si associa a tachicardia sovra e
sottoventricolare ed, occasionalmente, alla sindrome di
Wolf-Parkinson-White.
CAUSE
SISTEMICHE:
- Malattie neuromuscolari
In
particolare la Distrofia Miotonica, la Distrofia Muscolare di
Duchenne e di Emery – Dreifuss.
- Malattie d'accumulo
Glicogenosi
e malattia di Fabry, in primis.
- Lupus materno
Può
essere causa di blocco AV congenito.
- Infezioni
Tra
queste ricordiamo le miocarditi, le endocarditi batteriche, la febbre
reumatica ed il morbo di Lyme.
- Disionemie
Sia
l'iper che l'ipokaliemia è critica, in questo senso.
- Disordini metabolici
Ipotermia
ed ischemia cardiaca.
- Farmaci
Digossina,
agonisti adrenergici, farmaci anti-aritmici, farmaci induttori della
sd.del QT lungo (vedi oltre).
LE
PRINCIPALI ARITMIE DEL BAMBINO
Le
aritmie nel bambino non differiscono nella sostanza dai quadri
dell'adulto fatto salvo per la diversa incidenza che possono avere
i vari disturbi aritmici nelle diverse età. In particolare, in
età pediatrica una delle condizioni più frequenti è
rappresentata dalla tachicardia sopraventricolare mentre condizioni
quali il flutter, la fibrillazione atriale e il blocco AV di II e III
grado rappresentano condizioni del tutto eccezionali.
Esistono
svariate classificazioni delle aritmie a seconda della modalità
di distinzione considerata: alterazioni ECG, caratteristiche
cliniche, meccanismi di insorgenza…
Considerando
i meccanismi funzionali ed elettrofisiologici che stanno alla base
dell'insorgenza delle varie aritmie possiamo, ad esempio,
classificare i vari quadri nel seguente modo:
- Disfunzioni del nodo del seno
- Extrasistoli
- Aritmie da conduzione anomala
- Blocchi AV
- Tachicardie con QRS normale (sopraventricolari)
- Tachicardie con QRS largo
- Sindromi da pre-eccitazione
Sul piano
terapeutico e prognostico sarà importante valutare sia la
gravità in sé del quadro aritmico, in termini di
ripercussione immediata sull'efficienza di pompa, che la
potenzialità di evoluzione della stessa aritmia verso forme
assai critiche quali la fibrillazione ventricolare.
LE
DISFUNZIONI DEL NODO DEL SENO
Nel
complesso di queste aritmie ricorrono molte condizioni fisiologiche o
parafisiologiche quali l'aritmia sinusale e la bradicardia
sinusale. Accanto a queste, però, non vanno trascurate
condizioni di gran lunga più compromettenti come la Malattia
del nodo del seno (Sick Sinus Syndrome).
Aritmia
sinusale: identifica la fisiologica variabilità della
frequenza cardiaca in relazione alle fasi del respiro (↑ frequenza
in inspirio e ↓ frequenza in espirio). Talvolta, quando la
frequenza di scarica del SA diviene troppo bassa può generarsi
un battito di fuga a partire da un pacemaker ectopico AV. L'aritmia
sinusale risulta, di solito, soppressa in corso di esercizio fisico.
Bradicardia
sinusale: si caratterizza per un ritmo sinusale normale a
frequenza < 90/min nei neonati e < 60/min nei bambini più
grandi. Tale condizioni si riscontra fisiologicamente negli atleti ed
è comune anche nei neonati di basso peso nei quali spesso si
associa ad un ritmo di fuga giunzionale. Sul piano patologico può
instaurarsi secondariamente ad una condizione di ipotiroidismo franco
con mixedema.
In
condizioni di esercizio fisico i pazienti con bradicardia sinusale
sono, comunque, in grado di elevare la frequenza cardiaca oltre i
100/min al contrario di quello che accade in presenza di un blocco AV
di I grado (d.d.).
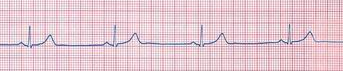
Fig.
9: Ritmo sinusale con frequenza < 50/min.
Malattia
del nodo del seno (Sick Sinus Syndrome): si realizza a causa di
alterazioni a carico del nodo SA e/o del sistema di conduzione
atriale. Può instaurarsi anche in assenza di patologie
cardiache sottostanti anche se, più spesso, rappresenta
l'esito di un pregresso intervento di cardiochirurgia (soprattutto
lo switch atriale per la trasposizione delle grandi arterie).
Può
decorrere in maniera del tutto asintomatica o presentarsi con
vertigini, lipotimia e sincope a seguito di una gittata cardiaca
deficitaria in condizioni di bradicardia spinta con un ritmo di fuga
giunzionale inadeguato. Per contro, possono alternarsi condizioni di
tachicardia sopraventricolare (focus ectopici atriali/giunzionali che
prendono il sopravvento scaricando a frequenza elevata) dando luogo
alla cosiddetta sindrome di bradicardia-tachicardia che può
manifestarsi clinicamente con intolleranza allo sforzo e cardiopalmo.
Soprattutto in quest'ultima condizione la terapia dei pazienti
sintomatici deve essere massimamente individualizzata e
tendenzialmente si avvale della disposizione di un pacemaker
ventricolare in associazione alla terapia antiaritmica.
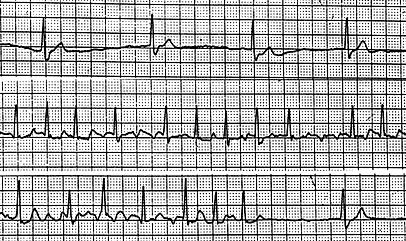
Fig.
10: Alternanza di bradicardia (< 50/min) e tachicardia
(>150/min) in paziente di due
anni
con precedente intervento cardiochirurgico per trasposizione delle
grandi arterie.
EXTRASISTOLI
Si tratta
di depolarizzazioni indotte dalla scarica di un focolaio ectopico
localizzato a livello atriale, giunzionale o ventricolare.
Complessivamente, quando si presentano in forma isolata, sono eventi
del tutto benigni e più frequenti nel bambino piccolo.
Extrasistoli
sopraventricolari: esse possono essere seguite da un QRS normale
o aberrante (prolungato) oppure l'impulso può risultare
bloccato a livello del nodo AV determinando l'assenza del
successivo QRS (pausa apparente).
Nei
neonati le extrasistoli atriali sono piuttosto frequenti e tendono a
regredire entro le prime settimane di vita senza, peraltro,
rappresentare un fattore di rischio per lo sviluppo di aritmie
sintomatiche.
Nei
bambini più grandicelli le extrasistoli sopraventricolari
frequenti possono anticipare lo sviluppo di una disfunzione del nodo
del seno (vedi sick sinus syndrome) soprattutto a seguito di
interventi cardiochirurgici oppure in associazione con
cardiomiopatie.
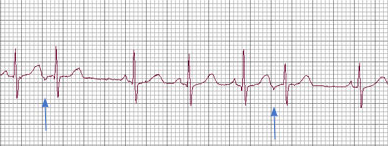
Fig.
11: Extrasistoli atriali – si noti come il II ed il VI battito
appaiono
prematuri con onde P di morfologia diversa.
Extrasistoli
ventricolari: sono caratterizzate dalla presenza di un QRS
anomalo (PVC) e prematuro non preceduto da un'onda P.
Tendenzialmente sono sempre seguite da una pausa compensatoria
(intervallo R-R-R identico ai cicli precedenti) salvo che l'impulso
prematuro ventricolare non venga condotto in modo retrogrado lungo il
nodo AV “resettando” in nodo SA: in questo caso (lo stesso può
accadere anche nelle extrasistoli sopraventricolari condotte in modo
retrogrado) l'extrasistole ventricolare sarà seguita da una
pausa non compenatoria.
Spesso
tendono ad acquisire una ritmicità (“aritmia ritmica”)
stabilendo un rapporto di 1:1 o 2:1 con i battiti normali; si parla
in questo caso di bigeminismo o trigeminismo.

Fig.
12: Bigeminismo – si noti l'alternanza “ritmica” di
complessi
prematuri
ventricolari (PVC) con battiti normali in un rapporto 1:1.
Le
extrasistoli ventricolari isolate (< 6 PVC in un minuto) sono
anch'esse discretamente frequenti nel neonato sano e tendono a
scomparire entro l'adolescenza.
Le
extrasistoli ventricolari “patologiche” si associano, invece, ad
una sottostante patologia cardiaca e spesso indicano che la portata
cardiaca coronarica è inadeguata (ischemia).
Nel
soggetto adolescente ricordiamo il quadro delle extrasistoli
ventricolari benigne che tendono a manifestarsi a frequenze
cardiache basse e a scomparire in corso di esercizio fisico.
In
sostanza, di fronte ad un paziente con evidenza di extrasistoli
ventricolari andrà, per prima cosa, valutata la natura benigna
o meno (potenzialità di degenerare in aritmia severa) del
quadro. Indizi di sospetto sono:
- 2 o più extrasistoli ventricolari in una striscia ECG;
- origine multifocale (PVC di aspetto polimorfo);
- persistenza in corso di esercizio fisico;
- fenomeno R su T (il PVC cade in coincidenza con un'onda T; in questa fase i ventricoli sono particolarmente vulnerabili e da ciò potrebbe scatenarsi una fibrillazione ventricolare);
- presenza di sottostanti patologie cardiache.
Sul piano
terapeutico in acuto si dimostra utile l'infusione di lidocaina in
bolo (1 mg/kg) seguita da un'infusione continua. Nei casi
refrattari o in pazienti con evidenza di compromissione emodinamica
la terapia di scelta è rappresentata dall'amiodarone (5
mg/kg in 20-60 minuti).
TACHICADIE
CON QRS NORMALI – TACHICARDIE SOPRAVENTRICOLARI
Rappresentano
le forme più comuni di tachicardia evidenziabili in età
pediatrica.
Si
distinguono tre principali meccanismi di insorgenza:
- tachicardia da rientro attraverso una via accessoria
- tachicardia da rientro in assenza di una via accessoria
- tachicardia ectopica o autonomica
Le forme
da rientro sono complessivamente le più rappresentate in età
pediatrica e il nodo AV costituisce una porzione determinante del
circuito di rientro. Possono realizzarsi in assenza di patologie
cardiache sottostanti anche se le forme ectopiche sottendono più
frequentemente una condizione di cardiomiopatia o si sviluppano
secondariamente ad un intervento per cardiopatia congenita.
Come
suggerito dalla nomenclatura stessa, queste forme di tachicardia sono
caratterizzate da un QRS di durata e morfologia normale; ad
eccezione, però, delle forme da rientro con conduzione
anterograda lungo la via accessoria (e retrograda attraverso il nodo
AV o una seconda via accessoria) in cui si dimostra un QRS prolungato
ma con morfologia sostanzialmente conservata (!! d.d con tachicardie
ventricolari!!).
Si
presentano, solitamente, con episodi accessuali - tachicardia
sopraventricolare parossistica - con frequenze di 180-300/min,
caratterizzati da un esordio ed una cessazione acuta spesso
“triggerati” da un battito prematuro o da un battito di fuga
giunzionale secondario ad una pausa sinusale; tali eventi si
realizzano più comunemente in presenza di un fatto infettivo
concomitante e tendono a presentarsi a riposo.
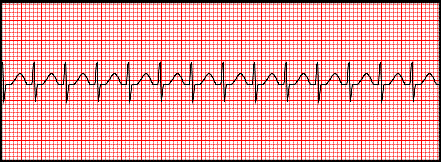
Fig
13: Tachicardia sopraventricolare con frequenza di 200/min.
Nei
bambini piccoli il quadro può risultare misconosciuto (per
impossibilità di riferire una sensazione di cardiopalmo o di
dolore precordiale) e manifestarsi con un quadro di scompenso
cardiaco (secondario alla lunga persistenza della tachicardia con
esito di compromissione emodinamica importante). Il bambino, in
questo caso, si dimostrerà pallido, agitato ed irritabile,
tachipnoico, spesso con evidenza di epatomegalia.
In
termini diagnostici sarà importante distinguere una
tachicardia sopraventricolare parossistica dalla tachicardia
sinusale (TS).
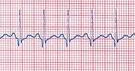
Fig.
14: Tachicardia sinusale con frequenza di 150/min
Quest'ultima
è la tachicardia di più frequente riscontro in età
pediatrica ed è provocata generalmente da un'attività
intensa come il pianto e l'esercizio fisico, da stress come l'ansia,
la paura o la febbre. Altre cause comuni sono il dolore, l'ipossia,
l'ipovolemia, la sepsi e l'anemia. In questo caso il tracciato ECG
dimostra un andamento sinusale in cui ogni complesso QRS appare
preceduto da un'onda P facilmente identificabile; la frequenza
cardiaca è elevata ma di solito inferiore ai 220/min. con
evidenza di modeste oscillazioni. La tachicardia sinusale regredisce,
solitamente, quando cessa lo stress qualunque ne sia la causa e
quindi la terapia deve essere diretta verso la causa scatenante: un
antidolorifico, un antipiretico, la somministrazione di fluidi o una
trasfusione di emazie concentrate.
Nella
diagnostica differenziale tra le due condizioni i seguenti elementi
depongono per un quadro di tachicardia sopraventricolare
parossistica:
- Presenza di cardiopatia
- Preesistente sindrome di Wolf-Parkinson-White
- Pregressi episodi di TPSV
- FC > 220/min nel primo anno di vita o > 180/min oltre il primo anno di vita
- Onde P spesso difficilmente identificabili
- Mancanza di variabilità fra battito e battito (di solito presente nella TS)
- Insorgenza e interruzione improvvise (nella TS la FC rallenta o aumenta gradualmente)
Sul piano
terapeutico vanno distinti gli interventi mirati alla risoluzione
dell'attacco acuto rispetto alla prevenzione delle ricorrenze.
Di fronte
ad un paziente clinicamente stabile, è opportuno procedere in
prima battuta con delle manovre di stimolazione vagale quali il
“diving reflex” che si realizza applicando del ghiaccio per
15-20” sul viso del bambino (!! ostruzione delle vie aeree), il
massaggio di un seno carotideo o l'esecuzione di un Valsalva (nel
bambino collaborante).
La
compressione dei bulbi oculari è, invece, potenzialmente
pericolosa ed è pertanto controindicata in età
pediatrica.
Se la
stimolazione vagale non è sufficiente a ristabilire un ritmo
sinusale bisogna procedere con l'impiego di ausili farmacologici ed
in primo luogo ricorrendo all'adenosina. Si tratta di un farmaco a
breve emivita in grado di indurre un blocco farmacologico a livello
dei nodi SA e AV. Va somministrata in bolo e.v. rapido (con
successivo lavaggio con 2.5-5 cc SF) alla dose iniziale di 0.1 mg/kg
che può essere poi aumentata a 0.2 mg/kg. L'efficacia del
farmaco si dimostra con un brusco rallentamento della FC, talora con
l'evidenza di una breve fase di asistolia, seguita da una rapida
ripresa della normale attività cardiaca.
Di fronte
ad un bambino con grave compromissione cardio-circolatoria o con
evidenza di un improvviso aggravamento della sintomatologia clinica è
indicato il ricorso alla cardioversione sincronizzata (0.5 – 1
J/Kg).
Una volta
ottenuta la stabilizzazione del paziente andrà valutata (in
collaborazione con lo specialista cardiologo) l'opportunità
di instaurare una terapia di profilassi delle recidive. Tale
valutazione dovrà tenere conto dell'età del paziente,
della frequenza e durata degli episodi, della severità dei
sintomi e della presenza o meno di patologie cardiache o sistemiche
sottostanti.
A questo
proposito va ricordato che la possibilità di recidive si
dimostra direttamente proporzionale all'età di insorgenza
del primo episodio. Nei bambini con esordio entro i 3-4 mesi di vita
il tasso di recidive è praticamente nullo mentre nei casi ad
esordio tardivo la percentuale di recidive può elevarsi anche
fino al 60%.
La
profilassi può essere ottenuta attraverso la somministrazione
di farmaci anti-aritmici oppure mediante l'ablazione con
radiofrequenze della via accessoria (quest'ultima procedura si
riserva ai pazienti più grandi).
Flutter
e Fibrillazione atriale: si tratta di aritmie di difficile
riscontro in età pediatrica. Prevalentemente si realizzano in
presenza di patologie cardiache o sistemiche sottostanti ad
eccezione del neonato in cui, seppur raramente, è possibile
registrare un evento di flutter atriale “primitivo”. In
particolare, si tratta di aritmie che accompagnano quadri di
cardiopatie congenite, interventi cardiochirurgici o più
spesso condizioni di marcato stiramento atriale (stenosi mitralica
post-reumatica, insufficienza mitralica e/o tricuspidale).
Il
flutter atriale si origina a partire da un unico focolaio
ectopico atriale (onde P , o meglio onde di flutter, con identica
morfologia) che scarica alla frequenza di 250-300/min. Tale frequenza
di impulsi non può essere trasmessa attraverso il nodo AV in
un rapporto di 1:1, ne deriva la compresenza inevitabile di un certo
grado di blocco AV tale per cui solo occasionalmente una
depolarizzazione atriale sarà seguita da un complesso QRS (di
morfologia normale).
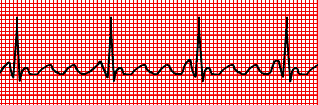
Fig.
15: Flutter atriale, si noti come non tutte le onde P, peraltro
di
morfologia sovrapponibile, siano seguite da un QRS.
La
fibrillazione atriale, invece, è sostenuta dalla
scarica di numerosi focolai ectopici atriali (linea di base
irregolare senza evidenza di vere e proprie onde P) che si attivano a
frequenze molto elevate (350-450/min) generando un ritmo atriale
disordinato e completamente irregolare seguito da una risposta
ventricolare irregolare.
In
assenza di cardiopatie sottostanti, l'insorgenza di una
fibrillazione atriale in un bambino precedentemente sano può
essere sostenuta da un quadro di tireotossicosi, di embolia polmonare
o di pericardite (condizioni da verificare!). Infine, va valutata con
attenzione l'anamnesi familiare di questi pazienti poiché
esistono quadri di fibrillazione atriale su base genetica.
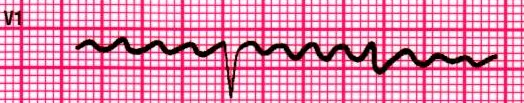
Fig
16: Fibrillazione atriale; non si identificano delle vere onde P
ma piuttosto
una
linea di base irregolare intervallata da occasionali QRS.
SINDROMI
DA PRE-ECCITAZIONE
Si tratta
di una classe di aritmie in cui lo stimolo atriale viene condotto, in
parte o completamente, ai ventricoli in modo prematuro attraverso una
via alternativa rispetto al nodo AV; la forma più comune è
rappresentata dalla Sindrome di Wolff-Parkinson-White (WPW).
Essa è
legata all'esistenza di un fascio anomalo di conduzione, detto
Fascio di Kent, che cortocircuita la normale conduzione AV
anticipando la depolarizzazione ventricolare; tale fascio è in
grado di condurre sia in modo retrogrado che anterogrado. I soggetti
portatori di tale condizione possono, pertanto, sviluppare crisi di
tachicardia parossistica attraverso due sistemi:
- RIENTRO: la depolarizzazione ventricolare può immediatamente stimolare in modo retrogrado gli atri ed il nodo AV generando un rientro circolare;
- CONDUZIONE RAPIDA: tachicardie sopraventricolari possono essere condotte attraverso il fascio di Kent ai ventricoli con un rapporto di 1:1. In questo modo una fibrillazione atriale può degenerare in un quadro di fibrillazione ventricolare giustificando un piccolo ma reale rischio di morte improvvisa in questi pazienti (1-2/1000 pz/anno).
La
sindrome di WPW si riscontra, più spesso, in assenza di
patologie cardiache sottostanti ma può generarsi anche in
associazione a cardiopatie congenite, cardiomiopatie e sclerosi
tuberosa.
Le
tipiche manifestazioni ECG si osservano in assenza di tachicardia.
Esse sono rappresentate dall'evidenza di un accorciamento
dell'intervallo P-R e conseguente prolungamento del QRS successivo.
L'isoelettrica P-R risulta sostituita da una “morbida”
deflessione concava identificata come onda delta. Tali alterazioni
ECG derivano dalla fusione della depolarizzazione ventricolare
anomala e precoce (condotta attraverso il fascio di Kent) con quella
normalmente condotta attraverso il nodo AV.
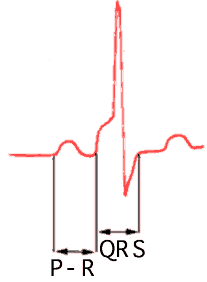
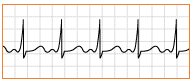
Fig.
17: Tipico aspetto ECG della WPW con accorciamento
dell'intervallo
PR, ampliamento del QRS e evidenza dell'onda delta.
Sul piano
terapeutico va ricordata che in presenza di una Sindrome di WPW non
vanno utilizzati farmaci quali la digossina o i Ca antagonisti perché
potrebbero favorire la stimolazione anterograda attraverso il fascio
di conduzione anomalo. Il farmaco di prima scelta (nella terapia di
mantenimento) in tali pazienti è, pertanto, il propanololo.
TACHICARDIE
VENTRICOLARI – a complessi QRS larghi –
Le
tachicardie ventricolari rappresentano un'evenienza rara in età
pediatrica che va posta in diagnosi differenziale con la tachicardia
sopraventricolare con conduzione intraventricolare aberrante (forme
da rientro con conduzione anterograda lungo la via accessoria).
Di fatto,
comunque, una tachicardia con QRS larghi va considerata di origine
ventricolare fino a prova contraria. Le principali caratteristiche
ECG sono:
- QRS prolungato;
- Dissociazione tra onde P e QRS in corso di tachicardia (con frequenza atriale inferiore).
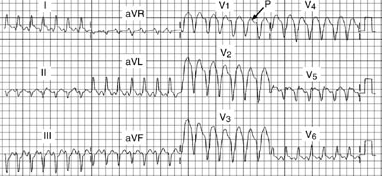
Fig
18: Tachicardia ventricolare - a QRS larghi
Purtroppo,
le cose non sono sempre così facili; infatti, è
possibile che nei bambini con tachicardia ventricolare in atto una o
entrambe le sopraccitate caratteristiche non siano evidenti.
In
presenza di una cardiopatia congenita, ad esempio, il QRS può
apparire di base allungato in corso di ritmo sinusale, in questo caso
la tachicardia ventricolare determinerà una modificazione
nella morfologia del QRS piuttosto che nella sua durata (si impone il
confronto con ECG in benessere).
La
dissociazione tra ritmo atriale e ventricolare, inoltre, può
venire meno in quelle condizioni in cui permane la capacità di
conduzione retrograda ad alta frequenza lungo il sistema di
conduzione specializzato tale per cui, in condizioni di tachicardia
ventricolare si instaura comunque un rapporto di frequenza
atrio-ventricolare di 1:1.
Le
tachicardie ventricolari possono essere associate a quadri quali le
miocarditi, la displasia aritmogena del ventricolo dx, l'origine
anomala delle coronarie, il prolasso della valvola mitrale, i tumori
cardiaci, le cardiomiopatie, la sindrome del QT lungo, la sindrome di
WPW oppure manifestarsi come esito (anche a lunga distanza) di
chirurgia intraventricolare.
Anche le
disionemie (potassio e calcio in primis), l'ipossia e la tossicità
da farmaci possono rappresentarne delle cause scatenanti come è
altresì possibile che tali aritmie si sviluppino in assenza di
condizioni patologie sottostanti.
Sul piano
terapeutico, nei pazienti con grave instabilità emodinamica
deve essere preferito un intervento di cardioversione elettrica
sincronizzata o di defibrillazione se il polso è assente.
Se il
paziente è emodinamicamente stabile il trattamento può
essere procrastinato per permettere una valutazione diagnostica più
approfondita da parte di uno specialista .
Nel caso
fosse disponibile un accesso vascolare si potrà considerare la
somministrazione di amiodarone (5 mg/kg ev in 20-60 minuti) o in
alternativa di lidocaina (1 mg/Kg ev bolo) o procainamide (15 mg/kg
ev in 30-60 minuti). L'amiodarone e la procainamide possono causare
ipotensione, soprattutto se infusi per via endovenosa e sono
controindicati in pazienti con sindrome del QT lungo.
La
fibrillazione ventricolare è certamente la tachicardia
ventricolare più temuta poiché è sostenuta dalla
depolarizzazione caotica e contemporanea di molteplici foci ectopici
ventricolari determinando una sistole assolutamente inefficace. Se
non rapidamente corretta conduce alla morte per arresto cardiaco.
L'intervento terapeutico deve essere, pertanto, tempestivo e si
avvale esclusivamente della defibrillazione elettrica; nell'attesa
è fondamentale praticare il massaggio cardiaco esterno e un
supporto di ventilazione artificiale. Qualora la defibrillazione si
dimostrasse inefficace o il quadro tendesse a recidivare, si potrà
procedere mediante infusione di amiodarone ripetendo,
successivamente, la defibrillazione.
Le
aritmie che più spesso possono degenerare in una fibrillazione
ventricolare sono la sindrome del QT lungo ed il WPW.
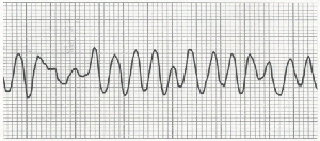
Fig.
19: Fibrillazione ventricolare con caratteristico andamento
caotico e totalmente irregolare.
LE
BRADICARDIE
La
bradicardia sintomatica nel paziente pediatrico è più
spesso da ricondurre a condizioni di ipossia o di grave instabilità
emodinamica, piuttosto che ad una origine primitivamente cardiaca.
Ipossiemia, acidosi, ipotermia, ipotensione, ed ipoglicemia possono
deprimere il normale funzionamento del nodo del seno e rallentare la
conduzione elettrica.
Un danno
delle vie elettriche di conduzione e del nodo AV può
rappresentare, talvolta, l'esito di pregressi interventi
cardiochirurgici o di ablazione con radiofrequenze. Una disfunzione
AV transitoria può rappresentare un evento comune a seguito di
interventi cardiochirurgici secondariamente ad una condizione di
edema ed emorragia posta in prossimità del sistema di
conduzione AV o infranodale. Quando, però, la disfunzione AV
permane oltre la 14^ giornata post-operatoria, essa identifica più
spesso una condizione permanente riconducibile ad infiltrazione
fibrotica o a lesione irreversibile del sistema di conduzione.
Altre
cause di bradiaritmie includono le stimolazioni vagali (intubazione,
aspirazione di muco) o alcuni disturbi del sistema nervoso centrale,
come l'ipertensione endocranica o la compressione del tronco
cerebrale.
In
particolare i blocchi AV di vario grado possono manifestarsi in corso
di patologie quali la distrofia muscolare, la distrofia miotonica, le
cardiomiopatie e alcuni quadri infettivi (febbre reumatica,
difterite, rickettsiosi, malattia di Lyme, endocarditi batteriche e
miocarditi virali).
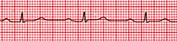
Fig
20: Blocco AV di I grado: si caratterizza per un prolungamento
fisso
dell'intervallo PR con trasmissione AV di tipo 1:1.
Blocco
AV di II grado: ne distinguiamo due forme.
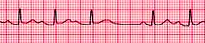
Fig
21: Mobitz I (Wenckebach) si caratterizza per un progressivo
prolungamento dell'intervallo
PR
fino a quando un impulso atriale risulta non condotto (onda P senza
successivo QRS)
per
poi riprendere il ciclo da capo.
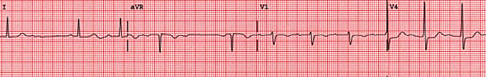
Fig
22: Mobitz II, invece, si osserva l'occasionale interruzione di
conduzione AV tale per cui una o più
onde
P risultano non seguite dal rispettivo QRS (vedi frecce) in assenza
di un precedente prolungamento
del
tratto PR. Tale interruzione di conduzione AV può manifestarsi
in forma regolare
(rapporto
fisso tra cicli normali e cicli senza QRS) oppure irregolare.
Blocco
AV di III grado: identifica una condizione di blocco AV completo
in cui, cioè, nessun impulso atriale risulta condotto ai
ventricoli la cui depolarizzazione si origina, pertanto, a partire
dalla scarica di un pacemaker ectopico distale.
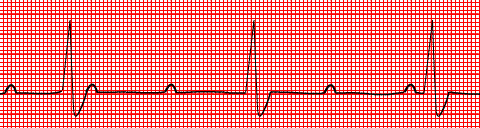
Fig
23: Blocco AV completo; le depolarizzazioni atriale e
ventricolare si sviluppano in
modo
completamente autonomo senza un rapporto fisso tra onde P e QRS.
Il blocco
AV completo riconosce due ordini di cause:
- Acquisite
Esito di
interventi cardiochirugici o di ablazione con radiofrequenze
- Congenite
Circa il
70-80% dei casi di blocco AV completo congenito è
riconducibile ad un danno immunomediato occorso al sistema di
conduzione del feto in corso di gravidanza e sostenuto dalle IgG
materne (anti-Ro e anti-La) in soggetti, per altro spesso
asintomatici, affetti da LES o meno frequentemente da AIG, Sindrome
di Sjogren o Dermatomiosite.
L'incidenza
complessiva delle forme congenite è di 1: 20-25.000 nati vivi.
Sul piano
clinico possono mantenersi a lungo asintomatici, specie se in assenza
di condizioni patologiche sottostanti e dare segno di sé solo
in condizioni in cui la gittata cardiaca diviene insufficiente
rispetto alle esigenze dell'organismo (aumentata richiesta o
diminuita disponibilità); le condizioni di diminuita
disponibilità si realizzano più frequentemente nei
bambini più piccoli (età < 6 mesi) nei quali la
gittata cardiaca è maggiormente dipendente dalla frequenza
cardiaca.
Clinicamente,
pertanto, possono esordire con un quadro di sincope (sindrome di
Morgagni-Adam-Stokes) oppure con segni e sintomi riferibili ad
una instabilità emodinamica quali: ipotensione, ritardo nel
riempimento capillare, acidosi, cianosi, obnubilazione del sensorio,
agitazione, ipossiemia.
Poiché
si è detto che nell'età pediatrica una condizione di
bradiaritmia importante è spesso da ricondurre ad una
condizione di ipossiemia, inizialmente si deve assicurare la pervietà
delle vie aeree e la ventilazione con somministrazione di O2 al 100%.
Il
trattamento farmacologico delle bradiaritmie sintomatiche si avvale
soprattutto della somministrazione di atropina ed adrenalina.
L'atropina
è il farmaco di scelta iniziale solo nelle bradicardie causate
da aumento del tono vagale (ad esempio durante intubazione o
aspirazione delle vie aeree) o da blocco cardiaco documentato. Essa
va somministrata alla dose di 0.02 mg/kg (dose minima di 0.1 mg; dose
massima di 0.5 mg nel bambino >1 aa. e di 1 mg nell'adolescente).
La dose può essere ripetuta dopo 5 minuti fino ad una dose
massima di 1 mg nel bambino > 1aa. e di 2 mg nell'adolescente. Se
non si ottiene un miglioramento immediato con la somministrazione di
atropina, bisognerà considerare il ricorso all'adrenalina,
che resta comunque il farmaco più efficace per trattare la
bradicardia associata a ipotensione. Adrenalina: 0,01 mg/Kg (max.
0,3-05 mg) ripetibile fino a tre volte ogni 15-20 min.
Se la
bradicardia persiste anche dopo adeguata ossigenazione, ventilazione
e risponde in modo transitorio all'adrenalina o atropina ed al
trattamento di eventuali cause scatenanti (es. ipotermia, ipovolemia)
potrà essere utile procedere con l'infusione continua di
adrenalina (0,1-1µg /Kg/min.) o dopamina (si inizia con
2-5µg/Kg/min. fino a 10-20 µg/Kg/min.).
Nei
pazienti fortemente sintomatici (vedi sincope di
Morgagni-Adam-Stokes) va certamente considerata l'opportunità
di procedere all'impianto di un pacemaker cardiaco.
SINDROME
DEL QT LUNGO (QTs)
Si tratta
di una condizione caratterizzata da un allungamento dell'intervallo
QT associata ad una aumentata suscettibilità di insorgenza di
una aritmia ventricolare maligna nota con il nome di Torsione di
Punta causa di eventi sincopatici, di morte improvvisa e
presumibilmente associata a quadri di SIDS.
Una
durata dell'intervallo QT > 0.47 sec. (circa 12 mm) è
fortemente indicativa di QTs. Altre alterazioni ECG suggestive della
sindrome sono:
- bradicardia;
- blocchi AV;
- morfologia anomala dell'onda T.
Sul piano
eziologico tale sindrome riconosce forme congenite e forme acquisite.
Le forme congenite sono riconducibili a cinque loci genetici ad oggi
identificati (11p15.5, 7q35, 3p21, 4q25-27, 21q22) che codificano per
proteine che concorrono alla formazione di canali ionici. Tali forme
genetiche si caratterizzano per una ampia variabilità
fenotipica e, spesso, per fenomeni di penetranza incompleta.
Le forme
acquisite, invece, sono riconducibili a disioniemie (ipokaliemia ed
ipomagnesemia) e all'azione di farmaci quali antiaritmici,
antidepressivi triciclici, eritromicina, ketoconazolo, chinidina
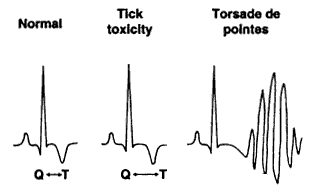
Fig
24: Sindrome del QT lungo acquisita con evidenza di allungamento
dell'intervallo
QT e possibile sviluppo di aritmia maligna.
La
torsione di punta è, di fatto, una tachicardia ventricolare
(200-250/min) sostenuta dalla scarica rapida di un focolaio ectopico
ventricolare (che prende il sopravvento) che genera dei complessi QRS
si ampiezza variabile con andamento crescente-decrescente. Tale
variabilità genera l'aspetto di una rotazione del QRS
attorno all'isoelettrica da cui il nome di torsione di punta.
Spesso si
realizzano brevi scariche di tachicardia autolimitanti responsabili
di un quadro di sincope; quando l'episodio si prolunga tende
irrimediabilmente ad evolvere verso un quadro di fibrillazione
ventricolare con possibile decesso per arresto cardiaco.
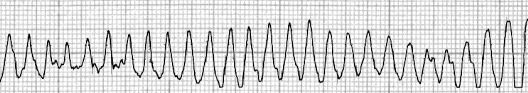
Fig.
25: Torsione di punta
La
terapia dell'episodio acuto si avvale, fondamentalmente, della
defibrillazione elettrica (risultati variabili si ottengono anche con
l'infusione in bolo ev. di o lidocaina).
Il
trattamento a lungo termine, invece, si effettua ricorrendo alla
somministrazione continua di β-bloccanti, propanololo in primis. Nei
pazienti refrattari è perentorio il ricorso all'applicazione
di defibrillatori impiantabili.
Fonti
bibliografiche:
- Behrman, Kliegman, Jenson. “Nelson- Textbook of Pediatrics” XVII ed. Saunders
- E. Cacciari, A. Cao, G.B. Cavazzuti, F. Panizon et al. “Principi e pratica di Pediatria” terza edizione, Monduzzi Editore
- D. Dubin “Rapida interpretazione dell'E.C.G” quarta ed. italiana, Ed. Marrapese Roma
- Kasper, Braunwald, Fauci, Hauser, Longo, Jameson. “Harrison's Principles of Internal Medicine” 16th Edition, Mc Graw Hill
- E. Barbi, L. Cantoni. “Prontuario Pediatrico guida alla terapia” sesta edizione, Edifarm
- Società Italiana di Emergenza e Urgenza Pediatrica, Italian Resuscitation Council – “PALS- Pediatic Advanced Life Support” – 2004
- Texter KM, Keretsz NJ, Friedmann RA. “Atrial flutter in infants” J Am Coll Cardiol. 2006 Sep 5;48(5):1040-6. Epub 2006 Aug 17.
- Lan JT, Lee JC, Wetzel G. “Postoperative arrhythmia” Curr Opin Cardiol. 2003 Mar;18(2):73-8.
- Villain E. “Cardiac syncope in children” Rev Prat. 2006 Mar 31;56(6):612-22.
- Doniger SJ, Sharieff QG. “Pediatric dysrhythmias” Pediatr Clin North Am. 2006 Feb;53(1):85-105
- Bush DM. “Evaluating cardiovascular presentations: what does an electrocardiogram have to offer?” Pediatr Ann. 2005 Nov;34(11):858-69
- Costedoat-Chalumeau N, Georgine-Lavialle S. “Anti-SSA/Ro and anti-SSB/La antibody-mediated congenital heart block” Lupus. 2005;14(9):660-4
- Chakrabarti S. Stuart AG. “Understanding cardiac arrhythmias” Arch Dis Child. 2005 Oct;90(10):1086-90.
- Lucet V. “Tachycardia in infants and children” Arch Pediatr. 2005 Apr;12(4):498-502.
- Kaltman J, Shah M. “Evaluation of the child with an arrhythmia” Pediatr Clin North Am. 2004 Dec;51(6):1537-51
- Locati ET. “QT interval duration remains a major risk factor in long QT syndrome patients”.J Am Coll Cardiol. 2006 Sep 5;48(5):1053-5. Epub 2006 Jul 7
Vuoi citare questo contributo?
