Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Febbraio 2007 - Volume X - numero 2
M&B Pagine Elettroniche
Contributi Originali - Ricerca
Le
infezioni da streptococco B in Emilia-Romagna: un problema sempre più
pediatrico
TIN,
Azienda Ospedaliera Policlinico, Modena; 1TIN, Ospedale M.
Bufalini, Cesena; 2Laboratorio di Microbiologia, Ospedale
Maggiore, Bologna; 3Pediatria, Ospedale Policlinico,
Parma; 4Laboratorio di Microbiologia, Ospedale S. Orsola,
Bologna; 5Pediatria, Ospedale Morgagni-Pieratoni, Forlì;6Agenzia Sanitaria, Regione Emilia-Romagna; 7Laboratorio
di Microbiologia, Ospedale Baggiovara, Modena; 8Pediatria,
Ospedale Montecatone, Imola; 9TIN, Ospedale Policlinico,
Parma; 10Laboratorio di Microbiologia, Ospedale Policlinico, Parma;11TIN, Ospedale S. Orsola, Bologna; 12TIN,
Ospedale S Maria Nuova, Reggio Emilia
Indirizzo
per corrispondenza: berardi.alberto@policlinico.mo.it
GROUP
B STREPTOCOCCAL INFECTIONS IN EMILIA-ROMAGNA: ISSUE OF INCREASING
PEDIATRIC RELEVANCE
Key
words
Group
B Streptococcus, Infant, Sepsis, Septic shock, Intrapartum
chemoprophylaxis
Summary
Introduction:
Group B streptococcus (GBS) is still a leading cause of neonatal
sepsis and meningitis. It can result in death or long-term
disabilities, including mental retardation and hearing or vision
loss. Even if the adoption of preventive strategies significantly
decreased the rate of early-onset infections, cases of GBS
infection continue to occur.
Methods:
We determined incidence and clinical features of disease in
Emilia-Romagna, a Northern region of Italy where GBS preventive
strategies have been implemented.
Results:
The total number of live births was 12,933. Early-onset
infections (EOD) were 30 (2 infants died), whereas late-onset
diseases (LOD) were 26 (4 infants died), with the latter
accounting for most meningitis and deaths. Risk factors were
found in 12 and 7 infants with EOD and LOD respectively. 2 women.
Twenty-one term mothers had antenatal screening: four were GBS
colonized but 17 were culture negative.
Conclusion:
The incidence of EOD found in Emilia-Romagna is one of the lowest
in Europe. Several early infections were still observed because
of negative screening results. LODs accounted for most meningitis
cases and deaths. |
|
Lo
streptococco beta emolitico di gruppo B (SGB) è un cocco Gram
positivo, comune commensale della donna gravida, principale
responsabile di severe infezioni batteriche verticali (sepsi,
meningiti, polmoniti) e infezioni sistemiche o focali nel lattante
(1). L'infezione da SGB ha distribuzione bimodale.
La forma
precoce (cosiddetta “early-onset” o EOD) si trasmette per via
verticale e si manifesta durante la prima settimana, entro le prime
12 ore di vita in circa il 90 % dei casi (2-4). E' frequentemente
associata a complicazioni ostetriche materne e può essere
prevenuta attraverso la somministrazione endovenosa di antibiotici in
travaglio (chemoprofilassi intrapartum o IAP) (5).
L'infezione
tardiva (cosiddetta “late-onset” o LOD) compare dopo la prima
settimana e la metà dei casi si trasmette per via verticale
(sviluppo di infezione tardiva dopo colonizzazione acquisita alla
nascita), nei casi rimanenti per via orizzontale (per trasmissione
nosocomiale o da portatori asintomatici). Generalmente non è
associata a complicazioni materne e dà luogo a meningiti,
sepsi o più raramente a infezioni focali. Fino ad oggi non
esiste alcuna modalità di prevenzione (1,6,7).
Il
prerequisito per la trasmissione madre-neonato dell'infezione
precoce è la colonizzazione vaginale della gravida,
particolarmente se ad alta carica (cosiddetta colonizzazione “densa”
o “heavy”); questa colonizzazione viene svelata nei comuni
terreni di coltura in agar-sangue. I terreni selettivi per lo SGB
permettono di identificare la colonizzazione “light”, cioè
a bassa carica, che interessa circa il 50 % delle gravide. In questo
secondo caso però il rischio di trasmissione è molto
minore: solo il 15% circa delle infezioni neonatali vengono trasmesse
da madri con colonizzazione light (8,9). Virtualmente, tutte le
portatrici possono essere svelate eseguendo colture ottimali (tampone
vagino-rettale coltivato sui terreni selettivi) (5). La cultura
vagino-rettale, effettuata entro 5 settimane dal parto, permette di
predire la colonizzazione al parto con una sensibilità dell'87
% ed una specificità del 96% (10).
Anche 5
condizioni ostetriche (denominate fattori di rischio) sono
strettamente associate all'infezione precoce (Tabella 1).
Tabella
1. Fattori di rischio ostetrici responsabili di infezione precoce
(modificata da Center for Disease Control and Prevention13)
*inizio
del travaglio e/o rottura delle membrane prima di 37 settimane
complete di gestazione |
L'infezione
neonatale precoce viene quasi sempre contratta per via ascendente
(non necessariamente con rottura delle membrane) all'interno del
liquido amniotico, attraverso l'aspirazione da parte del feto di
liquido contaminato. Può anche acquisirsi durante il passaggio
attraverso il canale del parto, mediante il contatto con secrezioni
vagino-anali infette. Comunque la maggioranza dei nati esposti
attraverso questa ultima via rimangono asintomatici e in seguito non
sviluppano la malattia (11).
In
assenza di profilassi l'infezione precoce colpisce da 0,76 a
5,4/1.000 nati vivi (8). L'epidemiologia dell'infezione è
ben conosciuta nelle aree di sorveglianza attiva statunitensi, dove
l'introduzione di programmi di prevenzione ha ridotto i casi da 1,8
a 0,34/1.000 nati vivi (12,13), mentre l'infezione tardiva è
rimasta sostanzialmente invariata ed attualmente si aggira intorno
allo 0,35/1.000. La mortalità, un tempo elevata, è
scesa sotto il 10 % (1).
La
profilassi intrapartum è efficace nel prevenire le infezioni
precoci, ma è costosa, non esente da rischi, non previene le
nascite pretermine ed è improbabile che diminuisca le sepsi
tardive. Vi è perciò crescente interesse allo sviluppo
di strategie basate sull'immunizzazione attiva della gravida. Due
strategie vaccinali potrebbero essere adottate: una prima, basata
sulla vaccinazione delle adolescenti o delle donne in età
fertile non gravide, più complessa perché richiede il
mantenimento di un titolo protettivo fino alla gravidanza. In
alternativa potrebbero essere vaccinate le donne già gravide,
somministrando il vaccino all'inizio del terzo trimestre, evitando
il 90 % delle infezioni precoci. Una vaccinazione durante la
gravidanza rimane però discutibile, perchè ogni outcome
sfavorevole potrebbe essere imputato al vaccino e non tutte le donne
potrebbero acconsentire alla vaccinazione se non correttamente
informate dei rischi della malattia. Sarebbe inoltre necessario
ottenere vaccini multivalenti, diretti verso i principali sierotipi
causanti infezioni in ogni diversa area geografica. In alternativa,
la ricerca più recente ha permesso la determinazione della
sequenza genomica di alcuni sierotipi. Grazie allo sviluppo di nuove
tecnologie (comprendenti screening multigenomico, proteomica, uso di
micro-sonde geniche e strumenti bioinformatici) la ricerca mira oggi
ad ovviare ai limiti connessi ai diversi sierotipi ed è
diretta verso un vaccino unico, attraverso l'identificazione di
antigeni protettivi universali (14-16).
Si hanno
poche informazioni sull'epidemiologia dell'infezione da SGB e
sulle strategie preventive in Europa e in particolare in Italia. Nei
centri dell'Emilia-Romagna si effettua la profilassi in travaglio
somministrando antibiotici alle gravide colonizzate in sede vaginale
(o vagino-rettale) o, in mancanza di dati sulla colonizzazione, a
quelle con fattori di rischio (17).
Gli
effetti dell'ampio uso di antibioticoprofilassi sono poco noti e
destano qualche preoccupazione. Le reazioni allergiche materne, con
possibili esiti sul nascituro (18) e l'aumento di resistenze
antibiotiche (19,20) sono i due maggiori rischi legati alla IAP.
Nel
nostro paese non è mai stato condotto uno studio di
popolazione, cioè uno studio dei casi rilevati in un'area
durante un determinato periodo di tempo. Abbiamo voluto valutare le
infezioni osservate negli ultimi 3 anni in Emilia-Romagna. Lo scopo
era quello di ottenere informazioni sulla loro incidenza e
caratterizzarne gli aspetti clinici.
Nel 2001
si è costituito in Emilia-Romagna un gruppo costituito da
pediatri, ostetrici ed epidemiologi, con l'obiettivo di conoscere
ed implementare le condotte di profilassi, elaborare protocolli
comuni e monitorare l'andamento dell'infezione. E' stata
utilizzata una scheda di rilevazione dei casi documentati in neonati
e lattanti con età inferiore ai 3 mesi. Tutti i bambini con
positività delle colture profonde (sangue e/o liquor) sono
stati inclusi. E' stato studiato il periodo compreso tra il 1°
Gennaio 2003 ed il 31 Dicembre 2005.
Dalla
fine del 2003 è stata allacciata anche una rete di rilevazione
tra i laboratori regionali. Sono stati indagati i metodi colturali
utilizzati dai laboratori (17) ed è stato chiesto di valutare
retrospettivamente per l'anno 2003 i casi di lattanti (età
inferiore ai 3 mesi) con colture profonde positive per lo SGB. In
seguito tutti i referenti dei reparti di terapia intensiva, pediatria
e laboratori sono stati contattati ogni 2 mesi per ottenere
informazioni sulla comparsa di nuovi casi. Il monitoraggio è
tuttora in corso. La scheda di rilevazione, somministrata ai clinici,
comprende informazioni su: fattori di rischio, colonizzazione materna
in gravidanza, parto, effettuazione della IAP, accertamenti eseguiti
nel neonato, tipologia ed epoca di esordio dei sintomi neonatali,
eventuali trattamentiantibiotici e di supporto, sensibilità
del germe agli antibiotici.
Dall'anno
2005 è iniziata una collaborazione con l'Istituto Superiore
di Sanità ed ogni ceppo di SGB isolato da colture profonde
viene tipizzato.
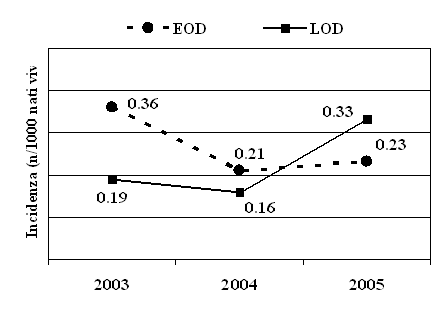
Figura
1. Incidenza dell'infezione (per 1000 nati) durante gli anni
2003-2005
Durante
gli anni 2003-2005 il numero totale dei nati in Emilia-Romagna è
stato di 112.933, ed il numero dei parti pretermine pari al 7,4 %
(informazioni ottenute dalle schede di dimissione ospedaliera
attraverso l'Agenzia Sanitaria Regionale). Tutti i centri
adottavano uno screening colturale delle gravide presso il termine di
gravidanza. L'uso dei terreni selettivi era limitato ad una
minoranza dei laboratori, ma durante il periodo studiato il numero
dei laboratori che ha adottato metodiche ottimali è aumentato
significativamente.
Abbiamo
osservato 56 casi di infezione invasiva da SGB, pari allo 0,50/1.000
nati. Le EOD sono state 30 (0,27/1.000 nati vivi), mentre le LOD 26
(0,23/1.000). L'incidenza delle infezioni è riportata nella
figura 1. L'infezione è risultata più frequente nei
nati di sesso maschile (35 su 56). Tutti i bambini tranne 7 erano di
etnia caucasica (4 africani, 3 asiatici).
Le 30
infezioni precoci hanno colpito 26 bambini a termine e 4 prematuri.
Sono state asintomatiche in 7 casi: per questi nati gli accertamenti
erano stati eseguiti a causa della mancata profilassi materna, in
presenza di colonizzazione vaginale o di fattori di rischio. In 4
casi i sintomi sono stati lievi o poco spiegabili: ittero (2 nati),
transitorio gemito (1 caso), lieve emorragia gastrica (1 caso). Non
vi era un significativo movimento dei markers laboratoristici di
infezione ed abbiamo definito questi 11 bambini come batteriemici.
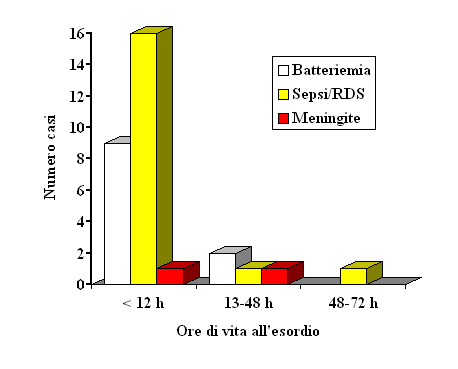
Nei restanti 19 bambini i sintomi sono stati evidenti e correlabili
all'infezione. Le manifestazioni sono comparse alla nascita in 7 su
19 nati e nella stragrande maggioranza dei casi (16 su 19) entro le
primissime ore di vita (Figura 2). L'apparato più
frequentemente coinvolto all'esordio è stato quello
respiratorio (14 casi) seguito da quello cardio-circolatorio: in 7
casi vi erano segni iniziali di shock settico, in 3 casi vi era già
insufficienza multi-organo e 2 (entrambi prematuri) sono deceduti.
Convulsioni all'esordio erano presenti in 2 bambini. In un nato a
termine l'insufficienza multiorgano alla nascita è stata
clinicamente indistinguibile dall'asfissia e solo la positività
dell'emocoltura ha permesso di chiarirne l'origine. Le meningiti,
documentate con esame colturale, sono state 2. Un bambino ha
presentato severi danni cerebrali alla dimissione (encefalomalacia
multicistica).
Figura
2. Tipologia ed epoca di esordio delle 30 infezioni precoci
Delle 26
madri che hanno partorito a termine, 21 erano state screenate prima
del parto: ben 17 (80,1%) avevano un tampone vaginale negativo, ma
soltanto in un caso le colture erano ottimali. Cinque madri (4 a
termine, 1 pretermine) avevano un tampone positivo, ma per motivi
diversi nessuna di loro è stata profilassata. Dodici su 30
donne (40 %) avevano 1 o più fattori di rischio. In totale,
solo 3 delle 30 partorienti hanno eseguito la profilassi in travaglio
(in 2 casi è stata completata). La tipologia delle infezioni e
l'età di esordio sono illustrati nella figura 2. Solo 9 su
30 bambini con EOD hanno effettuato la rachicentesi.
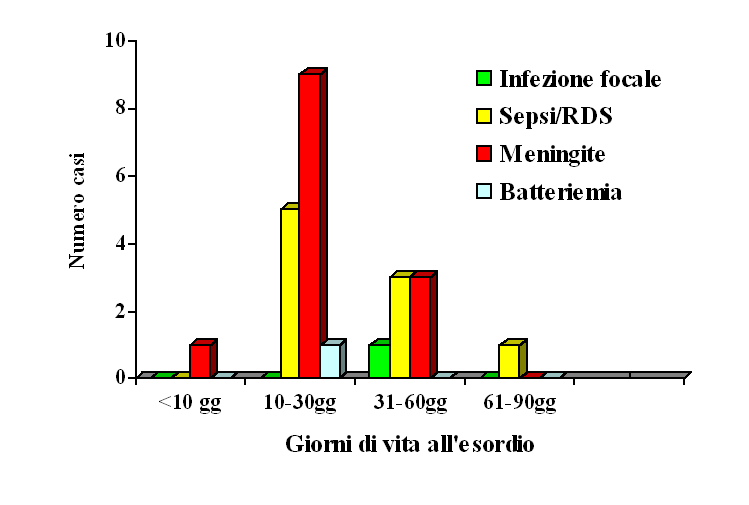
Le 26
infezioni tardive hanno colpito un maggior numero di pretermine (7 su
26 nati). Solo in 3 bambini i sintomi erano molto lievi (febbre
moderata senza altri segni). Non essendo significativo il movimento
dei markers di infezione, questi bambini sono stati considerati come
batteriemici. Nei rimanenti 23 casi le manifestazioni erano moderate
o severe. La maggior parte dei bambini (15 casi) era febbrile
all'esordio della malattia. In 11 casi vi erano segni iniziali di
shock settico, in 6 casi vi era già insufficienza
multi-organo e 4 (3 erano prematuri) sono deceduti. Convulsioni
all'esordio erano presenti in 2 bambini. Le meningiti sono state 12
(11 avevano esame colturale positivo, 1 aveva solo positività
degli antigeni batterici), ma solo 15 su 26 bambini hanno effettuato
la rachicentesi. Un solo bambino ha sviluppato infezione focale
(cellulite). Quattro bambini hanno presentato severi danni cerebrali
alla dimissione (2 casi di idrocefalo, 1 encefalomalacia
multicistica, 1 danno severo della sostanza bianca).
La
tipologia delle infezioni e l'età media di esordio sono
illustrati nella Figura 3. La maggior parte delle infezioni è
comparsa alla fine del primo mese di vita, ma diverse hanno esordito
nel secondo mese.
Figura
3. Tipologia ed epoca di esordio delle 26 infezioni tardive
Lo SGB è
la causa principale di gravi infezioni batteriche del neonato e
lattante nei primi mesi di vita. In epoche passate, in era
pre-profilassi, le infezioni precoci prevalevano sulle tardive, con
una proporzione di circa 5 ad 1 e circa il 20-30 % delle infezioni
precoci colpiva i nati pretermine (21). Queste informazioni
provengono soprattutto da studi statunitensi, perchè esistono
pochi dati europei e mancano quelli italiani ottenuti su ampie
popolazioni.
A partire
dagli anni '90, grazie alla profilassi, l'infezione precoce si è
ridotta, nelle aree di sorveglianza attiva statunitensi è
scesa fino allo 0,34 /1000 nati. L'incidenza dell'infezione
tardiva non è invece cambiata in modo sostanziale; attualmente
il rapporto tra precoci e tardive è circa 1:1 (22). I dati da
noi ottenuti mostrano alcuni aspetti importanti:
- Nella stragrande maggioranza dei nati a termine l'infezione precoce è stata trasmessa al bambino da madri con tampone falsamente negativo. I neonati pretermine colpiti sono stati pochi.
- In diversi casi le infezioni precoci sono state asintomatiche o con sintomi modesti, mentre la mortalità è stata bassa (2 soli nati) e confinata ai nati pretermine.
- Il rapporto infezioni precoci/tardive è variato durante i 3 anni dello studio (Figura 1) e nell'ultimo anno le forme tardive sono state prevalenti. Questo trend è ancora più evidente analizzando i dati dei primi 10 mesi dell'anno 2006, che non abbiamo riportato (7 infezioni precoci, 17 tardive).
- Le infezioni tardive colpiscono più prematuri delle precoci (27 % vs 13 %), sono più gravi (maggiore mortalità, maggiori esiti a distanza) e la profilassi antibiotica in travaglio o alla nascita non sembra influenzarne la comparsa. La mortalità, anche per le LODs, riguarda quasi esclusivamente i nati pretermine.
- Si manifestano quasi sempre nei primi 2 mesi di vita, con un acme a 10-30 giorni.
In anni
recenti sono segnalate sempre più di frequente infezioni nei
nati da madre con tampone falsamente negativo. Spesso si tratta di
colture materne inappropriate (tamponi vaginali o cervicali piuttosto
che vagino-rettali, uso di terreni non selettivi) (22), ma il
problema è stato osservato anche là dove le colture
sono eseguite con metodi ottimali (23,24). Una serie di fattori,
spesso incontrollabili (raccolta imperfetta del tampone, errori nelle
pratiche di trasporto o conservazione del materiale, etc.), può
alterare i risultati dello screening prenatale e dare falsa
rassicurazione in caso di tampone negativo.
Nella
nostra casistica le EODs si sono generalmente manifestate con sintomi
respiratori, spesso associati ai segni di una scarsa perfusione
cutanea e a sintomi neurologici aspecifici (ipotonia, torpore o
irritabilità). L'esordio è stato nella stragrande
maggioranza dei casi entro le prime 12 ore di vita, un tempo in cui
non sono ancora pervenuti gli esiti delle colture. La febbre, rara
nelle EODs, è invece il sintomo di esordio più
frequente delle LODs ed anche in questo caso la ridotta perfusione
cutanea è spesso presente. La meningite è molto
frequente (80 % dei casi che eseguono la rachicentesi), perciò
va esclusa con puntura lombare in tutti i bambini sospetti, anche
perché la negatività dell'emocoltura non esclude la
presenza di infezione del sistema nervoso centrale. L'esordio con
convulsioni è stato osservato solo in una minoranza di casi di
infezione precoce o tardiva (2 casi per ognuna).
L'incidenza
dell'infezione da noi osservata (totale 0,50/1000 nati; 0,27/1000
per le EODs, 0,23/1000 per le LODs) è bassa se confrontata con
altri paesi, ma è probabile vi sia una sottostima dei casi.
Infatti nel neonato l'emocoltura ha bassa sensibilità (<
40 %) (25) e la crescita del germe può essere inibita dalla
somministrazione di antibiotici in travaglio. Inoltre nella nostra
regione vi era scarsa abitudine ad eseguire colture profonde (26),
abbiamo perciò promosso nei vari centri un approccio
diagnostico più attento. E' possibile però che,
nonostante gli sforzi, le condotte non siano state uniformemente
rigorose, qualche bambino potrebbe aver ricevuto trattamenti
antibiotici prima di raccogliere le colture.
Dalla
nostra casistica si evidenzia uno spostamento dell'epoca
dell'infezione, che in era pre-profilassi colpiva soprattutto i
nati nelle prime ore di vita, spesso pretermine, mentre oggi sempre
più spesso interessa i lattanti, con forme purtroppo severe.
Le meningiti infatti sono frequenti nelle forme tardive ed hanno
purtroppo esiti neuro-sensoriali di gravità variabile in circa
la metà dei casi. La profilassi antibiotica intrapartum o la
terapia alla nascita non proteggono dall'infezione tardiva, in
quanto non necessariamente eradicano la colonizzazione del neonato
(1). La mortalità per LOD è del 2-6 % (28), ma nel
nostro studio è più elevata (13%). Si tratta in realtà
di una casistica piccola, da cui è difficile trarre precise
stime di un evento raro come il decesso. In aggiunta l'attenzione
alle infezioni è cresciuta durante tutto il periodo dello
studio. Forse l'ampio uso della profilassi materna, oltre che la
tempestività della diagnosi e della terapia delle EODs hanno
contribuito ad una più bassa mortalità per infezione
precoce.
Nel
complesso gli esiti dell'infezione sono stati pesanti (6 bambini
deceduti, 6 con lesioni cerebrali gravi alla dimissione). E'
probabile che un numero maggiore di soggetti avrà sequele a
distanza, sia come conseguenza delle infezioni del sistema nervoso
centrale (alcune delle quali probabilmente non sono state
riconosciute), sia a seguito di infezioni gravi, che hanno portato
allo shock settico.
Dato che
molte forme sono fulminanti, solo il trattamento precoce ne migliora
la prognosi. E' perciò necessaria una diagnosi tempestiva,
già alla comparsa dei segni iniziali, che spesso sono sfumati
e non specifici (torpore, irritabilità, colorito grigiastro,
apnee, difficoltà respiratoria, ittero). La tachicardia, il
tempo di ricircolo allungato ( 3“), la contrazione della
diuresi, possono essere spia di uno shock settico incipiente (29).
L'emocoltura va effettuata in tutti i neonati e lattanti che hanno
sintomi sospetti, perchè conferma l'infezione e permette di
disporre dell'antibiogramma. Anche la rachicentesi è un
esame fondamentale, infatti la meningite da SGB richiede un
trattamento antibiotico con penicillina o derivati più
prolungato (durata di almeno 14 giorni), a dosi 2-3 volte maggiori
rispetto a quelle utilizzate per la sepsi e necessita di un follow-up
clinico e neurosensoriale per diversi anni (1). Dopo aver elaborato i
nostri dati abbiamo cercato di coinvolgere i centri della regione,
ponendo come obiettivo prioritario il corretto inquadramento
diagnostico e terapeutico.
Le
infezioni da SGB sono ancora un importante problema nel neonato e
lattante. La loro prevenzione coinvolge molte figure professionali in
un percorso difficile e complesso, che va dalle ultime settimane di
gestazione ai primi mesi di vita. Nonostante la profilassi abbia
ridotto le infezioni ad esordio precoce e migliorato la loro
prognosi, le forme tardive non sono diminuite e sono tuttora spesso
gravi. L'obiettivo di una prevenzione di tutte le infezioni
invasive potrà forse essere raggiunto quando sarà
disponibile un vaccino per la donna.
1.
Edwards MS, Baker CJ. Group B Streptococcal infections. In Remington
JS, Klein JO, eds. Infectious diseases of the fetus and newborn
infant. 5th ed. Philadelphia: Saunders, 2005:1091-1156.
2.
American Academy of Pediatrics and COID/COFN: Revised guidelines for
prevention of early-onset group B streptococcal (GBS) infection.
Pediatrics 1997; 99:489-496.
3. Lin
FY, Brenner RA, Johnson YR et al. The effectiveness of risk-based
intrapartum chemoprophylaxis for the prevention of early-onset
neonatal group B streptococcal disease. Am J Obstet Gynecol
2001;184:1204-10.
4. Royal
College of Obstetricians and Gynaecologists. Guidelines N° 36.
2003, 1-10 (disponibile al sito www.rcog.org.uk).
5. Center
for Disease Control and Prevention. Prevention of perinatal group B
streptococcal disease: a public health perspective. MMWR Morb Mortal
Wkly Rep 1996;45(RR-7):1-24.
6. Law
MR, Palomaki G, Alfirevic Z et al. The prevention of neonatal group B
streptococcal disease: a report by a working group of the Medical
Screening Society. J Med Screen 2005;12:60-68.
7.
Schuchat A. Epidemiology of group B streptococcal disease in the
United States: shifting paradigms. Clin Microbiol Rev 1998;11:
497-513.
8. Benitz
WE, Gould JB, Druzin ML. Risk factors for early-onset group B
streptococcal sepsis: estimation of odds ratios by critical
literature review. Pediatrics. 1999;103:e77.
9. Benitz
WE. Perinatal treatment to prevent early onset group B streptococcal
sepsis. Semin Neonatol 2002;7:301-14.
10.
Yancey MK, Schuchat A, Brown LK et al. The accuracy of late
antenatal screening cultures in predicting genital group B
streptococcal colonization at delivery. Obstet Gynecol. 1996; 88:
811-15.
11.
Center for Disease Control and Prevention. Prevention of perinatal
group B streptococcal disease: Revised guidelines from CDC. MMWR Morb
Mortal Wkly Rep 2002; 51 (RR-11): 1-18.
12.
Schrag SJ, Zywicki S, Farley MM et al. Group B streptococcal disease
in the era of intrapartum antibiotic prophylaxis. N Eng J Med 2000,
342:15-20.
13. CDC.
Early-onset and late-onset neonatal group B streptococcal disease –
United States. MMWR 2005;54:1205-08.
14.
Maione D, Margarit I, Rinaudo CD et al. Identification of a universal
group B streptococcus vaccine by multiple genome screen. Science
2005;309:148-50.
15.
Patten S, Volman AR, Manning SD et al. Vaccination for Group B
Streptococcus during pregnancy: attitudes and concerns of women and
health care providers. Soc Sci Med 2006;63:347-58.
16. Johri
AK, Paoletti LC, Glaser P et al: Group B streptococcus: global
incidence and vaccine development. Nat Rev Microbiol. 2006;4:932-42.
17.
Berardi A, Lugli L, Rossi K. et al. GBS preventive policies in a
North Italian area. Pediatr. Res 2005;58:359 A.
18.
Berardi A, Rossi K, Cavalleri F et al. Maternal anaphylaxis and
foetal brain damage after intrapartum chemoprophylaxis. J Perinat Med
2004;32:375-77.
19. Stoll
B, Hansen N, Fanaroff AA et al.Changes in pathogens causing
early-onset sepsis in very-low-birth-weight infants. N Engl J Med.
2002;347:240-47.
20. Moore
MR, Schrag SJ, Schuchat A. Effects of intrapartum antimicrobial
prophylaxis for prevention of group-B-streptococcal disease on the
incidence and ecology of early-onset neonatal sepsis. Lancet Infect
Dis 2003;3:201-13.
21.
Berardi A, Rossi K, Bussetti C et al. La profilassi dell'infezione
neonatale da SGB. Medico e Bambino 2002;21:571-83.
22. Pinto
NM, Soskolne EI, Pearlman MD et al. Neonatal early-onset group B
streptococcal disease in the era of intrapartum chemoprophylaxis:
residual problems.J Perinatol 2003;23:265-71.
23. Share
L, Chaikin S, Pomeranets S, et al. Implementation of guidelines for
preventing early onset group B streptococcal infection. Semin
Perinatol 2001;25:107-13.
24.
Puopolo KM, Madoff LC, Eichenwald EC. Early-onset group B
streptococcal disease in the era of maternal screening. Pediatrics.
2005;115:1240-6.
25. Haque
K. Definitions of bloodstream infection in the newborn. Pediatr Crit
Care Med 2005;6:S45-49.
26.
Berardi A, Lugli L, Rossi K et al. Prevention of group B
streptococcal infection in a North-Italian area. Pediatr Infect Dis
J. 2004;23:691-2.
27.
Bedford H, de Louvois J, Halket S et al. Meningitis in infancy in
England and Wales: follow up at age 5 years. BMJ. 2001; 323:533-6.
28. Baker
CJ. Group B streptococcal infections. Clin. Perinatol. 1997;24:59-70.
29.
Berardi A, Mariotti I, Pagano R. et al. Lo shock settico in età
pediatrica. Medico e Bambino 2006;5:289-97.
Elenco
componenti del Gruppo per la Prevenzione dell'Infezione da SGB
- Albarelli A, Nido-Ostetricia, Ospedale S Maria, Borgo Taro
- Amarri S, Pediatria, Ospedale S Maria Nuova, Reggio Emilia
- Angileri V, TIN, Ospedale S Maria Nuova, Reggio Emilia
- Azzarone M, Ostreicia e Ginecologia, Ospedale Bentivoglio
- Baronciani D, Centro per la Valutazione dell'Efficacia dell'Assistenza Sanitaria, CeVEAS, Modena
- Baroncini Simona, TIP, Ospedale S Maria Nuova, Reggio Emilia
- Baroni M, Pediatria, Ospedale S Anna, Castelnuovo Monti
- Belluzzi A, TIN, Ospedale M Bufalini, Cesena
- Benaglia G, Pediatria, Ospedale Civile, Guastalla
- Benini S, Laboratorio, Ospedale S Maria delle Croci, Ravenna
- Bergomi A, Pediatria, Ospedale di Pavullo
- Bertelli M, Laboratorio di Microbiologia, Ospedale G da Saliceto, Piacenza
- Bertolani P, Pediatria, Ospedale Policlinico, Modena
- Bidetti ML, Pediatria, Ospedale Civile, Guastalla
- Biasini A, TIN, Ospedale M Bufalini, Cesena
- Biasucci G, Pediatria, Ospedale G da Saliceto, Piacenza
- Bigi E, Pediatria, Ospedale del Delta, Ferrara
- Bisonti M, Laboratorio di Microbiologia, Ospedale Civile Costa, Porretta Terme
- Bonacini G, TIN, Ospedale S Maria Nuova, Reggio Emilia
- Borghi A, Pediatria, Ospedale B Ramazzini, Carpi
- Calanca F, Laboratorio di Microbiologia, Ospedale Maggiore, Bologna
- Calisesi M, Ostetricia, Ospedale Ospedale SS. Annunziata, Cento
- Camerlo F, Pediatria, Ospedale del Delta, Ferrara
- Caponnetto A, TIN, Ospedale Infermi, Rimini
- Cattani S, TIN, Azienda Policlinico, Modena
- Cassani C, Laboratorio di Microbiologia, Ospedale Monte Catone, Imola
- Castellani F, Laboratorio di Microbiologia, Ospedali Infermi, Rimini
- Cecchini A, TIN, Ospedale Maggiore, Bologna
- Chiarabini R, Laboratorio di Microbiologia, Ospedale G da Saliceto, Piacenza
- Chierici R, TIN, Ospedale S Anna, Ferrara
- Chiossi C, Pediatria, Ospedale Civile, Sassuolo
- Ciccia M, TIN, Ospedale Maggiore, Bologna
- Cigarini A, Nido, Ospedale C Magati, Scandiano
- Cipolloni P, Laboratorio di Microbiologia, Ospedale M Bufalini, Cesena
- Cocilovo G, Pediatria, Ospedale del Delta, Ferrara
- Colla R, Laboratorio di Microbiologia, Ospedale Civile, Guastalla
- Confalonieri M, Laboratorio di Microbiologia, Ospedale G da Saliceto, Piacenza
- Contiero R, TIN, Ospedale S Anna, Ferrara
- Cornale M, Pediatria, Osp SS. Annunziata, Cento
- Corsini A, Pediatria, Ospedale Bentivoglio
- Costoli V, Laboratorio, Ospedale S Anna, Castelnuovo Monti
- Dallara F, Laboratorio di Microbiologia, Ospedale M Bufalini, Cesena
- Dall'Ara J, Laboratorio di Microbiologia, Ospedale del Delta, Ferrara
- Dalla Casa P, Pediatria, Ospedale Morgagni-Pierantoni, Forlì
- De Carlo L, Pediatria, Ospedale del Delta, Ferrara
- Della Strada M, Laboratorio, Ospedale M Bufalini, Cesena
- Di Grande E, Pediatria, Ospedale Civile, Sassuolo
- Di Pede.F, Laboratorio di Microbiologia, Ospedale Maggiore, Bologna
- Dodi I, Pediatria, Ospedale Policlinico, Parma
- Dozza A, Pediatria, Ospedale Maggiore, Bologna
- Facchinetti F, Clinica Ostetrica, Ospedale Policlinico, Modena
- Ferraroni E, Nido, Ospedale Franchini, Montecchio E
- Falcioni F, Pediatria, Ospedale Infermi, Rimini
- Galluppi E, Laboratorio di Microbiologia, Ospedale S. Orsola, Bologna
- Gambini L, TIN, Ospedale Policlinico, Parma
- Gentili A, TIP, Ospedale S. Orsola, Bologna
- Ghetti MT, Laboratorio, Ospedale Morgagni-Pierantoni, Forlì
- Guidi B, Pediatria, Ospedale di Pavullo
- Lanari M, Pediatria, Ospedale Montecatone Imola
- Lenzi L, Laboratorio di Microbiologia, Ospedale Civile Costa, Porretta Terme
- Leonardi R, Laboratorio di Microbiologia, Ospedale di Pavullo
- Loiodice A, Pediatria, Ospedale S Maria Nuova, Reggio Emilia
- Lucchi MG, Clinica Ostetrica, Ospedale Policlinico, Modena
- Fucchi MG, Clinica Ostetrica, Ospedale Policlinico, Modena
- Magnani C, Pediatria, Ospedale Maggiore Bologna
- Magnani C, TIN, Ospedale Ospedale S Maria Nuova, Reggio Emilia
- Malagutti L, Pediatria, Ospedale del Delta, Ferrara
- Mandrioli G, Pediatria, Ospedale SS. Annunziata, Cento
- Manfredini L, Pediatria, Ospedale del Delta, Ferrara
- Mantovani G, Laboratorio di Microbiologia, Ospedale S Maria Bianca Mirandola
- Mariani S, TIN, Ospedale M Bufalini, Cesena
- Mazza C, Laboratorio di Microbiologia Ospedale Bentivoglio
- Minelli P, Pediatria, Ospedale Bentivoglio
- Mirone P, Laboratorio di Microbiologia, Ospedale S. Orsola, Bologna
- Matteucci M, Laboratorio di Microbiologia, Ospedale Morgagni-Pierantoni, Forlì
- Molon Agnese, Laboratorio di Microbiologia, Ospedale B Ramazzini, Carpi
- Montini G, Laboratorio di Microbiologia, Ospedale Morgagni-Pierantoni, Forlì
- Moro ML, Agenzia Sanitaria Regione Emilia-Romagna, Bologna
- Nasi S, Laboratorio di Microbiologia, Ospedale di Vaio, Fidenza
- Palmieri R, Nido, Ospedale C Magati, Scandiano
- Paltrinieri G, Pediatria, Ospedale S Maria Bianca, Mirandola
- Papa I, TIN, Ospedale Infermi, Rimini
- Pedretti E, Pediatria, Ospedale Ospedale Civile, Fiorenzuola
- Perrone A, Pediatria, Ospedale Civile Costa, Porretta Terme
- Piccinini GF, Pediatria, Ospedale S Maria delle Croci, Ravenna
- Piccinini L, Laboratorio di Microbiologia, Ospedale Policlinico Modena
- Piepoli M, Pediatria, Ospedale G da Saliceto, Piacenza
- Pilato M Bruna, Pediatria, Ospedale di Vaio, Fidenza
- Piscina A, Laboratorio di Microbiologia, Ospedale S Maria, Borgo Taro
- Polese A, Laboratorio di Microbiologia, Ospedale S Anna, Castelnuovo Monti
- Preti P, Pediatria, Ospedale Civile Costa, Porretta Terme
- Ragni L, Cardiologia Pediatrica, Ospedale S. Orsola Bologna
- Ramilli M, Laboratorio di Microbiologia, Ospedale B Ramazzini, Carpi
- Razzaboni C, Laboratorio di Microbiologia, Ospedale SS. Annunziata, Cento
- Ricci L, Laboratorio di Microbiologia, Ospedale S Maria Nuova, Reggio Emilia
- Rigolin F, Laboratorio, Ospedale del Delta, Ferrara
- Rivalta G, Laboratorio, S.G. Persiceto
- Romeo N, TIN, Ospedale Infermi, Rimini
- Rossi G, Laboratorio di Microbiologia, Ospedale S Maria Nuova, Reggio Emilia
- Rossi MR, Laboratorio di Microbiologia, Ospedale S Anna, Ferrara
- Rossi K, TIN, Ospedale Policlinico, Modena
- Rota C, Ospedale S Maria Nuova, Reggio Emilia
- Rovinetti C, Laboratorio di Microbiologia, Ospedale Civile, Bentivoglio
- Rubbi P, Pediatria, Ospedale G da Saliceto, Piacenza
- Sabatini L, Pediatria, Ospedale S Maria delle Croci, Ravenna
- Sarti M, Laboratorio di Microbiologia, Ospedale Baggiovara, Modena
- Serra L, Pediatria, Ospedale Montecatone, Imola
- Simoni A, Pediatria, Ospedale Ospedale B Ramazzini, Carpi
- Solari E, Pediatria, Ospedale di Lugo
- Volante E, TIN, Azienda Policlinico, Parma
- Somenzi P, Laboratorio di Microbiologia, Ospedale Policlinico, Parma
- Specchia F, Pediatria, Ospedale S. Orsola Bologna
- Spisni R, Laboratorio di Microbiologia Ospedale Civile, Bentivoglio
- Sprocati M, Pediatria, Ospedale S. Anna, Ferrara
- Storchi Incerti, M, Laboratorio, Ospedale Civile, Guastalla
- Storni M, Laboratorio di Microbiologia, Ospedale S. Orsola, Bologna
- Suprani T, Pediatria, Ospedale M Bufalini, Cesena
- Testa G, Laboratorio di Microbiologia Ospedale Infermi, Rimini
- Testoni R, Pediatria, Ospedale SS. Annunziata, Cento
- Toniato M, Laboratorio di Microbiologia, Ospedale Civile Guastalla
- Tonni G, Ostetricia, Ospedale Civile, Guastalla
- Tridapalli E TIN, Ospedale S. Orsola Bologna
- Valenti A, Pediatria, Ospedale Lugo
- Vagnarelli Federica, Ospedale S Maria Nuova, Reggio Emilia
- Venturelli C, Laboratorio di Microbiologia, Ospedale Policlinico Modena
- Venturi V, Pewdiatria, Ospedale Maggiore, Bologna
- Visani M, Laboratorio di Microbiologia, Ospedale S Maria delle Croci, Ravenna
- Valenti A, Pediatria, Ospedale di Lugo
- Vecchi Vico, Pediatria, Ospedale Infermi, Rimini
- Viola L, Pediatria, Ospedale Infermi, Rimini
- Volante E, TIN, Azienda Policlinico, Parma
- Volta A, Nido, Ospedale Franchini, Montecchio
- Zardi N, Laboratorio di Microbiologia, Ospedale Civile, Fiorenzuola
- Zucchini A, Pediatria, Ospedale Civile di Faenza
Vuoi citare questo contributo?
