Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Gennaio 2007 - Volume X - numero 1
M&B Pagine Elettroniche
Appunti di Terapia
La
funzione dei toll-like receptor
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza: bartolozzi@unifi.it
Esistono
due sistemi, che contribuiscono all'immunità negli umani:
- il sistema innato (non specifico, non adattativo)
- il sistema adattativo (acquisito, specifico)
Ambedue
sono essenziali per la sopravvivenza degli individui.
Il primo
è costituito da un gran numero di cellule specializzate come i
macrofagi, i neutrofili, le cellule natural killer (NK), le cellule
dendritiche (DC), insieme a molte sostanze, come le citochine, gli
interferoni α, β e γ (INF), le chemochine, la proteina C reattiva
e le proteine che accompagnano la cascata del complemento. I
componenti del sistema innato possono essere attivati entro pochi
minuti od ore dall'inizio dell'infezione o dalla somministrazione
del vaccino. Questa risposta rapida è indispensabile per la
sopravvivenza degli individui, perché in generale ci vogliono
molti giorni affinchè i componenti del sistema adattativo
entrino in funzione.
Una volta
si pensava che il sistema innato e il sistema adattativo fossero
nettamente distinti, ma ora si pensa che essi siano intimamente
connessi e che il secondo non possa manifestarsi senza essere
attivato dal primo.
Mentre
l'induzione delle risposte adattative immuni specifiche richiede un
numero di giorni relativamente alto (7-10 giorni), l'immunità
innata fornisce difese entro pochi minuti od ore dall'inizio
dell'infezione. L'immunità innata non fornisce una
risposta specifica: essa si basa sulla digestione dei
microrganismi e degli antigeni estranei da parte dei macrofagi. Un
sofisticato sistema di recettori, i recettori toll-like
fornisce considerevole attività nei confronti dei patogeni
(un'ampia varietà di batteri, funghi, protozoi e virus) e
delle sostanze estranee.
I
toll-like recettori sono importanti per la clearance dei patogeni. A
oggi una decina di differenti molecole toll-like è stata
clonata, dimostrando una specificità generica per ampie
categorie di patogeni, che si differenziano per relativamente piccole
caratteristiche molecolari. Per esempio il toll-like 4 è
responsabile del riconoscimento dell'endotossina batterica e di
altre sostanze.
I
toll-like recettori sono espressi sulle cellule mielomonocitiche,
sulle cellule endoteliali ed epiteliali, come anche sulle cellule di
vari organi. I recettori toll-like sono proteine transmembrana che
hanno un comune dominio extracellulare, ricco di leucina e un dominio
citoplasmatico comune. La protezione immediata, fornita da questi
recettori, si basa sull'attività di molecole di ossigeno
reattivo e di azoto-intermedio, peptidi antimicrobici, citochine,
chemochine, molecole di adesione e proteine della fase acuta.
Tabella.
XXX-Ruolo dei recettori toll-like (TLR) nel riconoscimento dei
patogeni e nelle fisiopatologia delle malattie dell'uomo
(Abreu
MT e Arditi M, 2004).
|
Recettore
toll-like
|
Ligandi
|
Patogeni
o malattia
|
|
TLR1
|
Soltanto
segnali, come un dimero, quando combinati con TLR2; riconosce la
Borrelia burgdorferi OspA; richiesto per risposte adattive
immuni
Lipopeptidi
triacilici (Mycobacterium tuberculosis)
Fattori
solubili
|
Malattia
di Lyme
Neisseria
meningitidis
|
|
TLR2
|
Associato
con CD11, CD18, CD14, MD-2, TLR1, TLR6, dectina I; lipoproteine,
lipopeptidi
Peptidoglicani
dei batteri gram positivi
Acido
lipoteicoico
Lipoarabinomannano
(micobatteri)
modulino
fenolo-solubile (Staphylococcus epidermodis)
Glicoinositolfosfolipidi
(Trypanosoma cruzi)
Glicolipidi
(Treponema maltophilum)
Porina
(Neisseria)
Zymosan
(funghi)
Lipopolisaccaridi
atipici (Leptospira interrogans)
Lipopolisaccaridi
atipici (Pseudomonas gingivalis)
HSP70
Virioni
CMV
Proteina
emagglutinina del virus del morbillo selvaggio
Fimbrie
batteriche
|
M.
tuberculosis
Apoptosi
delle cellule di Schwann nella lebbra
Malattia
di Chaga
Leptospirosi
Sepsi
da funghi
Malattia
peridontale
Viremia
da CMV
Morbillo
|
|
|
RNA
a doppia elica nei virus
|
La
maggior parte dei virus
|
|
TLR4
|
Lipopolisaccaridi
da germi intestinali gram-negativi
Taxolo
delle piante
Virus
respiratorio sinciziale
Ligandine
aggiuntive: proteina 60 dell'heath shock delle clamidie
proteina
F del RSV
taxolo
(piante)
M.
tuberculosis HSP 65
Proteine
del capside
HSP
60
HSP70
Tipo
III extra dominio di fibronectina
Oligosaccaridi
dell'acido ialuronico
Frammenti
polisaccaridici di heparan solfato
Fibrinogeno
Beta-defensina
2
|
Germi
gram negativi
Chlamydia
trachomatis,
Chlamydia
pneumoniae
Alcuni
virus, come il RSV
M.
tuberculosis
Vaccino
del vaiolo
|
|
TLR5
|
Flagellina
monomerica dei batteri gram positivi
|
Batteri
flagellati, come le salmonelle
|
|
TLR6
|
Modulina
fenolo-solubile
Lipopeptidi
diacilici (micoplasma)
|
|
|
TLR7
|
Risponde
all'imidazolchinolina, un agente antivirale
Loxoribina
Bropirimina
Ligandina
esogena ed endogena sconosciuta
RNA
a elica singola
|
Può
essere utile come adiuvante nella terapia del cancro
Infezioni
virali
|
|
TLR8
|
Imidazolchinolina
RNA
a elica singola
|
Infezioni
virali
|
|
TLR9
|
DNA
batterico
|
Infezioni
virali
Infezioni
batteriche e virali
Può
essere utile come adiuvante
Herpes
simplex tipo 2
|
|
TLR10
|
Sconosciuta
|
Sconosciuto
|
Con la
scoperta e la caratterizzazione dei recettori toll-like è
divenuto evidente che la risposta immune innata è essenziale
per innescare le risposte immuni adattative.
Il
sistema immune innato può giocare un ruolo in molte malattie
umane: sebbene la principale funzione dei recettori toll-like sia
quella di riconoscere i patogeni, essi possono essere interessati
alla patogenesi della malattia, soprattutto quando la risposta innata
sia inappropriata ed eccessiva; qualcosa del genere può
contribuire alla genesi di alcune comuni malattie, come la sepsi
grave, la meningite, l'aterosclerosi, la malattia cronica
intestinale, le malattie autoimmuni, come la sclerosi multipla, il
lupus eritematoso sistemico e l'epatite.
E'
ormai evidente che i recettori toll-like hanno, come ruolo primario,
quello di riconoscere patogeni batterici, virali o fungini, che
potrebbero essere deleteri per l'organismo ospite. Ne deriva che
mutazioni a carico dei recettori toll-like contribuiscono ad
aumentare la suscettibilità per alcune infezioni o per rendere
più grave il decorso della malattia. E' stato dimostrato che
mutazioni rare dei recettori toll-like 4, contribuiscono a sviluppare
infezioni meningococciche gravi. Analogamente è stato visto
che la deficienza del recettore associato all'interleuchina 1
chinasi-4 (IRAK-4) è stata diagnosticata in 28 pazienti con
malattia invasiva, causata da batteri piogeni, principalmente lo
Streptococcus pneumoniae e, in minor misura, lo Staphylococcus
aureus.
Analogamente
la deficienza di UNV-93B sembra conferire una predisposizione
selettiva verso la meningo-encefalite, causata dal virus dell'herpes
simplex.
Figura
1. I recettori toll-like e i loro ligandi (Harrison's ,
Principles of Internal Medicine 2005, 16° ed. Pag. 1913)
Alcune
molecole, associate ai patogeni, e alcuni prodotti, originati
dall'ospite, utilizzano i membri della famiglia dei recettori
toll-like (TLR) come trasmettitori di segnali di grande importanza.
Il TLR2 riconosce una varietà di prodotti microbici; il TLR4 è
essenziale per segnalare la presenza di lipopolisaccaridi (lPS),
originati dai batteri gram negativi; fanno eccezione la Leptospira e
la Pseudomonas gengivalis, i cui polisaccaridi sono riconosciuti dal
TLR2. Il TLR4 riconosce non solo le sostanze dei virus e delle
piante, ma anche i prodotti originati dall'organismo stesso del
soggetto, come la proteina dello shock termico 60 (HSP60) e frammenti
delle fibronectina e dell'ialuronan. In confronto ai TLR2 e TLR4,
il riconoscimento da parte dei TLR5 e TLR9 sono più ristretti
e richiedono rispettivamente le segnalazioni della flagellina e del
CpG mediato dal DNA.
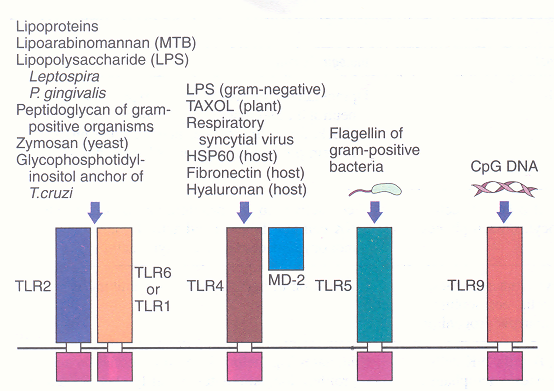
I 10
recettori toll-like (TLR) (ma soprattutto i TLR3 e TLR4) utilizzano
l'IRAK-4 come trasmettitore per l'interferon antivirale. L'IRAK-4
d'altra parte è essenziale per l'induzione precoce delle
citochine pro-infiammatorie, come il tumor necrosis factor α,
l'interleuchina-1β e l'interleuchina-6 da parte dei batteri
piogenici, attraverso il TLR1/2, TLR4, TLR5, TRL2/6 e TLR9 (vedi
Figura 2). Le citochine, la cui produzione è indotta dai TLR,
determinano l'infiammazione e tutti i fenomeni a essa connessi.
I segnali
del vari TLR reclutano i linfociti T eB del sistema dell'immunità
adattativa perché inizino la loro risposta immune umorale e
cellulare.
Quattro
TLR (TLR3, TLR7, TLR9, TLR10) richiedono l'UNC-93B per la
segnalazione.
I TLR
sono localizzati anche a livello dell'endotelio ipotalamico: essi
vengono attivati da prodotti microbici (endotossine soprattutto),
originate da germi gram negativi, e dagli acidi teicoici dei batteri
gram positivi, a produrre PGE2 e quindi la febbre.
Figura
2. Vie di segnalazione dei recettori toll-like per la produzione
delle citochine pro-infiammatorie in risposta ai prodotti batterici
(Harrison's
, Principles of Internal Medicine, 2005, 16° ed., pag.
704)
Alcune
sostanze presenti sulla superficie delle cellule microbiche
interagiscono con il CD14, che a sua volta interagisce con i
recettori toll-like (TLR); alcuni costituenti microbici non
necessitano del CD14 per interagire con i TLR: sia il CD14 che i TLR
contengono domini ricchi di leucina. Associato al TRF4 c'è
un cofattore (MD-2) che facilita la risposta ai lipopolisaccaridi. La
parte citoplasmatica dei TLR si lega con la proteina, adattarore
generale, MyD88, che si lega anche ai membri delle proteine
transmembrana, recettori dell'interleuchina-1. La proteina
adattatore, contenente il dominio TIR (TIRAP), partecipa al
trasferimento dei segnali originati dal TLR4. Si arriva così
all'attivazione delle molecole di trasferimento del segnale, come
'IRAK1/2 (recettore dell'interleuchina 1 chinasi 1- o 2), il
TRAF-6 (recettore del tumor necrosis factor associato al fattore 6),
TAK-1 (fattore β trasformante la crescita, attivante la chinasi 1),
TAB1 (proteina 1 legante TAK1). Oltre all'attivazione di altre vie
di segnalazione, che portano alla produzione di citochine e di
risposte allo stress, come la via del c-Jun N-terminal chinasi (JNK)
e la via MAP chinasi chinasi (MEKK1), i segnali mediati dal TLR
portano all'attivazione del complesso della chinasi inducibile,
IKK-α, -β e –γ. L'IKK-γ è chiamato anche NEMO (fattore
nucleare kB (NF-kB) modulatore essenziale) fa parte di un vasto
complesso che fosforilizza la porzione inibitoria (I) dell'NF-kB,
che porta alla liberazione dell'IkB da parte dell'NF-kB. L'IkB
fosforilato (PP) viene degradato e l'NF-kB traslocato al nucleo,
dove si lega ai siti di trascrizione sui geni bersaglio, la maggior
parte dei quali codifica per le proteine proinfiammatorie.
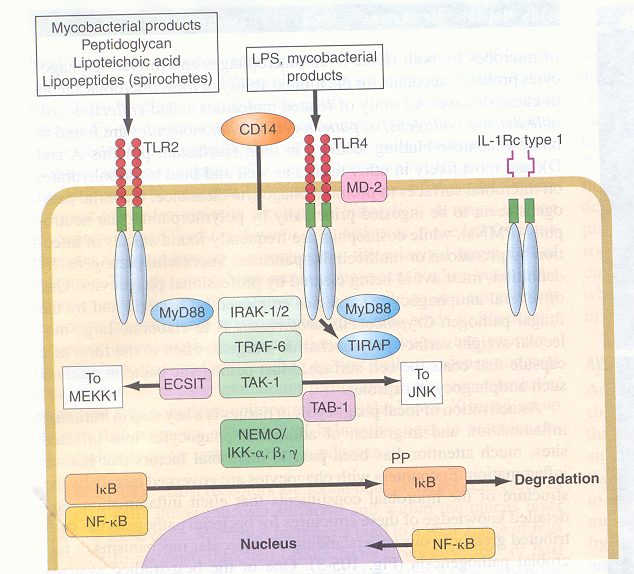
La
mancanza del TRF4 è incompatibile con la vita, perché
si associa a malattie piogeniche invasive, causate tipicamente da
batteri gram positivi, come lo Streptococcus pneumoniae e lo
Staphylococcus aureus e più di rado da batteri gram
negativi. Le infezioni iniziano nell'infanzia e nelle fanciullezza
e sono rappresentate dalla meningite, artrite e/o setticemia. Altri
aspetti tipici includono le lievi reazioni cliniche e le
infiammazioni biologiche oltre alla ritardata caduta del cordone
ombelicale. Con queste malattie sono già state descritte 18
famiglie con 28 pazienti in 11 Paesi. E' stato notato che i
soggetti con deficienza di IRAK-4 non sono particolarmente
suscettibili alle infezioni da micobatteri, da funghi e da virus. Al
contrario la mancanza di UNC-93B si associa a encefalite da herpes
virus e non a infezioni dovute a batteri.
Va
sottolineato che in questi pazienti non si riscontra nessuna
alterazione immunologica sia a carico della serie mieloide che
linfoide.
La
mancanza di IRAK-4 viene usualmente dimostrata misurando in vitro la
produzione di TNF-α o di IL-6 da parte di cellule mononucleate,
isolate dal sangue intero e stimolate con agonisti dei TLR (come i
lipopolisaccaridi), o usando la prova immuno-enzimatica (ELISA) o
infine all'interno delle cellule con la citometria di flusso.
Analogamente la mancanza di UNCB-93B viene accertata misurando la
produzione di interferon antivirale da parte delle cellule ematiche
mononucleate, stimolate con TLR agonisti.
Tutte
queste prove sono complesse, costose e richiedono molto tempo, per
cui solo pochi laboratori sono in grado di eseguirle.
Di
recente è stata descritta una prova rapida e di poco prezzo
per la dimostrazione dei difetti dei TLR, basata sulla dimostrazione
con la citometria di flusso mediante la valutazione del distacco
della L-selettina legata alla membrana (CD62L) dei granulociti (von
Bernuth H, Ku C-L, Rodriguez-Gallego C, et al. A fast precedure for
the detection of defects in toll-like receptor segnalino. Pediatrics
2006, 118:2498-503).
Con
questa nuova prova sono stati studiati 38 controlli sani e 7 pazienti
nei quali geneticamente era stata dimostrata la presenza di difetti
del recettoritoll-like: 5 pazienti con una deficienza della chinasi
4, associata al recettore dell'interleuchina 1 e 2 pazienti con
UNC-93B deficienza.
Nei
soggetti con mancanza della chinasi 4, associata ai recettori
dell'interleuchina 1, è risultato evidente un disturbo della
liberazione della L-selectina dai granulociti, in seguito alla
attivazione con agonisti dei recettori toll-like ½, 2/6, 4, 7
e 8. Tutti i controlli sani risposero invece normalmente a questa
stimolazione.
Gli
autori concludono che la valutazione della liberazione della
L-selectina, legata alla membrana dei granulociti, mediante la
citometria di flusso puà risultare utile per la dimostrazione
delle immunodeficienze primarie nella via dei recettori toll-like,
come la mancanza della chinasi 4, associata al recettore
dell'interleuchina-1 e la mancanza di UNC-93B. Confermano inoltre
che questa prova è semplice e rapida; viene consigliata
l'esecuzione di questa prova routinariamente in tutto il mondo nei
bambini con malattia pneumococcica e nei pazienti con encefalite da
herpes virus.
Considerazioni
personali
I
recettori toll-like sono un costituente essenziale della immunità
innata, che, come si sa, è comparsa, nella storia
dell'evoluzione, molto prima dell'immunità adattativa;
essa è presente, per la prima volta, negli organismi
multicellulari e rappresenta una pietra miliare nella lotta contro le
infezioni. L'immunità innata è già presente in
ogni persona alla nascita: essa blocca l'entrata dei microrganismi,
elimina quelli che riescono a passare le barriere cutanee e mucose e
costituisce un elemento indispensabile per l'attivazione e
l'istruzione dell'immunità adattativa, altamente specifica
e basata sulla comparsa di anticorpi (immunità umorale) e di
cellule (immunità cellulare).
Essa è
costituita da cellule (macrofagi, neutrofili, celllule natural
killer, cellule epiteliali delle mucose, cellule endoteliali) e da
sostanze, come le citochine, le chemochine, gli interferoni, la
poroteina C reattiva, la catena del complemento, la lecitina legante
il mannosio e altre.
L'immunità
innata è attivata da antigeni non self, da virus, da batteri,
da protozoi, da funghi e da organismi pluricellulari; essa inizia
precocemente, da pochi minuti a qualche ora dopo il contatto con
agenti estranei e si basa sulla neutralizzazione delle sostanze
estranee e degli agenti infettivi. La sua caratteristica è
quella di rimane uguale nel tempo, cioè di non aumentare
d'intensità anche dopo ripetute stimolazioni. Quando lo
stesso agente infettivo colpisce l'individuo per la seconda volta,
la risposta è uguale, pari pari a quella che si era
manifestata la prima volta. Non c'è in altre parole nessun
tipo di adattabilità in seguito a contatti successivi.
I sensori
sono rappresentati dai recettori toll-like, presenti sulla
superificie di molte cellule e dalle proteine leganti il mannosio.
I
recettori toll-like costituiscono infatti la prima linea di difesa:
se ne conoscono per ora 10, ognuno stimolato da antigeni diversi. Si
tratta di proteine transmembrana con un dominio extracellulare e un
dominio citoplasmatico.
Essi sono
i segnalatori della presenza di agenti estranei: dopo la loro
stimolazione si manifestano numerosi eventi:
- produzione di ossigeno nascente
- attivazione della cascata del complemento
- attivazione dell'interferone
- attivazione delle cellule natural killer
- produzione di citochine e di chemochine
- produzione di molecole di adesione
- produzione delle proteine della fase acuta
- produzione di peptidi di vario tipo.
Le
mutazioni dei recettori toll-like costituiscono un settore nuovo
della patologia infettiva, perchè una loro variazione
funzionale (polimorfismo) può associarsi a un'aumentata
suscettibilità verso particolari agenti infettivi, in modo
tale da rendere più facile e talvolta straordinariamente più
grave una determinata infezione.
Poter
oggi disporre di una prova relativamente semplice per identificare i
difetti funzionali dei recettori toll-like, apre una finestra nuova
del campo della patologia infettiva. E' molto probabile che poter
disporre di una prova che può essere usata facilmente in un
gran numero di condizioni, permetterà l'individuazione di
nuove affezioni e anche dei fattori di rischio in situazioni
patologiche ben conosciute. Una migliore conoscenza della
partecipazione dei toll-like recettori all'immunità
conferita dalla vaccinazione apre nuove strade di ricerca.
Dopo
l'era dell'immunità adattativa e dei relativi anticorpi,
si apre una nuova strada, quella dell'immunità innata e dei
recettori toll-like.
Vuoi citare questo contributo?
