Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Maggio 2007 - Volume X - numero 5
M&B Pagine Elettroniche
Contributi Originali - Casi contributivi
Un
caso di eritrofagocitosi secondaria a leishmaniosi nell'entroterra
friulano
Clinica
Pediatrica, IRCCS Burlo Garofolo, Trieste
*Unità
Operativa di Emato-Oncologia, IRCCS Burlo Garofolo, Trieste
**Struttura
complessa di Pediatria, A.O. Santa Maria degli Angeli, Pordenone
Indirizzo
per corrispondenza: mailto: federicominen@gmail.com
A case of secondary hemophagocytic Lymphohistiocytosis associated with leishmaniasis in a non endemic area of Italy Key
words
Hemophagocytic
lymphohistiocytosis, Leishmaniasis, Northern Italy
Summary
The
present report describes the case of a 2-year-old girl that lives
in Northern Italy suffering from a one month lasting fever,
pallor and hepatosplenomegaly. Serum testing showed pancytopenia,
high levels of immunoglobulins, hypertriglyceridemia and
hyperferritinemia. Secondary hemophagocytic lymphohistiocytosis
was suspected on the basis of case history (a holiday in Southern
Italy few months before, which is an endemic area for
leishmaniasis, unlike the region where the child lives) and on
clinical and laboratory findings. Bone marrow examination
revealed active hemophagocytosis with intra and extracellular
parasites. High levels of antibody title for leishmaniasis
confirmed the final diagnosis of hemophagocytic syndrome
associated with visceral leishmania. |
S. è
una bambina di 2 anni e mezzo residente in Friuli-Venezia Giulia che
giunge alla nostra osservazione per una storia clinica caratterizzata
da febbre intermittente con brivido (3 picchi quotidiani, temperatura
massima 40° C) ed epatosplenomegalia, esordita circa un mese
prima. Era stata iniziata terapia antibiotica empirica (ceftriaxone e
azitromicina) senza efficacia. Gli esami di laboratorio all'esordio
avevano dimostrato una citopenia (globuli bianchi 5550/µl, di
cui neutrofili 28%, linfociti 64%; Hb 10.3 g/dl, piastrine 64000/µl)
con aumento degli indici di flogosi (PCR 6 mg/dl). Nel sospetto di
una leucemia era stato eseguito un aspirato midollare, risultato
negativo. Nell'ipotesi di un'artrite idiopatica sistemica era
stato iniziato trattamento con prednisone (al dosaggio di 2 mg/kg) e
indometacina, con immediato sfebbramento. Tuttavia, dopo circa 10
giorni di benessere, è ricomparsa la febbre (in corso di
terapia) con le stesse caratteristiche.
Veniva
quindi ricoverata nel nostro reparto. La piccola era pallida e
presentava un'importante epatosplenomegalia (milza e fegato a 6-7
cm dall'arcata costale); ancora febbrile (1 picco/die a 39° C).
Gli esami all'ingresso suggerivano la possibilità di un
quadro di eritrofagocitosi (globuli bianchi 4200/µl, di cui
neutrofili 700/µl, linfociti 3200/µl; Hb: 9,1 g/dl,
piastrine 59000/µl, ferritina 1787µg/l, trigliceridi 213
mg/dl, IgG 1812 mg/dl, IgM 1326 mg/dl, PCR 6 mg/dl, VES 75 mm/h);
l'ipergammaglobulinemia (importante) associata alla splenomegalia
ci faceva considerare l'ipotesi di una leishmaniosi. A
conferma della nostra ipotesi diagnostica abbiamo eseguito l'esame
del midollo osseo, che evidenziava nel citoplasma dei macrofagi e a
livello extracellulare figure compatibili con leishmanie; vi era
inoltre riscontro di alcuni elementi monocitici (macrofagi) in
atteggiamento di eritrofagocitosi (Figura 1).
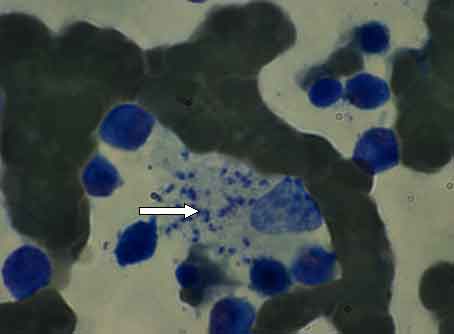
Figura
1. Istiocita in atteggiamento di eritrofagocitosi con leishmanie
al suo interno
Approfondendo
l'anamnesi, i genitori negavano viaggi in aree tropicali ma
riferivano di aver trascorso alcune settimane con la piccola in
Costiera Amalfitana durante il periodo estivo (circa 5 mesi prima).
Abbiamo eseguito il titolo anticorpale per leishmania, che è
risultato >1:160 confermando quindi la diagnosi di
eritrofagocitosi secondaria a leishmaniosi.
Si è
deciso di iniziare il trattamento con Ambisone per via
endovenosa (3 mg/kg/die), mantenendo lo steroide, via via a scalare
(da 25 mg a 12,5 mg e poi a 7,5 mg) sino a sospensione.
Il quadro
clinico è andato rapidamente migliorando, con sfebbramento in
48 ore e progressivo benessere generale (in regressione anche
l'epatosplenomegalia). Il trattamento con Anfotericina B
liposomiale è stato effettuato per 5 giorni, con due dosi
aggiuntive al 14° e 21° giorno.
A
conferma del miglioramento sono stati eseguiti un aspirato midollare
e alcuni esami bioumorali a un mese dalla dimissione, che risultavano
del tutto negativi.
Il
termine leishmaniosi indica un gruppo eterogeneo di malattie ad ampia
distribuzione, tropicale, subtropicale e mediterranea, causate
dall'infezione di un protozoo appartenente al genere Leishmania.
La leishmaniosi comprende forme cliniche a interessamento
esclusivamente cutaneo, forme muco-cutanee e forme con grave
disseminazione viscerale talvolta fatale.
Si stima
che la leishmaniosi colpisca 10-50 milioni di persone nelle regioni
endemiche tropicali e subtropicali di tutti i continenti, tranne
Australia e Antartide1 (Figura 2) L'incidenza
annuale è in costante aumento, con 1,5-2 milioni di nuovi
casi/anno, di cui 1-1,5 milioni casi di leishmaniosi cutanea, e
500.000 casi di leishmaniosi viscerale2.
In Italia
ufficialmente sono stati diagnosticati 700 casi di leishmaniosi tra
il 1994 ed il 1999 (ma molto probabilmente quelli reali sono di più),
di cui 150 in pazienti HIV positivi. La maggior parte dei soggetti
colpiti vive in aree endemiche del centro-sud3. Durante
l'anno 2000 sono stati registrati 143 casi di Leishmaniosi
viscerale umana, di cui 83 casi in Campania4; in questa
regione l'incidenza della malattia è così elevata da
giustificare la creazione di un centro di riferimento pediatrico (255
casi diagnosticati e trattati dal 1990 al marzo 2004). Alcuni autori
considerano addirittura che il macrofocus di Napoli e Caserta
sia probabilmente il responsabile del maggior numero dei casi di
Leishmaniosi infantile nell'Europa del sud5.
Le
numerose segnalazioni degli ultimi anni di casi di leishmaniosi
canina provenienti da aree tradizionalmente ritenute indenni (anche
dell'Italia settentrionale) debbono portare alla conclusione che non
esistono zone, comunemente abitate, che possano essere considerate
completamente sicure. Infatti, se fino al 1989 il Nord Italia era
considerato praticamente indenne dalla leishmaniosi canina, oggi
abbiamo dei focolai accertati in Veneto, Emilia Romagna e Piemonte e
altri probabili in Trentino e Lombardia6. In Piemonte sono
state individuate 3 differenti aree in cui la leishmaniosi canina è
endemica (Torino, Ivrea, Casale), con una sieroprevalenza che va dal
3,9% al 5,8%. È stato identificato anche un possibile focus
instabile in Valle D'Aosta: in quest'area montuosa non erano mai
stati segnalati flebotomi in precedenti stazioni di cattura.
In base
ad analogie climatiche e caratteristiche ambientali si può
anche prevedere che la diffusione della malattia si estenderà
nel prossimo futuro ad altre zone dell'Europa centrale7.
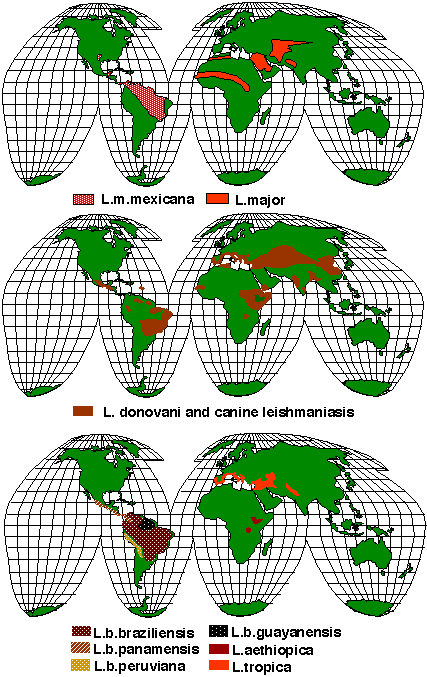
Figura
2. Distribuzione mondiale della Leishmaniosi
Le
leishmanie sono membri della famiglia delle Tripanosomatidee.
Il ciclo
biologico del parassita (Figura 3) è relativamente
semplice: le femmine dei flebotomi vettori (ematofaghe) pungono
l'ospite (serbatoio, di solito un cane); con la puntura del
flebotomo si forma un lago emo-linfatico nel derma dell'ospite, ed
il flebotomo si infetta per assunzione delle cellule del sistema
reticolo-endoteliale parassitate. All'interno del flebotomo gli
amastigoti aflagellati si attivano a promastigoti e si moltiplicano
nell'intestino medio dell'insetto acquisendo il potere
infettante; i promastigoti risalgono poi il canale digerente del
flebotomo fino alle parti buccali dove si concentrano e vengono
iniettati in un nuovo ospite, all'interno del quale i promastigoti
vengono fagocitati dai macrofagi e si trasformano in amastigoti. Gli
amastigoti si moltiplicano per divisione binaria anche all'interno
dei primi macrofagi infettati fino a distruzione di questi: i
parassiti che si liberano vengono poi fagocitati da altre cellule e
così via. I macrofagi fungono da cavallo di Troia e
trasportano i parassiti in altre sedi dell'organismo infettato, in
vari organi e tessuti del SRI8. Nelle forme antroponotiche (non
presenti in Italia), l'unico ospite recettivo è l'uomo,
per cui l'insetto trasmette il parassita da un uomo all'altro.
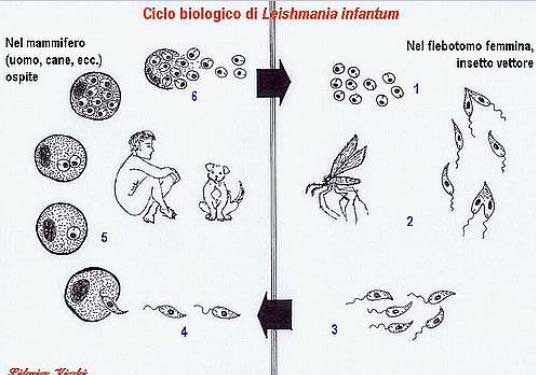
Figura
3. Ciclo biologico della Leishmania Infantum
I
flebotomi sono delle piccole zanzare di 2-4 mm di colore giallo
sabbia (sand-flies, Figura 4), con ali e corpo rivestiti di
peli; a differenza delle comuni zanzare il loro volo è del
tutto silenzioso (di qui il nome di pappatacio), le loro
punture non dolorose e sono attratti da luci deboli. Le femmine
ematofaghe di tali insetti pungono gli ospiti nelle ore
serali-notturne nel periodo compreso tra fine maggio-inizi di giugno,
fino a metà ottobre, con temperatura superiore ai 18 C°,
in assenza di vento. Nei Paesi a clima temperato sono particolarmente
favorevoli ai flebotomi vettori le colline retro-litorali specie se
alte fra i 200 ed i 600 m slm. In questa fascia
climatico-altitudinale si adattano bene anche alle periferie urbane.
In Italia
sono quattro le specie di flebotomi capaci di trasmettere L.
infantum: Phlebotomus perniciosus (il più diffuso e
dotato della maggiore capacità vettoriale), Ph. perfiliewi,
Ph. ariasi e Ph. neglectus. I primi due sono abbondantemente diffusi
in Campania nel versante Vesuviano che si affaccia sul golfo di
Napoli, nell'area Flegrea, in tutta la penisola Sorrentina e
Amalfitana, in gran parte delle province di Salerno e di Caserta e
nelle isole di Procida, Capri e Ischia.

Figura
4. Flebotomo (dal sito www.anaaweb.org/leishmania.html)
In genere
l'infezione è subclinica e asintomatica; gli individui
colpiti da leishmaniosi viscerale sono bambini al di sotto dei 2 anni
di età (nei quali il sistema immunitario è ancora
immaturo), soggetti immunodepressi (HIV positivi, organo-trapiantati)
o che comunque presentano condizioni predisponenti. L'immunità
è acquisita nel tempo dalla popolazione delle aree endemiche.
Le varie
forme di Leishmaniosi si presentano con le seguenti caratteristiche:
Leishmaniosi
cutanea localizzata (LCL, bottone d'Oriente): i bambini sono i più
colpiti. Si presenta con una o poche lesioni papulari, nodulari, a
placca o ulcerative in zone di cute esposta (volto, estremità).
Le lesioni iniziano come una piccola papula rossa nella zona di
inoculo che si estende fino a 1-3 cm per poi ulcerarsi dopo alcune
settimane, con un margine indurito ed eritematoso, al cui centro si
forma una crosta (Figura 5). Le lesioni causate da L. Major
cronicizzano e tendono poi a guarire in alcuni mesi lasciando una
cicatrice depressa, mentre quelle da L. Mexicana sono destruenti.
Quest'ultima forma è molto rara in Italia.
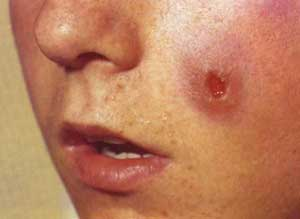
Figura
5. Leishmaniosi cutanea localizzata
Leishmaniosi
cutanea disseminata (LCD): rara, causata da L. Mexicana e L.
Aethiopica. Si manifesta con ampie macule non ulceranti, papule,
noduli, o placche che possono coinvolgere ampie zone cutanee. La
disseminazione a partire dalla sede d'inoculo impiega diversi anni.
Dal punto
di vista laboratoristico, non vi sono alterazioni di rilievo nelle
forme cutanee localizzata e disseminata.
Leishmaniosi
mucosale (LM, espundia): rara, risulta dalle metastasi ematogene che
dalle localizzazioni cutanee raggiungono la mucosa nasale o
orofaringea. Si sviluppa a distanza di anni dalla risoluzione della
lesione primaria. Si presenta con congestione nasale, rinorrea,
epistassi ricorrente; le forme interessanti l'orofaringe e la
laringe sono rare, ma nelle fasi avanzate può portare alla
distruzione di tessuti molli, cartilagine ed osso, con notevoli
deformità del naso e della bocca e restringimento della
trachea (Figura 6).
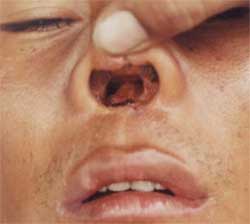
Figura
6. Erosione dei tessuti molli nella Leishmaniosi mucosale
Leishmaniosi
viscerale (LV, KalaAzar): forma sistemica di malattia causata
dalla disseminazione del parassita intracellulare attraverso il
sistema reticoloendoteliale. Interessa tipicamente bambini di età
inferiore ai 5 anni nel bacino del Mediterraneo (L. Infantum)
e nelle Americhe (L. Chagasi), bambini più grandi e
giovani adulti in Africa e Asia (L. Donovani). A seguito
dell'inoculazione si può avere un'infezione asintomatica o
pauciasintomatica (malessere, diarrea) che si risolve spontaneamente
o può evolvere in malattia sistemica.
La forma
sistemica ha una lunga incubazione, in media 4-6 mesi, e l'esordio
è caratterizzato da una febbricola accompagnata da una
progressiva anemia. La milza si ingrossa rapidamente (Figura 7)
e le analisi di laboratorio rivelano una pancitopenia, una
ipergammaglobulinemia e a volte un aumento delle transaminasi. Il
sospetto di una leucemia, con cui la malattia può essere
confusa soprattutto nei bambini, porta spesso alla diagnosi
occasionale di leishmaniosi dall'analisi dei campioni di midollo
osseo. Sovrainfezioni batteriche sono comuni nello stadio avanzato
di malattia e possono essere mortali (mortalità del 90% nei
pazienti non trattati).
In uno
studio retrospettivo italiano9 sono stati analizzati 111
casi di LV: febbre e splenomegalia erano presenti nel 100% dei casi,
l'epatomegalia nel 90,1%, trombocitopenia ed anemia nel 70,1%
mentre la leucopenia nel 42,3% dei casi. Nei pazienti
immunocompromessi la sintomatologia preponderante interessa il tratto
gastro-intestinale senza la tipica epatosplenomegalia.
Sono
stati segnalati in letteratura dei casi in cui vi è un aumento
degli autoanticorpi, verosimilmente da un attivazione policlonale dei
linfociti B (suggerito dagli alti livelli di IgG). Studi clinici
hanno dimostrato un aumento della proliferazione dei linfociti T CD4+
nei topi, con rilascio di IL-4, determinando una proliferazione
policlonale dei linfociti B10,11.
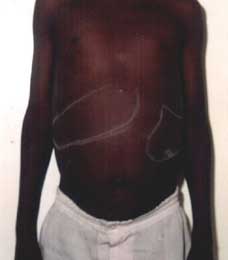
Figura
7. Epatosplenomegalia importante tipica del Kala-Azar
In alcuni
casi (come il nostro) il quadro si presenta con una eritrofagocitosi
secondaria a leishmaniosi12,13, che si caratterizza per
una proliferazione incontrollata non maligna di macrofagi e linfociti
T attivati, secondaria ad aumentata produzione citochinica.
La
linfoistocitosi emofagocitica si classifica in primaria e secondaria;
la variante secondaria può essere associata a infezioni
virali, batteriche, fungine o parassitarie (come la leishmania del
nostro caso), neoplasie, alimentazione parenterale, malattie
infiammatorie croniche (come l'artrite reumatoide)14. I
criteri utilizzati per la diagnosi di linfoistiocitosi emofagocitica
sono presenti nell'HLH-200415 (prospective international
treatment study for hemophagocytic lymphohistiocytosis, HLH) e
vengono riportati in Tabella 1: almeno 5 degli 8 criteri devono
essere soddisfatti, a meno che non sia presente una storia familiare
o una diagnosi molecolare compatibile con linfoistiocitosi
emofagocitica.
CRITERI
CLINICI |
CRITERI
DI LABORATORIO |
CRITERI
ISTOPATOLOGICI |
1-
Febbre (> 38.5° C da almeno 7 giorni)
2-
Splenomegalia (> 3 cm oltre il margine costale) |
3-
Citopenia (Hb < 9.0g/dl, PLT <100x109/l, neutrofili
<1.0x109/l)
4-
Ipertrigliceridemia (valori a digiuno >180 mg/dl) e/o
ipofibrinogenemia (<150 mg/dl)
5-
Iperferritinemia
6-
Attività cellule NK bassa/assente
7-
Elevati livelli di recettore solubile per IL-2 |
8-
Emofagocitosi nel midollo osseo, milza e linfonodi, senza evidenza
di malignità
|
Tabella
1. Criteri diagnostici per l'eritrofagocitosi.
Nei Paesi
occidentali il farmaco d'elezione è l'Amfotericina B
liposomiale16-18: si tratta di una preparazione
liposomiale di amfotericina B, che permette che il farmaco venga
immagazzinato a livello del sistema reticolo-endoteliale,
rendendo più specifica la terapia. E' l'unico farmaco
approvato dalla US Food and Drug Administration per il
trattamento della LV nei pazienti immunocompetenti.
L'Amfotericina
B nella sua preparazione non liposomiale è molto più
economica e viene quindi maggiormente utilizzata nei paesi in via di
sviluppo, ma possiede maggiori effetti collaterali tra cui rigor e
nefrotossicità19. Lo schema terapeutico è
inoltre più lungo rispetto alla preparazione liposomiale.
Lo
Stibogluconato sodico, composto antimoniale organico pentavalente, è
il farmaco di scelta nei paesi africani e del sudamerica, utilizzato
topicamente nella forma cutanea localizzata o per via sistemica nelle
altre forme. Generalmente ben tollerato se assunto per via sistemica,
risulta tuttavia potenzialmente tossico su cuore, pancreas e fegato.
Nell'ultimo periodo sono comparse molte resistenze a questo farmaco
soprattutto in India una delle nazioni dove la malattia è più
frequente.
La
Miltefosine fa parte della classe dei lisofosfolipidi alchilici
(ALPs). E' la molecola più recente, importante perché
è il primo farmaco utilizzabile per os in questa patologia.
Dagli studi di Sundar et al19,20, si evidenzia che la
Miltefosine è un farmaco sicuro nei bambini di età
superiore ai 2 anni, la cui efficacia per os è paragonabile
all'amfotericina B ev. (farmaco finora di scelta per la
leishmaniosi in paesi ad elevata resistenza allo stibogluconato di
sodio), ma con minori effetti collaterali: sono presenti a volte
vomito e diarrea lievi, moderato rialzo degli enzimi epatici senza
sintomatologia. Lo schema terapeutico per ciascuno di questi farmaci
è riportato in Tabella 2.
FARMACO |
POSOLOGIA |
Amfotericina
B liposomiale |
3
mg/kg e.v. per 5 giorni, con due ulteriori somministrazioni il 14°
e 21° giorno (dose totale: 21 mg/kg)16* |
Amfotericina
B |
0.25-1
mg/kg/die e.v. in infusione lenta a giorni alterni per un periodo
di 30-40 giorni |
Stibogluconato
di Sodio |
20
mg/kg/die (massimo 850 mg) per 28 giorni i.m. o e.v. |
Miltefosine |
2,5
mg/kg/die per 28 giorni frazionato in 3 dosi dopo i pasti |
Tabella
2. Posologia dei farmaci utilizzati nella Leishmaniosi
*Lo
studio di Di Martino et al17 ed altri successivi 18
dimostrano che un ciclo ancora più breve di trattamento (sei
infusioni al dosaggio di 3 mg/kg dal 1° al 5° giorno con
ulteriore dose al 10° giorno, per un totale di 18 mg/kg) è
altrettanto sicuro ed efficace nella terapia della LV nel bacino del
Mediterraneo.
- Behrman, Kliegman, Jenson. Nelson Textbook of Pediatrics, 16ma edizione, 2002.
- Oliva G. La leishmaniosi: una malattia in costante aumento (dal sito www.notes.provincia.napoli.it)
- Dal sito www.leishmania.org
- Baldi L, Mizzoni V, Guarino A. Canine leishmaniasis in Campania: new and old foci. Parassitologia 2004;46(1-2):217-20.
- Di Martino L, Gramoccia M, Occorsio P, Di Muccio T, Scalone A, Gradoni L. Infantile visceral leishmaniasis in the Campania region, Italy: experience from a Paediatric Referral Centre. Parassitologia 2004;46(1-2):221-3.
- Natale A. La leishmaniosi in Italia. Obiett Doc Vet 2004;12:23-8.
- Ferroglio E, Maroli M, Gastaldo S, Mignone W, Rossi L. Canine Leishmaniasis, Italy. Emerging infectious diseasaes 2005;11(10);1618-20.
- Dal sito: www.leishmania.org
- Cascio A, Colomba C, et al. Pediatric visceral leishmaniasis in western Sicily, Italy: a retrospective analysis of 111 cases. Eur J Clin Microbiol Infect Dis 2002;21:277-82
- Gagnaire MH, Galambrun C, et al. Hemophagocytic syndrome: a misleading complication of visceral leishmaniasis in children-A series of 12 cases. Pediatrics 2000;106(4): E58
- Holaday BJ, Pompeu MM, et al. Potential role for interleukin-10 in the immunosuppression associated with kala azar. J Clin Invest 1993; 92:2626-32
- Agarwal S, Narayan S, et al. Hemophagocytic syndrome associated with visceral leishmaniasis. Indian J Pediatr 2006;73:445-6
- Dash S, Awasthi A, et al. Haematological profile of childhood visceral leishmaniasis. Indian J Pathol Microbiol 2005;48:4-6
- Rabusin M, Tamaro P, Zanazzo G. Le istiocitosi dell'infanzia. Medico e Bambino 1999; 2:87-94.
- Henter JI, Horne AC et al. HLH-2004: Diagnostic and therapeutic guidelines for hemophagocytic lymphohistiocytosis. Pediatr Blood Cancer 2007;48:124-131.
- Meyerhoff A. U.S. Food and Drug Administration approval of AmBisome (liposomal amphotericin B) for treatment of visceral leishmaniasis. Clin Infect Dis 1999;28(1):42-8.
- Di Martino L, Davidson R, et al. Treatment of visceral leishmaniasis in children with liposomal amphotericin-B. J Pediatr 1997;131:271-7.
- Cascio A, di Martino L et al. A 6 day corse of liposomal amphotericin B in the treatment of infantile visceral leishmaniasis: the Italian experience. J Antimicrob Chemother 2004;54; 217-20
- Sundar S. Jha TK, et al. Oral miltefosine for Indian Visceral leishmaniasis. NEJM 2002; 347:173-46
- Sundar S. et al. Efficacy and tolerability of Miltefosine for childhood visceral leoshmaniasis in India. Pediatr Infect Dis J 2003;22:434-8
Vuoi citare questo contributo?
