Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Settembre 2007 - Volume X - numero 7
M&B Pagine Elettroniche
Contributi Originali - Casi contributivi
Ipertensione
endocranica idiopatica (pseudotumor cerebri) in una bambina in
terapia con ormone della crescita
Clinica
Pediatrica, IRCCS Burlo Garofolo, Trieste
*Servizio
di Oculistica
**
Servizio di Endocrinologia e Diabetologia Pediatrica
Indirizzo
per corrispondenza: marchetti@burlo.trieste.it
Idiopathic
intracranial hypertension (pseudotumor cerebri) in a girl
receiving growth hormone treatment
Key
words
Idiopathic
intracranial hypertension, rhGH, Acetazolamide, Corticosteroids.
Summary
We
report a case of idiopathic intracranial hypertension (IIH)
(pseudotumor cerebri) following treatment with recombinant growth
hormone (rhGH). A 9-year-old girl, treated for GH deficiency,
developed bitemporal worsening headache, diplopia, intermittent
exotropia and visual loss 3 months after starting rhGH. Ocular
fundus examination revealed bilateral papilloedema and a MRI scan
ruled out intracranial disease (including venous sinus
thrombosis), leading to diagnosis of IIH. rhGH was discontinued
and acetazolamide therapy was initiated up to 30 mg/kg/die dose
without clinical improvement and with mild metabolic acidosis. We
reduced acetazolamide to 20 mg/kg/die and added dexamethasone ev
(0,4 mg/kg/die) with dramatic answer already after 1 day, then
confirmed by fundus oculi and visual evocated potential. We
suggest the use of corticosteroids in IIH when acetazolamide is
inefficient or intolerable. |
F. è
una bambina di 9 anni con deficit di GH diagnosticato all'età
di otto anni e mezzo per importante ipoplasia dell'adenoipofisi e
ectopia della neuroipofisi evidenziata alla RMN ed in trattamento
sostitutivo con GH (6 mg/settimana). A circa tre mesi dall'inizio
del trattamento la piccola aveva iniziato a lamentarsi di cefalea
bitemporale ingravescente, con successiva comparsa di diplopia e
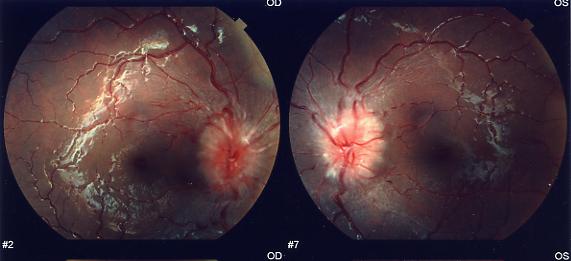
esotropia alterna, offuscamento visivo. All'esame del fondo
dell'occhio era evidente il riscontro di un papilledema bilaterale
(Figura 1)
La
valutazione neurologica evidenziava l'esotropia come unico segno di
deficit. La RMN encefalo ha escluso la presenza di masse occupanti
spazio, una dilatazione dei ventricoli, né altre lesioni
anatomiche (in particolare è stata negata una trombosi dei
seni). Nell'ipotesi di una ipertensione endocranica idiopatica
(IIH) (pseudotumor cerebri), verosimilmente indotta dalla terapia
sostituiva col GH, si è subito avviato trattamento con
acetazolamide alla dose di 20 mg/kg/die e sospesa la terapia con GH.
A distanza di 2 giorni dall'inizio della terapia non vi è
stato un chiaro miglioramento clinico, vista la persistenza della
cefalea, della diplopia e la comparsa di alcuni episodi di vomito e
di una profonda astenia, con sonnolenza. Si è deciso di
aumentare la dose di acetazolamide a 30 mg/kg/die. La risposta
clinica ottenuta è stata parziale, con modesto miglioramento
delle condizioni generali e una lieve riduzione della cefalea, mentre
persisteva un'astenia marcata. L'emogasanalisi ha evidenziato una
lieve acidosi metabolica (pH 7,33; PCO2 31,1; HCO3 16,7; BE – 7,3)
da acetazolamide.
Per
queste ragioni, è stato deciso sia di diminuire il dosaggio
dell'acetazolamide (20 mg/kg/die), sia di avviare trattamento
cortisonico endovena con desametasone al dosaggio di 0,4 mg/kg/die in
2 dosi per via endovenosa. Il giorno successivo all'inizio della
terapia steroidea vi è stato un chiaro miglioramento della
sintomatologia della bambina, con risoluzione completa della cefalea
e della diplopia, con evidenza, al controllo oculistico, del
miglioramento del papilledema. La terapia steroidea per via e.v. è
stata progressivamente scalata e dopo una settimana si è
passati al prednisone per via orale (1 mg/kg/die)
Dopo 10
giorni dalla dimissione la bambina non aveva più presentato
cefalea, astenia e si erano risolti l'esotropismo e la diplopia. La
consulenza oculistica ha mostrato un ulteriore miglioramento del
papilledema, e un miglioramento ulteriore è stato osservato
anche ai PEV. La terapia con acetazolamide e con cortisone è
stata gradualmente sospesa nell'arco di 3 settimane senza alcuna
recrudescenza della sintomatologia.
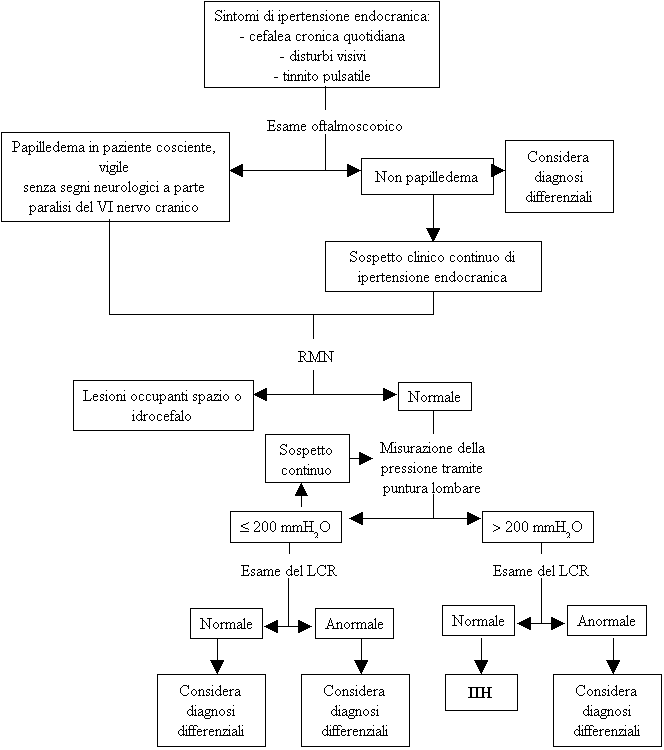
L'ipertensione
endocranica idiopatica1
(IIH) (questa terminologia si preferisce in alcune classificazioni a
quella più conosciuta di pseudotumor cerebri)2
è definita come una condizione caratterizzata da un aumento
della pressione intracranica senza evidenze cliniche,
laboratoristiche o radiologiche di patologie intracraniche (Figura
2).
Sebbene
(come indicato in Figura 2) la misurazione della pressione del liquor
cefalorachidiano (LCR) mediante puntura lombare costituisca uno dei
criteri classificativi dell'IIH tale misurazione non è
sempre attendibile, a causa delle naturali fluttuazioni della
pressione intracranica nella IIH3.
Anche se uno stato stazionario elevato è stato segnalato nel
93% dei pazienti con IIH4,
alcuni pazienti possono avere livelli bassi o normali di pressione
endocranica fra i brevi periodi di marcata ipertensione endocranica.
Un piccolo gruppo di pazienti con IIH può avere una pressione
media liquorale normale con riscontri puntuali di picchi patologici5.
Inoltre, anche se la puntura lombare viene ritenuta una procedura
fondamentalmente sicura nell'IIH diversamente da quanto avviene in
altre condizioni6,
sono comunque segnalati raramente effetti iatrogeni, in particolare
erniazione tonsillare7,8,9
(soprattutto in caso di anomalie sottostanti) e cefalea post-puntura
durale da ipotensione endocranica10.
Per questi motivi, in presenza di un forte sospetto confermato dalla
clinica e dalle immagini radiologiche, si potrebbe evitare (come è
avvenuto nel nostro caso) di procedere con la puntura lombare e
attendere una conferma di risposta dalla terapia medica e
dall'evoluzione della sintomatologia.
Il nome
stesso dell'IIH indica nella condizione di malattia idiopatica
un'eziologia sconosciuta. Negli anni, tuttavia, le segnalazioni in
letteratura di casi di IIH coincidenti con particolari condizioni
cliniche o con l'assunzione di determinati farmaci (Tabella 1)
rende la dizione di “idiopatica” come per molti aspetti
inadeguata. In pratica si tratterebbe di casi, secondari a cause
presumibili (come l'assunzione di farmaci o endocrinologiche) in
grado di aumentare la pressione liquorale (i cui limiti superiori
della norma per i bambini sono generalmente considerati fra i 180 e i
200 mmH2O11,
misurati con puntura lombare con paziente in decubito laterale o
attraverso monitoraggio della pressione intraventricolare) senza
evidenza di lesioni intracraniche documentate da tecniche di immagine
(RMN) o da specifiche condizioni cliniche e di laboratorio (ad
esempio come nel caso delle vasculiti cerebrali o tumori cerebrali o
trombosi dei seni cavernosi) che rientrano obbligatoriamente in
diagnosi differenziale. A parte l'obesità, però, non
esistono ancora evidenze convincenti di una associazione sempre
causale tra fattori esogeni ed endogeni e l'insorgenza dell'IIH.
I fattori esogeni ed endogeni non sarebbero in grado di causare da
soli quadri di ipertensione endocranica in tutti i pazienti, ma vanno
a sollecitare sistemi predisposti o mal funzionanti (probabilmente
per una suscettibilità genetica di base12),
fungendo così solo da fattori scatenanti o iniziali e non da
cause vere e proprie: in tal senso il termine idiopatico, sebbene non
nel pieno della sua accezione etimologica, ci sembra essere ancora
quello valido per entrambi i gruppi.
Fra i
vari fattori esogeni indicati come possibili cause di IIH viene anche
riportato l'ormone della crescita (GH), con segnalazioni sempre più
frequenti in letteratura13,14,15,16,17,18,19,20,21,22.
I primi casi riportati risalgono al 1986, in coincidenza con un
maggiore e più frequente utilizzo di GH seguito
all'introduzione di rhGH (umano ricombinante) a partire dal 1985.
Come per
tutti gli altri farmaci chiamati in causa come primum movens
dell'IIH, il miglioramento che si ha in seguito alla sospensione
dell'rhGH (e in alcuni casi la ricomparsa di segni e sintomi alla
ripresa) ha portato a postularne il nesso causale, ma questo rimane
non provato. Esistono, al contrario, casi in cui vi è evidenza
della ripresa di segni e sintomi alla risomministrazione di rhGH così
come vi sono casi in cui l'IIH si risolve nonostante la
continuazione della terapia con rhGH e tuttavia ciò non
preclude che questa sia l'evento iniziale dello sviluppo dell'IIH,
poiché la risoluzione potrebbe essere dovuta ad aggiustamenti
omeostatici (risposta di compenso). A supportare il nesso causale tra
l'uso del rhGH e l'insorgenza dell' IIH, vi è una
frequente correlazione temporale tra l'inizio della terapia e
l'IIH, solitamente entro i primi 3 mesi (così come nel caso
clinico da noi descritto).
Sebbene
la patogenesi dell'IIH non sia nota, è verosimile che
coinvolga – fra gli altri – l'aumentata produzione di LCR, un
diminuito drenaggio o entrambi23.
Quanto all'azione dell'rhGH si pensa che le sue proprietà
di ritenzione dei liquidi possano appunto contribuire all'espansione
del volume del LCR e/o che il rhGH, una volta attraversata la
barriera ematoencefalica, possa agire incrementando l'IGF-I locale,
che aumenterebbe a sua volta la produzione di LCR dai plessi
corioidei.
Alte dosi
di GH sembrano essere un fattore di rischio comune, ma il modo in cui
la terapia viene iniziata sembra essere ancora più importante
della dose finale. È possibile che un inizio cauto, dalla dose
minima raccomandata progredendo per piccoli aumenti, possa eliminare
o quantomeno ridurre il rischio di IIH nei bambini con deficit di GH,
anche se la dose finale è relativamente alta.
L'incidenza
dei casi di IIH correlati a terapia con rhGH è sconosciuta,
essendo comunque l'IIH di per sé una condizione rara
nell'infanzia. Secondo il database australiano-neozelandese,
l'incidenza dell'IIH nei bambini trattati con GH sembrerebbe
attestarsi sui 1.2 casi ogni 1000, sebbene si ritenga verosimile un
difetto di stima. Il gruppo affetto più frequentemente è
quello con deficit di GH con 6.5 casi ogni 1000, mentre le pazienti
con sindrome di Turner hanno un'incidenza di 2.3/1000.
L'associazione tra terapia con rhGH e IIH non è quindi
limitata ai pazienti con deficit di GH, ma tutti i pazienti che
vengono trattati per altre indicazioni con GH (insufficienza renale
cronica, sindrome di Turner, sindrome di Prader Willi, etc.) sono a
rischio di tale complicanza. Inoltre sono stati riportati casi di IIH
in pazienti con resistenza al GH trattati con IGF-1, il mediatore
primario delle azioni del GH.
Non sono
disponibili raccomandazioni evidence-based per la gestione
terapeutica dell'IIH, sia perché non esistono studi
randomizzati, controllati, in doppio cieco prospettici sul
trattamento, sia perché non si conosce la storia naturale
della condizione non trattata e sia perché non è ancora
stata compresa a pieno la fisiopatologia che ne è alla base.
Di conseguenza, attualmente è difficile fornire
raccomandazioni sul miglior trattamento per l'IIH. Le varie
modalità di trattamento usate in età pediatrica
prevedono l'uso dei corticosteroidi, dell'acetazolamide, della
furosemide, ripetute punture lombari (per ridurre la pressione
liquorale); sebbene la maggior parte dei casi rispondano ad un
trattamento farmacologico, in rari e selezionati casi la chirurgia
deve essere valutata.
L'acetazolamide
(inibitore dell'anidrasi carbonica) viene universalmente indicato
come il farmaco di prima scelta nel trattamento dell'IIH, e agisce
probabilmente riducendo la produzione di LCR e conseguentemente la
pressione intracranica24;
la dose di partenza suggerita è di 20 mg/kg/die in 3
somministrazioni con possibile graduale incremento fino ad un massimo
di 100 mg/kg/die in 3 somministrazioni (dose massima 750 mg/die al di
sotto dei 12 anni e 1 g/die oltre questa età)25.
In alcuni casi, però, i pazienti non rispondono al
trattamento, oppure per la comparsa di effetti collaterali (come nel
caso riportato) si devono utilizzare dosi inferiori. Gli effetti
collaterali sono solitamente dose-dipendenti e includono disturbi
gastrointestinali, acroparestesie, perdita dell'appetito, acidosi e
squilibri elettrolitici e raramente nefrocalcinosi. La maggior parte
degli effetti indesiderati, delle controindicazioni e delle
interazioni con altri farmaci sono proprio conseguenti
all'alcalinizzazione dell'urina o all'acidosi metabolica
causati dal farmaco26.
Nei casi
che non rispondono all'acetazolamide o con effetti collaterali, il
trattamento suggerito (solitamente in aggiunta) è quello con
corticosteroidi orali (prednisone) al dosaggio di 1 mg/kg, così
come nei casi particolarmente acuti e severi viene indicato il
desametasone27
o il metilprednisolone ad alte dosi28
per via endovenosa, per un periodo di 2–6 settimane (la diminuzione
dei sintomi e la risoluzione di papilledema avviene solitamente nelle
prime due settimane di trattamento)29,30.
Se è vero che l'acetazolamide è riconosciuta da tutti
come trattamento di prima scelta, è altrettanto vero che
esiste un timore forse eccessivo nell'utilizzo degli steroidi:
questa paura deriva dal fatto che i cortisonici possono essere
responsabili dell'IIH (sai alla sospensione della terapia31
che durante il trattamento32).
Anche a causa dei numerosi effetti collaterali, fra cui soprattutto
un indesiderato aumento di peso, il trattamento steroideo viene da
alcuni Autori sconsigliato, ma pur a fronte di una efficacia provata
sebbene soltanto da analisi cliniche retrospettive27,33,34.
Nel caso da noi riportato il trattamento con steroide è stato
fondamentale per favorire una rapida regressione della sintomatologia
clinica molto invalidante e del papilledema, con normalizzazione dei
PEV. Lo steroide va preso pertanto sempre in considerazione nei casi
di IIH che non rispondono rapidamente al trattamento con
acetazolamide, anche in considerazione del rischio di disfunzioni
visive permanenti o addirittura di cecità bilaterale che
possono verificarsi in percentuali riportate rispettivamente intorno
al 10-25%35
e al 4%36
dei casi di IIH.
Fattori
esogeni |
Fattori
endogeni |
Tetracicline
Nitrofurantoina
Acido
Nalidixico
Sulfametossazolo
Penicillina
Trattamento
steroideo e sospensione
FANS
nella sindrome di Bartter
Mesalamina
Carbonato
di litio
Amiodarone
Ciclosporina
Vitamina
A
rhGH
e IGF-1 |
Endocrinologici
Obesità
Mestruazioni
irregolari
Gravidanza
Contraccettivi
orali
Sindrome
di Turner
Insufficienza
surrenalica
Ipertiroidismo
Ipotiroidismo
Iperaldosteronismo
Ematologici
Anemia
Ipercoagubilità |
(da
voce bibliografica 2, modificata)
Bibliografia
1 The
International Classification of Headache Disorders, 2nd edition.
Cephalalgia 2004; 24 (Suppl. 1):9–160
2 Skau
M, Brennum J, Gjerris F, Jensen R. What is new about idiopathic
intracranial hypertension? An updated review of mechanism and
treatment. Cephalalgia 2006;26(4):384-99.
3 Johnston
I, Paterson A. Benign intracranial hypertension. II. CSF pressure
and circulation. Brain 1974; 97:301–12.
4
Gjerris F, Soelberg Sorensen P, Vorstrup S, Paulson OB. Intracranial
pressure, conductance to cerebrospinal fluid outflow, and cerebral
blood flow in patients with benign intracranial hypertension
(pseudotumor cerebri). Ann Neurol 1985; 17:158–62.
5 Torbey
MT, Geocadin RG, Razumovsky AY, Rigamonti D, Williams MA. Utility of
CSF pressure monitoring to identify idiopathic intracranial
hypertension without papilledema in patients with chronic daily
headache. Cephalalgia 2004; 24:495–502.
6 Salman
M. Why does tonsillar herniation not occur in idiopathic
intracranial hypertension? Med Hypotheses. 1999 Oct;53(4):270-1.
7 Durcan
FJ, Corbett JJ, Wall M. The incidence of pseudotumor cerebri.
Population studies in Iowa and Louisiana. Arch Neurol
1988;45(8):875-7.
8 Paruchuri
SR, Lawlor M, Kleinhomer K, Mason L, Johnson C. Risk of cerebellar
tonsillar herniation after diagnostic lumbar puncture in pseudotumor
cerebri. Anesth Analg. 1993 Aug;77(2):403-4.
9 Sullivan HC. Fatal tonsillar herniation in
pseudotumor cerebri. Neurology. 1991; 41(7):1142-4.
10 Nafiu OO, Monterosso D, Walton SR, Bradin S.
Post dural puncture headache in a pediatric patient with idiopathic
intracranial hypertension. Paediatr Anaesth 2005;15(9):778-81.
11 Friedman DI, Jacobson DM. Idiopathic
intracranial hypertension. J Neuroophthalmol 2004;24(2):138-45.
12 Gardner K, Cox T, Digre KB. Idiopathic
intracranial hypertension associated with tetracycline use in
fraternal twins: case reports and review. Neurology 1995;45(1):6-10.
13 Otten B J, Rottevel JJ, Cruysberg JRM. Pseudotumor
cerebri following treatment with growth hormone. Horm Res
1992;37:16.
14 Malozowski S, Tanner LA, Wysowski D, Fleming GA.
Growth hormone, insulin-like growth factor I, and benign
intracranial hypertension. N Engl J Med 1993;329:665-6.
15 Lordereau-Richard I, Roger M, Chaussain JL. Transient
bilateral papilloedema in a 10-year-old boy treated with recombinant
insulin-like growth factor I for growth hormone receptor deficiency.
Acta Paediatr Suppl 1994;399:152.
16Malozowski S, Tanner LA, Wysowski DK, Fleming GA,
Stadel BV. Benign intracranial hypertension in children with growth
hormone deficiency treated with growth hormone. J Pediatr
1995;126(6):996–9.
17 Koller EA, Stadel BV, Malozowski SN. Papilledema in 15
renally compromised patients treated with growth hormone. Pediatr
Nephrol 1997;11(4):451–4.
18 Francois
I, Casteels I, Silberstein J, Casaer P, de Zegher F. Empty sella,
growth hormone deficiency and pseudotumour cerebri: effect of
initiation, withdrawal and resumption of growth hormone therapy. Eur
J Pediatr 1997;156(1):69–70.
19 Crock
PA, McKenzie JD, Nicoll AM, Howard NJ, Cutfield W, Shield L, Byrne
G. Benign intracranial hypertension and recombinant growth hormone
therapy in Australia and New Zealand. Acta Paediatr 1998;
87(4):381–6.
20 Rogers
AH, Rogers GL, Bremer DL, McGregor ML. Pseudotumor cerebri in
children receiving recombinant human growth hormone. Ophthalmology.
1999; 106(6):1186-9; discussion 1189-90.
21 Clayton
PE, Cowell CT. Safety issues in children and adolescents during
growth hormone therapy—a review. Growth Horm IGF Res
2000;10:306–17.
22 Vischi
A, Guerriero S, Giancipoli G, Lorusso V, Sborgia G. Delayed onset of
pseudotumor cerebri syndrome 7 years after starting human
recombinant growth hormone treatment. Eur J Ophthalmol.
2006;16(1):178-80.
23 Radhakrishnan
K, Ahlskog JE, Garrity JA, Kurland LT. Idiopathic intracranial
hypertension. Mayo Clin Proc 1994;69:169-80.
24 Tomsak
RL, Niffenegger AS, Remler BF. Treatment of pseudotumour cerebri
with Diamox (acetazolamide). J Clin Neuroophthalmol 1988;8:93–8.
25 Ministero
della Salute. Guida all'uso dei farmaci per i bambini. Istituto
Poligrafico e Zecca dello Stato, Roma 2003.
26 Hardman
JG, Limbird LE. Goodman & Gilman. Le basi farmacologiche della
terapia, X edizione italiana. McGraw-Hill, 2003; 728.
27 Cinciripini
GS, Donahue S, Borchert MS. Idiopathic intracranial hypertension in
prepubertal pediatric patients: characteristics, treatment, and
outcome. Am J Ophthalmol. 1999;127(2):178-82.
28 Liu
GT, Glaser JS, Schatz NJ. High-dose methylprednisolone and
acetazolamide for visual loss in pseudotumor cerebri.Am J
Ophthalmol. 1994 Jul 15;118(1):88-96.
29 Weisberg
LA. Benign intracranial hypertension. Medicine (Baltimore) 1975;
54:197–207.
30 Ahlskog
JE, O'Neill BP. Pseudotumor cerebri. Ann Intern Med 1982;
97(2):249–56.
31 Neville
BG, Wilson J. Benign intracranial hypertension following
corticosteroid withdrawal in childhood. BMJ 1970; 3:554–6.
32 Newton
M, Cooper BT. Benign intracranial hypertension during prednisolone
treatment for inflammatory bowel disease. Gut 1994; 35:423–5.
33 Soler
D, Cox T, Bullock P, Calver DM, Robinson RO. Diagnosis and
management of benign intracranial hypertension. Arch Dis Child.
1998;78(1):89-94.
34 Salman
MS, Kirkham FJ, MacGregor DL. Idiopathic "benign"
intracranial hypertension: case series and review. J Child Neurol.
2001;16(7):465-70.
35 Digre
KB. Not so benign intracranial hypertension. BMJ. 2003
22;326(7390):613-4.
36 Wall
M, George D. Idiopathic intracranial hypertension. A prospective
study of 50 patients. Brain. 1991;114(Pt1A):155-80.
Vuoi citare questo contributo?
