Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Aprile 2024 - Volume XXVII - numero 4
M&B Pagine Elettroniche
Il punto su
Chikungunya e Dengue: tutta colpa di una zanzara
Epidemiologia, clinica e prevenzione vaccinale
1AC Pediatria, Ospedale “Bambino Gesù”, Università “Tor Vergata”, Roma
2Unità Operativa Materno Infantile, ASL Benevento
Indirizzo per corrispondenza: alberto.villani@opbg.net
Chikungunya and Dengue: it is all the fault of a mosquito. Their epidemiology, treatment and vaccination prevention
Key words: Arbovirus, Zoonosis, Vaccination prophylaxis
Abstract
Arboviruses are zoonoses caused by viruses transmitted by many arthropod vectors, included mosquitoes. In Italy, Arboviruses can cause both imported and native infections, with different clinical manifestations. Therefore, they should always be considered in the differential diagnosis in case of both history of foreign travels and disease diffusion within the national territory. Among the strategies against Arbovirosis, communication and training should be kept in mind, in order to implement environmental and vaccination prophylaxis.
Riassunto
Le arbovirosi sono zoonosi causate da virus trasmessi da vettori artropodi, come ad esempio la zanzara. Dal momento che anche nel nostro Paese possono essere causa di infezioni, sia importate sia autoctone, con diverse manifestazioni cliniche, le arbovirosi devono essere sempre prese in considerazione nella diagnostica differenziale in caso di storia di viaggio all’estero o in presenza di nota diffusione sul territorio nazionale. Tra le principali strategie di contrasto alle arbovirosi non bisogna assolutamente sottovalutare il valore della comunicazione del rischio e della stessa formazione, finalizzati a garantire la messa in atto delle valide misure di profilassi ambientale e vaccinale.
Introduzione
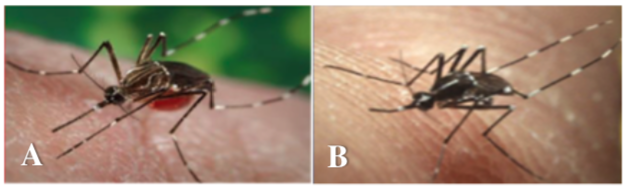
Chikungunya, Dengue e febbre gialla sono malattie virali trasmesse dalla puntura delle zanzare appartenenti al genere Aedes, che comprendono Aedes aegypti (nota anche come zanzara della febbre gialla) e Aedes albopictus (più conosciuta come zanzara tigre) (Figura 1A e 1B, rispettivamente).
Le malattie trasmesse da vettori (es. zanzare e zecche) costituiscono un importante problema di Sanità pubblica con una stima dell’Organizzazione Mondiale della Sanità (OMS) che riporta annualmente oltre 1 miliardo di casi e più di 700.000 decessi, rappresentando circa il 17% dei casi totali di malattie trasmissibili1.
Con il cambiamento climatico e altri cambiamenti demografici, le zanzare Aedes vettrici dei virus si stanno espandendo in nuove aree geografiche2.
Nel nostro Paese la sorveglianza epidemiologica dei casi di Chikungunya e Dengue risulta essere regolata dal “Piano Nazionale di prevenzione, sorveglianza e risposta alle Arbovirosi (PNA) 2020-2025”3 (sottoscritta dalla Conferenza Stato, Regioni e Province autonome il 15 gennaio 2020), con emissione periodica di specifici bollettini, dall’ultimo dei quali emerge che nel periodo da gennaio a dicembre 2023 risultano essere stati segnalati: 7 casi confermati di Chikungunya (tutti associati a viaggi all’estero, età mediana di 42 anni, 71% di sesso maschile, nessun decesso) e 362 casi confermati di Dengue (82 casi autoctoni e 280 casi associati a viaggi all’estero, età mediana di 37 anni, 52% di sesso maschile e 1 decesso)4.
Chikungunya
Caratteristiche cliniche
Dopo un periodo di incubazione di 2-12 giorni, la malattia si manifesta in maniera improvvisa con febbre e artralgie tali da limitare i movimenti dei pazienti (da cui deriva il nome Chikungunya, che in lingua swahili significa “ciò che curva” o “contorce”) tendendoli a farli rimanere assolutamente immobili e assumere posizioni antalgiche. Altri sintomi possono includere dolore muscolari, cefalee, affaticamento e rash cutaneo. Il dolore alle articolazioni è spesso debilitante, generalmente dura alcuni giorni ma può anche prolungarsi per alcune settimane. Nella maggior parte dei casi i pazienti si riprendono completamente, tuttavia in alcuni casi il dolore alle articolazioni può persistere per mesi o anche anni. Spesso i sintomi delle persone infette sono lievi e l’infezione può non essere riconosciuta o male interpretata, soprattutto nelle aree in cui è presente anche la Dengue.
Occasionalmente sono state segnalate complicanze oculari, neurologiche, cardiache e gastrointestinali. Raramente si verificano complicanze gravi, tuttavia negli anziani la malattia può essere una concausa di decesso.
Epidemiologia
La malattia è stata identificata per la prima volta in Tanzania nel 1952, diffondendosi poi tra il 2004 e il 2007 dal Kenya e attraverso l'Oceano Indiano a più di 60 paesi, colpendo 1,5 milioni di persone. Successivamente si è diffusa in Europa e nelle Americhe portata da viaggiatori viremici5.
Esistono quattro genotipi del virus Chikungunya: West African, East-Central-South Africa (ECSA), ECSA-diverged o Indian Ocean Lineage (IOL) e Asian. Indagini di sieroprevalenza da 44 studi, testando 51.599 individui provenienti da 29 paesi, hanno riportato un dato complessivo pari al 25% (IC 95%: 22–29). Tra tutte le regioni dell’OMS, il maggiore tasso di sieroprevalenza conseguente ad infezione da Chikungunya risulta essere presente nelle Regioni del Sud-Est asiatico (42%, IC 95%: 17-67); al contrario, la regione del Mediterraneo orientale risulterebbe avere il tasso di infezione più basso (2%, IC 95%: 0–5). Tra le regioni testate, i primi cinque Paesi/Aree con i tassi di infezione più elevati risultano essere Camerun (68%, IC 95%: 25–100), Comore (63%, IC 95%: 58–68), Haiti (58%, 95% IC: 56–59), Tailandia (49%, IC 95%: 6–92) e Indonesia (39%, IC 95%: 32–45). Al contrario, Turchia (0%), Gabon (1%), Iraq e Croazia (entrambi 1%) sono stati classificati come i Paesi con i tassi di infezione più bassi6.
Nel nostro Paese, coloro che ritenevano il virus Chikungunya causa di una malattia appartenente a una specifica area “tropicale” si sono dovuti ricredere quando, nel periodo tra il 4 luglio e il 27 settembre 2007, sono stati registrati 205 casi in due piccoli Comuni contigui dell'Italia nord-orientale, caratterizzati da una manifestazione clinica abbastanza lieve e con un solo decesso segnalato7.
Un'indagine epidemiologica mostrò che l'epidemia era iniziata circa 10 giorni dopo una visita di una persona viremica (caso indice un uomo proveniente dal Kerala, India) ai suoi parenti a Castiglione di Cervia. Inoltre, nell'estate del 2017, l’Italia ha sperimentato un’altra epidemia che si è diffusa nel Lazio, cominciando ad Anzio in due persone che non erano state all'estero nei tre mesi precedenti l’insorgenza dei sintomi, coinvolgendo poi altri individui residenti a Roma che non erano stati ad Anzio, suggerendo una diffusione multifocale dell’infezione. A fine ottobre 2017, 269 casi di Chikungunya erano stati segnalati nella zona attorno ad Anzio, 61 casi a Roma, più altri casi sporadici in altre aree del Lazio. Tra settembre e ottobre dello stesso anno, 68 casi di Chikungunya sono stati identificati a Guardavalle Marina, sulla costa ionica della Calabria8. Entrambe le epidemie sopra descritte sono state originate dal ceppo ECSA.
Prevenzione vaccinale
Da novembre 2023 negli USA, su approvazione della Food and Drug Administration (FDA), è disponibile il primo vaccino a virus attenuato per la prevenzione dell’infezione da virus Chikungunya VLA1553 (nome commerciale IXCHIQ9) con indicazione a partire dai 18 anni di età e somministrabile con una schedula a singola dose (0,5 ml dopo ricostituzione) per via intramuscolare. L'approvazione si è basata sui risultati di uno studio randomizzato in doppio cieco condotto negli Stati Uniti in cui sono stati coinvolti 4.128 adulti (età ≥ 18 anni)10, dal quale è emerso che, entro i 28 giorni dopo la vaccinazione, nel sottogruppo di 266 pazienti identificati per testare il farmaco “per protocollo”, in 263 la risposta anticorpale sieroprotettiva neutralizzante risultava essere del 99%, con una persistenza a 180 giorni pari al 96%. I tassi di risposta erano simili tra i partecipanti di età compresa tra 18 e 64 anni e quelli di età ≥ 65 anni. Al vaccino sono stati attribuiti due effetti avversi gravi, mialgia e sindrome da inappropriata secrezione dell'ormone antidiuretico, entrambi risolti. Gli effetti avversi più comuni includevano cefalea (32%), affaticamento (29%), mialgia (24%), artralgia (18%) e febbre (14%). Gli studi clinici in corso stanno valutando l’immunogenicità nell’arco di cinque anni e l’efficacia e sicurezza negli adolescenti di età compresa tra 12 e 18 anni in Brasile.
La scelta di utilizzare un endpoint biologico – accettata dalle Autorità regolatorie – si è resa necessaria per l’imprevedibilità dell’epidemia della malattia, che impedisce di pianificare studi clinici basati sull’efficacia dei trattamenti. A 24 mesi di distanza dalla vaccinazione primaria (una dose) il tasso di risposta anticorpale protettiva era ancora del 97%, suggerendo che il vaccino può offrire una protezione prolungata nel tempo.
Al momento risulta essere in atto la valutazione per l’immissione in commercio di tale vaccino da parte dell’Agenzia Europea per i Medicinali (EMA), del Governo Canadese e dell’Agenzia Nazionale di Vigilanza Sanitaria (ANVISA) del Brasile, con potenziali approvazioni nel corso del 2024.
A gennaio 2024, la stessa Azienda produttrice di questo primo vaccino approvato per gli adulti contro il Chikungunya, ha annunciato l’arruolamento del primo paziente per un trial di fase 2 multicentrico pediatrico11, che prevede uno studio clinico, prospettico, randomizzato e in cieco su circa 300 bambini sani di età compresa tra uno e undici anni presso tre Centri di sperimentazione nella Repubblica Dominicana e in Honduras. I partecipanti verranno randomizzati per ricevere una formulazione a dose piena del vaccino (120 partecipanti), una formulazione a dose dimezzata (120 partecipanti) e un gruppo controllo non riceverà alcun farmaco (60 partecipanti).
Attualmente risultano essere in corso di sviluppo anche altri tipi di piattaforme di prevenzione vaccinale nei confronti dell’infezione da virus Chikungunya (Tabella I).
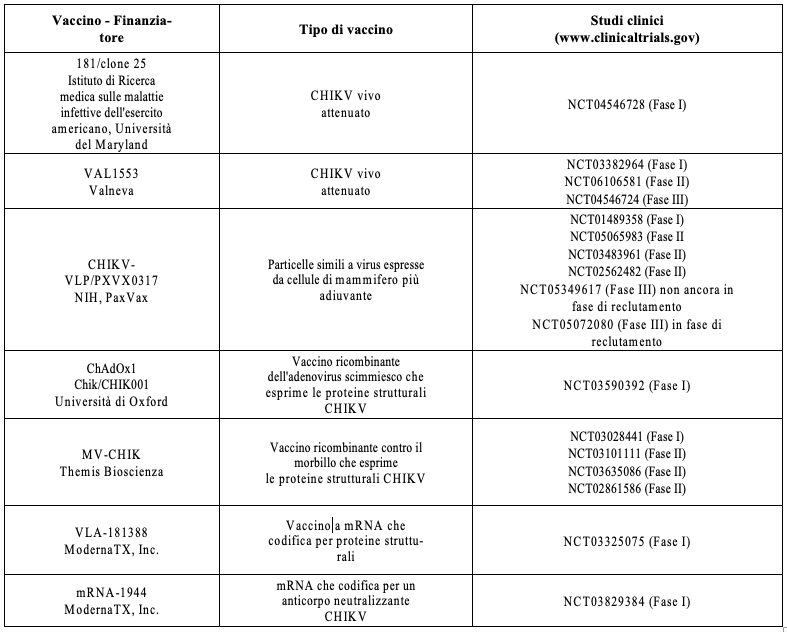
In uno studio randomizzato che ha coinvolto più di 260 adulti sani in regioni non endemiche per la Chikungunya, un vaccino vivo attenuato, vettore del morbillo, che esprime le proteine strutturali del virus della Chikungunya (MV-CHIK) o un vaccino del morbillo prime e MV-CHIK, ha indotto una neutralizzazione anticorpi contro il virus Chikungunya dopo una o due immunizzazioni12. I tassi di sieroconversione in coloro che hanno ricevuto MV-CHIK variavano dal 50% al 93% dopo una dose e dall’86% al 100% dopo due dosi. Le risposte immunitarie sono durate fino a sei mesi dopo una o due dosi e il vaccino si è rivelato sicuro e ben tollerato.
Sono in corso ulteriori studi clinici. In uno di fase 2 su un vaccino CHIK con particelle simili al virus (VLP) nei Paesi caraibici, 400 adulti con infezione endemica hanno ricevuto il vaccino in confronto con il placebo. Tra coloro che erano sieronegativi, l'88% aveva un aumento di almeno quattro volte del titolo di neutralizzazione13. La risposta immunitaria è stata duratura fino a 72 settimane dopo la vaccinazione e il vaccino è risultato sicuro e ben tollerato.
Sono in corso anche due studi clinici di fase 3 che stanno valutando una forma adiuvata di questo vaccino (PXVX0317)14,15, così come sono in corso progetti di ricerca con piattaforma a RNA messaggero (mRNA), tra cui uno studio di fase 1, randomizzato, controllato con placebo, finalizzato a testare, in un gruppo di adulti sani di nazionalità americana, la sicurezza e l'immunogenicità di un vaccino anti-Chikungunya (VAL-181388) con dosaggio variabile16.
Vaccino in attesa di approvazione in Italia
Il vaccino IXCHIQ, che come abbiamo visto è stato approvato il 9 novembre 2023 negli Stati uniti dall’FDA nella popolazione di età ≥ 18 anni, risulta essere controindicato, oltre che per i soggetti con una storia di grave reazione allergica (ad esempio anafilassi) a qualsiasi componente del vaccino, anche per quelli immunodeficienti o immunodepressi a causa di malattia o terapia medica (ad esempio, da tumori ematologici e solidi, sottoposti a chemioterapia, immunodeficienza congenita, terapia immunosoppressiva a lungo termine o pazienti con infezione da HIV gravemente immunocompromessi).
Dai risultati dello studio registrativo, dopo 180 giorni dalla dose di IXCHIQ, si rileva un’efficacia pari al 96,3% (IC 95%: 93,1 - 98,3)10, caratterizzata dal livello di anticorpi neutralizzanti anti-Chikungunya superiore alla soglia (μPRNT50 titolo ≥150).
È attualmente in corso da parte del Comitato per i medicinali per uso umano (CHMP) dell’EMA la valutazione di tale vaccino per l’approvazione della commercializzazione in Europa.
Dengue
Caratteristiche cliniche
La Dengue è una malattia febbrile con un periodo di incubazione che varia da 3 a 14 giorni ed è causata dall’infezione di uno dei quattro sierotipi del virus dengue (DEN-1, DEN-2, DEN-3 e DEN-4) appartenente al genere Flavivirus, che risultano essere strettamente correlati ma sierologicamente distinti, e dei quali DEN-2 e DEN-3 risultano essere maggiormente associati a infezioni gravi.
La loro trasmissione umana avviene prevalentemente attraverso punture di zanzare vettrici (Aedes aegypti o Aedes albopictus), che hanno a loro volta punto una persona infetta, anche se sono stati segnalati anche rari casi di trasmissioni interumana: nosocomiali (lesioni da aghi, esposizione mucocutanea, donatori di sangue asintomatici anche in corso di viremia), verticali (trasmissione in gravidanza, incluso l’allattamento materno) e sessuali.
Dal momento che è stata dimostrata una transitoria protezione crociata tra i quattro tipi di DEN, che tuttavia si riduce e/o si perde nel corso dei mesi successivi alla stessa infezione, i soggetti che vivono in un'area endemica ove circolano tutti i tipi, risultano essere sempre a rischio di infezione con qualsiasi tipo di virus dengue.
Non bisogna sottovalutare il dato di un 5% di pazienti che sviluppa una forma grave di Dengue, che risulta essere comunemente collegata alla seconda e alle altre precedenti infezioni.
I sintomi della Dengue si sviluppano tipicamente tra 4 e 7 giorni dopo la puntura della zanzara infetta e, come riportato dallo schema di classificazione dell’OMS17, vengono descritti tre livelli di infezione sintomatica, che si differenziano per tempistica e livello di gravità.
Questi sono:
Dengue senza segnali di allarme: caratterizzata da una diagnosi presuntiva di infezione da Dengue che può essere fatta nel contesto di residenza o viaggio in un'area endemica e con una manifestazione febbrile accompagnata da almeno due dei seguenti sintomi, quali:
- nausea, eruzione cutanea, cefalea, dolore retro-orbitario o oculare, mialgia e/o dolore osseo, leucopenia, prova del laccio positiva;
Dengue con segnali d'allarme: caratterizzata dalla sintomatologia come definita sopra, più uno dei seguenti sintomi:
- dolore o dolorabilità addominale, vomito persistente, aumento della permeabilità vascolare (ascite, versamento pleurico), sanguinamento mucosale, letargia, irritabilità o epatomegalia > 2 cm;
Dengue grave: caratterizzata da almeno uno dei seguenti segni clinici, quali:
- shock ipovolemico o ritenzione idrica con distress respiratorio, grave sanguinamento o grave coinvolgimento di organi (ad esempio ipertransaminasemia ≥ 1.000 UI/l, disturbi della coscienza, insufficienza cardiaca e di altri organi).
Epidemiologia
La Dengue attualmente risulta essere endemica in più di 100 Paesi delle regioni OMS dell’Africa, delle Americhe, del Mediterraneo orientale, del Sud-Est asiatico e del Pa-cifico occidentale. Le regioni delle Americhe, del Sud-Est asiatico e del Pacifico occidentale sono le più gravemente colpite, con l’Asia che rappresenta circa il 70% del carico globale di malattia.
L’infezione si sta diffondendo anche in nuove Aree, inclusa l’Europa, ove la prima trasmissione locale di Dengue è stata segnalata in Francia e Croazia nel 2010. La regione delle Americhe raccoglie dati epidemiologici sulla Dengue dal 1980 e da allora il virus si è diffuso in gran parte delle aree con una segnalazione nel solo anno 2023 di 4.493.652 casi, con 7.536 forme gravi e 2.289 decessi18.
Fonti OMS riportano che circa la metà della popolazione mondiale è oggi a rischio di Dengue, con circa 100-400 milioni di infezioni che si verificano ogni anno, con tassi di incidenza che risultano essere più alti tra luglio e settembre, variando in maniera significativa in base alla località geografica e influenzati da vari fattori quali la densità di popolazione, l’altitudine, la riproduzione delle zanzare e i modelli di approvvigionamento idrico19.
Prevenzione vaccinale
Dal momento che l’infezione Dengue risulta essere causata da quattro diversi sierotipi del virus e considerato che la stessa infezione fornisce una specifica immunità nel tempo contro il sierotipo omologo, ma solo transitoria contro i sierotipi eterologhi, la ricerca in ambito vaccinale, attraverso le varie piattaforme (Tabella II), ha polarizzato l’attenzione nella messa in atto di prodotti finalizzati a garantire un’adeguata protezione nei confronti di tutti e quattro i sierotipi DEN.
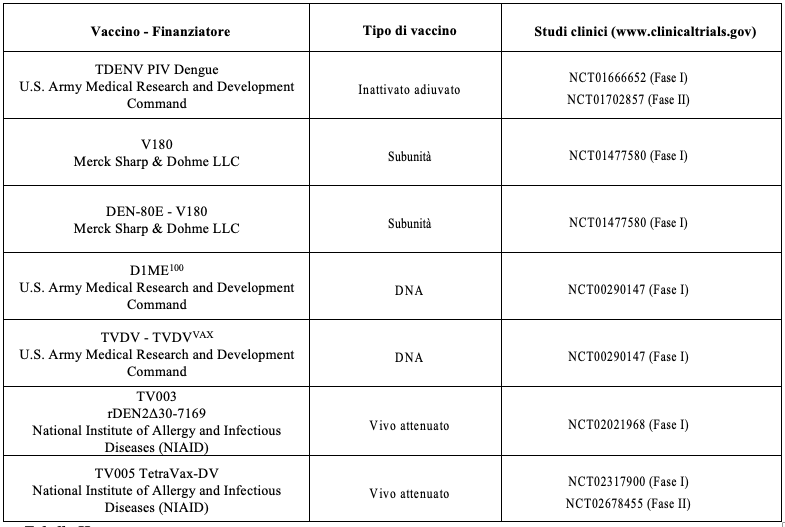
La storia del vaccino contro la Dengue risulta essere caratterizzata da una battuta d’arresto nel 2017, quando l’unico vaccino a virus attenuato disponibile – Dengvaxia – fu associato a un aumento del rischio di ricoveri ospedalieri e di malattie gravi nelle persone che erano state vaccinate ma che non avevano avuto alcun contatto con il virus, dovute ad un ipotetico fenomeno ADE (Antibody-Eependent Enhancement), rispetto ai vaccinati che avevano contratto la stessa infezione in precedenza, tanto da riportare nella scheda tecnica del prodotto la raccomandazione della messa in atto per adulti, giovani e bambini (di età compresa tra 6 e 45 anni) di uno specifico screening di laboratorio pre-vaccinale per l’identificazione di una precedente infezione da virus Dengue.
Le motivazioni alla base di tale tipo di raccomandazione nascono anche dall’esperienza nelle Filippine, ove il vaccino venne somministrato a 800.000 bambini, di cui 14 morirono dopo avere contratto il virus in comunità, per cui venne ipotizzato che in tali bambini non si fossero sviluppate le adeguate risposte anticorpali per la neutralizzazione del virus naturale.
Vaccino attualmente disponibile in Italia
QDENGA20 (approvazione EMA del 5/12/2022 e autorizzazione AIFA del 23/02/2023) è un vaccino contro i quattro sierotipi (DEN-1, DEN-2, DEN-3 e DEN-4) del virus Dengue. L’approvazione da parte dell’EMA è stata supportata dai risultati di 19 studi di fase 1, 2 e 3 con un campione di oltre 28.000 bambini e adulti, inclusi quattro anni e mezzo di dati di follow-up dallo studio globale di fase 3 sull’immunizzazione tetravalente contro la Dengue (studio TIDES: Tetravalent Immunization against Dengue Efficacy Study). Tale studio ha raggiunto il suo endpoint primario di efficacia complessiva del vaccino prevenendo l’80% dei casi sintomatici 12 mesi dopo la vaccinazione, ma anche il suo endpoint secondario con la prevenzione del 90% dei ricoveri 18 mesi dopo la vaccinazione, con un’efficacia variabile in base al sierotipo. Le analisi esplorative di TIDES hanno dimostrato che, durante i 4,5 anni di follow-up dello studio, il vaccino di QDENGA ha prevenuto l’84% dei casi di Dengue ospedalizzati e il 61% dei casi sintomatici di Dengue nella popolazione complessiva, inclusi individui sieropositivi e sieronegativi.
QDENGA, a differenza del precedente vaccino approvato in Unione Europea (Dengvaxia):
- può essere somministrato per prevenire la malattia anche nei soggetti che non hanno mai contratto l’infezione
- è utilizzabile su una popolazione di adulti, adolescenti e bambini a partire dai 4 anni di età
- richiede un numero inferiore di dosi per ottenere l’immunizzazione completa.
Il protocollo vaccinale del QDENGA prevede due dosi da 0,5 ml somministrate per via sottocutanea ad almeno tre mesi di distanza l’una dall’altra. Le controindicazioni comprendono l’ipersensibilità a uno dei componenti del vaccino; le immunodeficienze congenite o acquisite, anche dovute a terapie immunosoppressive quali chemioterapia o alte dosi di corticosteroidi sistemici (ad es. 20 mg/die o 2 mg/kg di peso corporeo/die di prednisone per 2 settimane o più) ricevute nelle 4 settimane precedenti la vaccinazione (come con altri vaccini vivi attenuati); l’infezione da HIV sintomatica o infezione da HIV asintomatica se accompagnata da evidenze di compromissione della funzione immunitaria; la gravidanza e l’allattamento.
I dati di sicurezza nella fascia di età compresa tra 4 e 17 anni, provenienti da studi clinici su 13.839 bambini (9.210 di età compresa tra 4 e 11 anni e 4.629 di età compresa tra 12 e 17 anni), includono dati di reattogenicità raccolti in 3.042 bambini (1.865 di età compresa tra 4 e 11 anni e 1.177 di età compresa tra 12 e 17 anni).
La frequenza, il tipo e la severità delle reazioni avverse nei bambini risultavano essere in gran parte coerenti con quelle negli adulti. Le reazioni avverse segnalate più comunemente nei bambini rispetto agli adulti sono risultate essere: febbre (11% vs 3%), infezione delle vie respiratorie superiori (11% vs 3%), nasofaringite (6% vs 0,6%), farin-gotonsillite (2% vs 0,3%) e malattia simil-influenzale (1% vs 0,1%). Le reazioni avverse segnalate meno comunemente nei bambini rispetto agli adulti sono state: eritema nella sede dell’iniezione (2% vs 27%), nausea (0,03% vs 0,8%) e artralgia (0,03% vs 1%); inoltre le reazioni registrate in 357 bambini di età < 6 anni vaccinati con QDENGA sono risultate essere: inappetenza (17%), sonnolenza (13%) e irritabilità (12%).
Conclusioni
I processi della globalizzazione, quali conseguenza anche dell’aumento degli scambi commerciali, il rischio di importazioni non solo di merci ma anche di parassiti e vettori, i viaggi internazionali, le migrazioni e il miglioramento delle tecniche diagnostiche, senza sottovalutare la drammatica variabile dei numerosi effetti del riscaldamento globale e dei cambiamenti climatici, risultano essere alla base della preoccupante diffusione e prevalenza delle malattie trasmesse da vettori anche nelle regioni temperate. In questo contesto, risulta essere di indubbio valore la strategia preventiva21 attraverso anche l’uso di nuovi vaccini per la tutela della Salute pubblica, ma non bisogna assolutamente dimenticare che per garantire un futuro sano e più sicuro c’è bisogno dell’impegno di tutti: prima che la Terra torturata ci presenti il conto!
Bibliografia
- WHO. Control of Neglected Tropical Diseases (NTD), Global Malaria Programme (GMP), High Impact Epidemics, Vector Control and Resistance. Global vector control response 2017-30. 2017.
- Sambri V. Infezioni emergenti da Arbovirus in Italia. Medico e Bambino 2019;38(4):231-6.
- ISS. Piano Nazionale di prevenzione, sorveglianza e risposta alle Arbovirosi (PNA) 2020-2025. 2019.
- ISS. Sistema nazionale di sorveglianza delle Arbovirosi: i bollettini periodici. Ultimo aggiornamen-to 01/11/2024.
- Roongaraya P, Boonyasuppayakorn S. Chikungunya vaccines: An update in 2023. Asian Pac J Allergy Immunol. 2023;41(1):1-11. DOI: 10.12932/ AP-271222-1520.
- Costa LB, Barreto FKA, Barreto MCA, et al. Epidemiology and Economic Burden of Chikungunya: A Systematic Literature Review. Trop Med Infect Dis. 2023;8(6):301. DOI: 10.3390/tropicalmed 8060301.
- Rezza G, Nicoletti L, Angelini R, et al; CHIKV study group. Infection with chikungunya virus in Italy: an outbreak in a temperate region. Lancet. 2007;370 (9602):1840-6. DOI: 10.1016/S0140-6736 (07)61779-6.
- Rezza G. Chikungunya is back in Italy: 2007-2017. J Travel Med. 2018;25(1). DOI: 10.1093 /jtm/tay004.
- Valneva. IXCHIQ (Chikungunya Vaccine, Live) Solution for Intramuscular Injection. Validation report. 2023.
- Schneider M, Narciso-Abraham M, Hadl S, et al. Safety and immunogenicity of a single-shot live-attenuated chikungunya vaccine: a double-blind, multicentre, randomised, placebo-controlled, phase 3 trial. Lancet. 2023;401(10394):2138-47. DOI: 10.1016/S0140-6736(23)00641-4.
- Valneva Clinical Development. A Phase 2 Clinical Study of VLA1553 in Healthy Children Aged 1 to 11 Years. 2023-2025.
- Reisinger EC, Tschismarov R, Beubler E, et al. Immunogenicity, safety, and tolerability of the measles-vectored chikungunya virus vaccine MV-CHIK: a double-blind, randomised, placebo-controlled and active-controlled phase 2 trial. Lan-cet. 2019;392(10165):2718-27. DOI: 10.1016/S0 140-6736(18)32488-7.
- Chen GL, Coates EE, Plummer SH, et al; VRC 704 Study Team. Effect of a Chikungunya Virus-Like Particle Vaccine on Safety and Tolerability Outcomes: A Randomized Clinical Trial. JAMA. 2020;323(14):1369-77. DOI: 10.1001/jama.2020. 2477. Erratum in: JAMA. 2020 Jul 28;324(4):400.
- Bennett SR, McCarty JM, Ramanathan R, et al. Safety and immunogenicity of PXVX0317, an aluminium hydroxide-adjuvanted chikungunya virus-like particle vaccine: a randomised, double-blind, parallel-group, phase 2 trial. Lancet Infect Dis. 2022; 22(9):1343-55. DOI: 10.1016/S1473-3099(22)00226-2.
- Raju S, Adams LJ, Earnest JT, et al. A chikungunya virus-like particle vaccine induces broadly neutralizing and protective antibodies against alpha-viruses in humans. Sci Transl Med. 2023; 15(696):eade8273. DOI: 10.1126/scitranslmed. ade8273.
- ModernaTX. Safety, Tolerability, and Immunogenicity of VAL-181388 in Healthy Subjects. 2017-2019.
- WHO. Dengue: Guidelines for Diagnosis, Treatment, Prevention and Control. World Health Organization, 2009.
- PAHO/WHO. Reported Cases of Dengue Fever in the Americas.
- WHO. Dengue and severe dengue. 2023.
- AIFA. QDENGA Riassunto Caratteristiche Prodotto. 2023.
- Alpern JD, Dunlop SJ, Dolan BJ, Stauffer WM, Boulware DR. Personal Protection Measures Against Mosquitoes, Ticks, and Other Arthropods. Med Clin North Am. 2016;100(2):303-16. DOI: 10.1016/j.mcna.2015.08.019.
Vuoi citare questo contributo?
