Gennaio 2013 - Volume XVI - numero 1
M&B Pagine Elettroniche
Ricerca
Analisi
delle sospette reazioni avverse alle vaccinazioni nella popolazione
pediatrica
1Agenzia
Italiana del Farmaco, Roma
2Centro
Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute,
Istituto Superiore Sanità, Roma
Indirizzo
per corrispondenza:
C.Santuccio@aifa.gov.it
Spontaneous
reports of suspected adverse reactions to vaccines in the
paediatric population
Key
words
Vaccines,
Spontaneous reports, Adverse reactions
Abstract
Spontaneous
reports of suspected adverse reactions to vaccines represent the
majority of adverse reaction reports involving children. The
evaluation of these reports is an important tool for the
continuous monitoring of vaccine safety. This article summarizes
the analysis of spontaneous reports of adverse reactions of
vaccines used in children in the years 2009-2010. A full
description of these data has been published in the report
“Rapporto sulla sorveglianza post-marketing dei vaccini in
Italia 2009-2010”. |
Le
segnalazioni di sospette reazioni avverse a vaccini costituiscono la
maggior parte delle segnalazioni spontanee relative all’età
pediatrica. La valutazione di tali segnalazioni rappresenta uno
strumento importante per il monitoraggio continuo della sicurezza dei
vaccini. In questo articolo viene presentata l’analisi delle
segnalazioni spontanee nel periodo 2009-2010, relative ai principali
vaccini utilizzati nei bambini, estratta dal “Rapporto sulla
sorveglianza post-marketing dei vaccini in Italia 2009-2010”.
La
sorveglianza post-marketing degli eventi avversi a farmaci e vaccini
è un insieme di attività svolte costantemente sulla
base della valutazione dei dati di sicurezza che si rendono via via
disponibili da diverse fonti tra loro complementari, quali ad esempio
segnalazioni spontanee di sospette reazioni avverse, studi clinici,
studi epidemiologici e dati di letteratura1. Rispetto agli
studi epidemiologici le segnalazioni spontanee sono in grado di
fornire informazioni più immediate e costituiscono uno
strumento importante per monitorare in modo continuo e sistematico il
profilo sicurezza di farmaci e vaccini dopo la loro registrazione.
Le
segnalazioni relative ai vaccini rappresentano la maggior parte delle
sospette reazioni avverse segnalate in età pediatrica (Figura
1). Questo è dovuto sia al fatto che la
normativa richiede di segnalare qualsiasi reazione avversa osservata
dopo somministrazione di vaccino sia a una maggiore attenzione e
sensibilità da parte degli operatori sanitari coinvolti2.
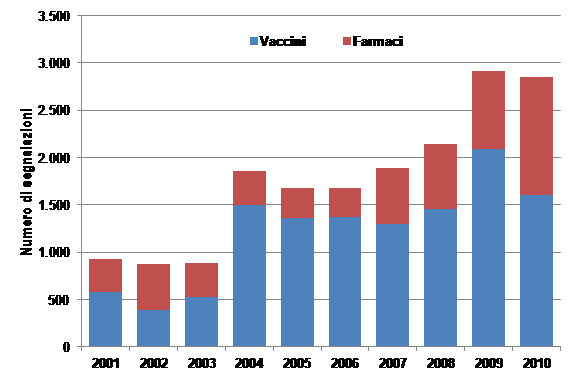
Oltre
alla valutazione delle singole segnalazioni ricevute, l’AIFA,
in collaborazione con i Centri Regionali di Farmacovigilanza (CRFV) e
con i referenti per la prevenzione delle Regioni in cui sono attivi i
CRFV, effettua semestralmente, l’analisi dei segnali che
emergono analizzando il complesso delle segnalazioni.
L’analisi
presentata in questo articolo si riferisce alle segnalazioni da
vaccino presenti nella Rete Nazionale di Farmacovigilanza (RNF) al 15
luglio 2011, insorte nel periodo 2009-2010 e che riguardano la
popolazione fino a 17 anni (2.002 segnalazioni nel 2009 e 1.755 nel
2010). I vaccini più frequentemente segnalati sono quelli più
utilizzati nell’età evolutiva, tenendo presente che il
Piano Nazionale Vaccini prevede in questa fascia d’età
l’immunizzazione contro difterite (D), tetano (T), poliomielite
(IPV), pertosse (P), epatite B (HBV), malattie invasive da
Haemophilus influenzae b (Hib), malattie invasive da
pneumococco, infezioni da meningococco C, morbillo-parotite-rosolia
(MPR), varicella (V) e infezioni da alcuni genotipi di papilloma
virus umano (HPV).
Per la
prevenzione delle prime sei malattie vengono generalmente utilizzati
i vaccini combinati e in particolare l’esavalente
(DTP-HBV-IPV-Hib), autorizzato per la vaccinazione primaria e
di richiamo (booster) in età pediatrica.
Vaccini
esavalenti
Nel
periodo in studio sono stati segnalati 1.116 casi di sospetta
reazione avversa dopo la somministrazione con vaccini esavalenti pari
a un tasso di segnalazione di 40 per 100.000 dosi vendute nel 2009 e
di 37 per 100.000 nel 2010; con una percentuale di casi gravi del
12%. Le classi sistemico-organiche (SOC) a maggior frequenza sono
state le “Patologie sistemiche e condizioni relative alla sede
di somministrazione” (74% delle segnalazioni) e le “Patologie
del sistema nervoso” (23% delle segnalazioni). Nel complesso le
reazioni più segnalate sono state: febbre (648 casi pari al
58% del totale), pianto (87 casi - 8%), ipotonia (57 casi - 5%) e
orticaria (51 casi - 5%). Tra le reazioni gravi, oltre a febbre e
ipotonia, sono state segnalate anche convulsioni afebbrili (18 casi)
e convulsioni febbrili (17 casi). Generalmente la tipologia delle
reazioni segnalate è prevista nel Riassunto delle
Caratteristiche del Prodotto (RCP).
Vaccini
tri-, tetra-, pentavalenti
Segnalazioni
di sospette reazioni avverse sono pervenute anche a seguito della
somministrazione di altri vaccini disponibili contro DTP, IPV, Hib
e HBV, combinati nello stesso prodotto o in co-somministrazione,
soprattutto dopo i primi due anni di vita. I vaccini più
utilizzati sono stati il tetravalente (DTP-IPV) e il trivalente (DTP)
mentre è stato utilizzato un numero di dosi inferiori per il
vaccino pentavalente (DTP-IPV-Hib).
Nella
maggioranza dei casi le reazioni segnalate non risultano essere
gravi; le SOC maggiormente coinvolte dopo somministrazione sia del
tetravalente che del trivalente sono state, in ordine di frequenza:
“Patologie sistemiche e condizioni relative alla sede di
somministrazione”; “Patologie della cute e del tessuto
sottocutaneo” e “Patologie del sistema nervoso”.
Tra i
prodotti utilizzati per le vaccinazioni di richiamo nei bambini, sono
pervenute 143 segnalazioni, di cui 6 gravi (4,2%), dopo la
somministrazione di Polioinfanrix (vaccino tetravalente DTP-IPV per
la dose booster). Per questo vaccino il tasso di segnalazione è
in aumento da 40 per 100.000 dosi nel 2009 a 64 per 100.000 dosi nel
2010. Nel 92% dei casi le reazioni osservate si riferiscono alla SOC
“Patologie sistemiche e condizioni relative alla sede di
somministrazione” trattandosi per lo più di reazioni di
tipo locale.
Vaccinazione
pneumococcica
La
vaccinazione contro le malattie invasive da pneumococco nei primi
anni di vita è stata effettuata con il vaccino antipneumococco
contenente sette sierotipi (4, 6B, 9V, 14, 18C, 19F e 23F dello
Streptococcus pneumoniae); a partire dal secondo semestre 2010
tale vaccino è stato sostituito con il vaccino antipneumococco
13-valente che include altri sei sierotipi di pneumococco (1, 3, 5,
6A, 7F, e 19A). Per favorire l’aderenza alla campagna
vaccinale, la vaccinazione con l’antipneumococco 7- o
13-valente viene effettuata generalmente nella stessa seduta
vaccinale dell’esavalente, entrambi però possono dar
luogo a insorgenza di febbre e, come riportato nel RCP del vaccino
antipneumococco 7-valente, la frequenza di reazioni febbrili risulta
più elevata se il vaccino è somministrato
contemporaneamente all’esavalente. Nella grande maggioranza
delle segnalazioni in seguito a somministrazione di vaccino
antipneumococcico, e in particolare nei casi segnalati come gravi, i
bambini hanno ricevuto contemporaneamente il vaccino esavalente.
Questa consuetudine rende quindi più difficile la valutazione
dei dati.
Nel
biennio considerato, sono pervenute complessivamente 710 segnalazioni
di sospetta reazione avversa relative al vaccino antipneumococco
7-valente (tasso di segnalazione pari a 30 segnalazioni per 100.000
dosi vendute nel 2009 e 46 nel 2010). La distribuzione per SOC
ricalca quella del vaccino esavalente per le motivazioni già
menzionate e le reazioni segnalate con maggior frequenza sono state
la febbre (427 casi pari al 60% del totale), il pianto (61 casi, 9%),
l’orticaria (45 casi, 6%) e l’ipotonia (41 casi, 6%). Le
segnalazioni di reazioni insorte nei sei mesi di utilizzo del vaccino
antipneumococco-13 valente sono state 133 (tasso di segnalazione di
16 per 100.000 dosi vendute). Considerata la situazione di passaggio
da un vaccino all’altro, avvenuta a partire dal secondo
semestre 2010 e la variabilità regionale, è possibile
che l’esposizione effettiva al vaccino antipneumococco
13-valente sia stata inferiore al numero di dosi distribuite. Una
valutazione più accurata può essere effettuata
disponendo dei dati di esposizione dei vaccinati, ma la parziale
informatizzazione delle anagrafi vaccinali non permette l’utilizzo
di questi dati. Bisognerà quindi seguire l’andamento nel
tempo delle segnalazioni per avere un quadro più chiaro del
profilo di sicurezza del vaccino antipneumococco 13-valente.
Vaccinazione
meningococcica
Un’altra
vaccinazione effettuata nell’età pediatrica è
quella contro il meningococco C prevista in due fasce di età
(13 mesi o 12-14 anni). Dai dati delle segnalazioni risulta che i due
vaccini maggiormente utilizzati nel periodo di riferimento sono stati
il Menjugate e Meningitec che vengono spesso somministrati insieme ad
altri vaccini. Per entrambi, il tasso di segnalazione è andato
riducendosi nel biennio; il tasso del Menjugate è passato da
18 per 100.000 dosi nel 2009 a 13 nel 2010, mentre quello del
Meningitec è diminuito da 23 segnalazioni per 100.000 dosi nel
2009 a 20 nel 2010. La percentuale di reazioni gravi segnalate varia
dal 17% al 19% a seconda del vaccino usato, con una distribuzione per
SOC abbastanza simile nei due vaccini ad esclusione delle reazioni
del sistema nervoso e di quello gastrointestinale più
frequenti per il Menjugate. Le reazioni segnalate più
frequentemente per entrambi i prodotti sono state la febbre, la
cefalea e l’orticaria.
Vaccinazioni
contro morbillo, parotite, rosolia e varicella
Per
l’immunizzazione contro morbillo, parotite e rosolia (MPR) sono
utilizzati essenzialmente i vaccini trivalenti MPR (Priorix e
MMRVAXPRO), a volte in co-somministrazione con vaccini antivaricella
monocomponente (V; Varivax e Varirlix); negli ultimi anni si è
diffuso anche il ricorso al vaccino tetravalente MPRV (l’unico
disponibile è il Priorix Tetra, essendo stata interrotta da
tempo la produzione del ProQuad). Nel periodo considerato sono
pervenute 426 segnalazioni dopo somministrazione di vaccini
trivalenti MPR e 195 segnalazioni dopo vaccini quadrivalenti MPRV. I
tassi di segnalazione mostrano delle differenze tra i diversi
prodotti, in particolare per quanto riguarda il vaccino tetravalente
(Tabella
I).
Vaccino |
Tasso
per 100.000 dosi | |
2009 |
2010 | |
Priorix
tetra |
68,9 |
55,2 |
Varivax |
22,9 |
29,0 |
MMRVAXPRO |
19,6 |
20,4 |
Varirlix |
14,5 |
16,3 |
Priorix |
21,7 |
16,2 |
Tabella
I. Tasso di segnalazione tra i diversi vaccini contro
morbillo, parotite, rosolia e varicella (anni 2009-2010).
Le
segnalazioni ricevute mostrano alcune differenze tra le reazioni
osservate con il tetravalente MPRV e quelle con i trivalenti MPR. Le
principali reazioni segnalate sono state: febbre, eruzione cutanea e
orticaria per il Priorix; febbre, eruzione cutanea ed eritema per il
MMRVAXPRO; febbre, eruzione cutanea e convulsioni febbrili per il
Priorix Tetra. La maggiore frequenza di segnalazioni di convulsioni
febbrili in seguito a somministrazione di Priorix Tetra potrebbe
dipendere dall’utilizzo di questo vaccino nei bambini più
piccoli. Infatti il 90% delle segnalazioni relative a Priorix Tetra
riguardano bambini di inferiore a 2 anni e per il 10% quelli da 2 a
11 anni, mentre quelle relative a vaccini trivalenti MPR riguardano
solo per il 42% bambini più piccoli. In relazione a
quest’ultima tipologia di eventi nell’autunno del 2011 è
stato aggiornato il RCP del Priorix Tetra. Altre due differenze
meritano di essere approfondite e seguite nel tempo: nei vaccini
tetravalenti è stata osservata una maggiore frequenza di
segnalazioni di trombocitopenia e atassia rispetto a quelli
trivalenti.
Vaccinazione
HPV
Nel 2009
e nel 2010 è proseguita la campagna vaccinale contro HPV che
prevedeva sia l’offerta attiva e gratuita della vaccinazione
(con i vaccini Cervarix e Gardasil) alla coorte di ragazze nel
dodicesimo anno di età, che l’estensione dell’offerta
vaccinale ad altri gruppi di età.
Complessivamente,
nel biennio 2009-2010, sono state registrate nella RNF 1.087
segnalazioni di sospette reazioni avverse dopo somministrazione di
vaccini contro HPV, la maggior parte delle quali nella fascia di età
a cui è rivolta la vaccinazione (655 in minori di 12 anni, 397
tra 12 e 17 anni).
Sono
state riscontrate differenze nei tassi di segnalazione tra i due
prodotti: 118 segnalazioni per 100.000 dosi vendute nel 2009 e 158
nel 2010 per il Cervarix; 30 segnalazioni per 100.000 dosi vendute
nel 2009 e 28 nel 2010 per il Gardasil.
Questa
differenza può essere in parte legata alla diversa attitudine
alla segnalazione spontanea nelle Regioni che utilizzano un vaccino
piuttosto che l’altro, ma anche a differenze qualitative tra i
due prodotti. Le reazioni locali, e in particolare il dolore nella
sede di iniezione, sono riportate più frequentemente dopo la
somministrazione di Cervarix; tali reazioni potrebbero essere messe
in relazione ad una maggiore reattogenicità locale del vaccino
a causa della presenza dell’adiuvante AS04 nella sua
composizione. Inoltre, le numerose segnalazioni di reazioni locali
potrebbero spiegare sia la diversa distribuzione percentuale delle
segnalazioni per gravità (13% per il Gardasil rispetto al 5%
per il Cervarix) che la distribuzione per SOC delle reazioni
osservate.
In
Tabella II viene riportata la
distribuzione delle reazioni in valore percentuale per le prime
cinque SOC coinvolte più frequentemente nelle segnalazioni
relative ai due vaccini.
SOC |
%
segnalazioni | |
Gardasil |
Cervarix | |
Patologie
del sistema nervoso |
44,4 |
36,1 |
Patologie
sistemiche e condizioni relative alla sede di somministrazione |
30,4 |
73,5 |
Patologie
della cute e del tessuto sottocutaneo |
22,2 |
11,2 |
Patologie
gastrointestinali |
13,2 |
14,8 |
Patologie
del sistema muscoloscheletrico e del tessuto connettivo |
9,3 |
17,8 |
Tabella
II. Distribuzione percentuale delle segnalazioni dei vaccini
anti-HPV per SOC (sono riportate le prime cinque SOC).
Si nota
che, a parità di SOC, è presente una diversa
distribuzione tra i due vaccini delle percentuali di reazioni
insorte. La SOC coinvolta con maggiore frequenza dopo
somministrazione di Gardasil è rappresentata dal sistema
nervoso e la reazione più frequente è la cefalea; per
il Cervarix la SOC più frequente è invece rappresentata
dalle “Patologie sistemiche e condizioni relative alla sede di
somministrazione” e la reazione più frequente è
il dolore in sede di somministrazione.
Nell’ambito
delle attività di sorveglianza passiva, l’analisi delle
segnalazioni spontanee di reazioni avverse è uno strumento
importante per il monitoraggio continuo della sicurezza dei vaccini.
La segnalazione spontanea ha però limiti ben conosciuti,
legati soprattutto alla sottosegnalazione e alla mancanza dei dati
relativi alla popolazione esposta. Altri strumenti complementari al
sistema di sorveglianza passiva sono spesso necessari ed è per
questo che in alcune circostanze sono stati avviati programmi di
sorveglianza attiva e studi epidemiologici specifici. Tra questi nel
biennio 2009-2010 è stato condotto lo studio sulla
“Sorveglianza della sicurezza di farmaci e vaccini in pediatria
in corso di pandemia influenzale”3, coordinato
dall’Istituto Superiore di Sanità (ISS) e finanziato
dall’AIFA ed è stata avviata la “Sorveglianza
attiva degli eventi avversi dopo vaccinazione anti-HPV”
progetto inter-regionale coordinato dall’ISS4.
I dati
presentati nell’articolo sono estratti dal “Rapporto
sulla sorveglianza post-marketing dei vaccini in Italia 2009-2010”
pubblicato dall’AIFA a dicembre 2011 e disponibile
integralmente on line5. La pubblicazione del rapporto ha
il duplice intento di informare gli operatori sanitari sulle attività
di sorveglianza condotte in Italia e di fornire l’informazione
di ritorno ai segnalatori con la convinzione che una sorveglianza
post-marketing efficace e un’adeguata diffusione delle
informazioni di ritorno agli operatori sanitari e ai cittadini
possono senza dubbio favorire ricadute positive in termini di
maggiore adesione ai programmi di vaccinazione.
- Edwards JR, Aronson JK. Adverse drug reactions: definitions, diagnosis, and management. Lancet 2000;356:1255-9.
- Decreto Legislativo 24 aprile 2006, n. 219 (Attuazione della direttiva 2001/83/CE (e successive direttive di modifica) relativa ad un codice comunitario concernente i medicinali per uso umano, nonché della direttiva 2003/94/CE).
-
Italian Multicenter Study Group for Drug and Vaccine Safety in Children. Effectiveness and safety of the A-H1N1 vaccine in children: a hospital-based case-control study. BMJ Open 2011;1;e000167.
- Conferenza permanente per i rapporti tra lo Stato, le Regioni e le Province autonome di Trento e Bolzano. Repertorio Atti n. 219/CSR del 18 ottobre 2007.
- Rapporto sulla sorveglianza postmarketing dei vaccine in Italia 2009-2010. AA.VV. Ufficio di Farmacovigilanza, Agenzia Italiana del Farmaco & Centro Nazionale di Epidemiologia, Sorveglianza e Promozione della Salute, Istituto Superiore di Sanità. Novembre 2011:1-71 (ultimo accesso 21 maggio 2012).
Vuoi citare questo contributo?