Dicembre 2000 - Volume III - numero 10
M&B Pagine Elettroniche
Pediatria per l'ospedale
La
guarigione delle ferite cutanee
(Parte
prima)
Tutti,
medici e non medici, osserviamo ogni giorno, le grandi capacità
riparatrici della cute: ognuno sa che, a meno che non si sovrammetta
un'infezione, quando i due labbri della ferita combacino, entro 7
giorni tutto torna perfettamente come prima.
Ho
sentito più volte alcune madri lamentarsi che gli strappi sui
vestiti non era possibile rimediarli in modo altrettanto perfetto e
altrettanto rapidamente, come le ferite della pelle.
Ma a
ben pensare, poco ci è stato detto nel corso degli studi sui
fenomeni principali che stanno alla base della guarigione delle
lesioni della cute e sui processi di cicatrizzazione. La
pubblicazione di un articolo di revisione del problema (Singer AJ
e Clark RAF, Cutaneous wound healing – N Engl J Med 341, 738-46,
2000) ci offre l'occasione per approfondire le nostre
conoscenze sull'argomento.
La
funzione primaria della cute è quella di servire come barriera
protettiva nei confronti dell'ambiente. La perdita dell'integrità
di estese porzioni della cute, in seguito a lesioni o a malattie, può
portare a gravi danni e perfino alla morte.
Gli
obbiettivi principali del trattamento delle ferite sono:
- la rapidità della loro chiusura
- il mantenimento della funzione
- la cicatrice esteticamente soddisfacente
I recenti
miglioramenti nelle conoscenze nel campo della biologia cellulare e
molecolare hanno allargato le possibilità d'influire sui
processi biologici che sono interessati nella guarigione delle ferite
e nella rigenerazione della cute: tutto ciò ha portato a
miglioramenti della loro cura.
Biologia
della guarigione delle ferite
La
guarigione delle ferite è un processo dinamico, interattivo,
che interessa mediatori solubili, cellule del sangue, matrice
extracellulare e cellule parenchimali.
Le
ferite guariscono secondo 3 fasi, che si sovrammettono l'una
all'altra nel tempo:
- infiammazione
- formazione di tessuto
- rimodellamento del tessuto
Infiammazione
Ogni
lesione di tessuto porta a un'interruzione di vasi sanguigni e a
fuoriuscita dei costituenti del sangue. Il coagulo sanguigno che si
viene a formare ristabilisce l'emostasi e fornisce una matrice
extracellulare provvisoria per la migrazione delle cellule (Vedi
Figura n.1.)..
La
piastrine non soltanto facilitano l'emostasi, ma secernono molti
mediatori, utili per la guarigione della ferita (fattori di crescita,
originati dalle piastrine, che attraggono i macrofagi e i
fibroblasti). Ma in assenza di emorragia, è stato visto che le
piastrine non svolgono un ruolo essenziale per la guarigione della
ferita. Numerosi mediatori vasoattivi e fattori chemiotattici sono
formati dalla coagulazione, dai fattori del complemento attivati e
dalle cellule parenchimasli lese e attivate. Tutte queste sostanze
reclutano leucociti infiammatori nella sede della lesione.
Figura
n.1 - Una ferita della cute 3 giorni dopo il trauma
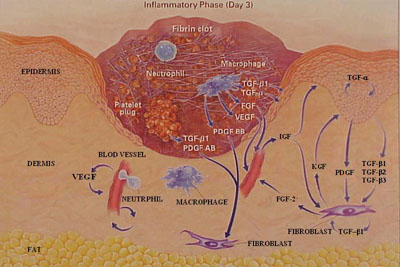
Si pensa
che siano necessari fattori di crescita per i movimenti delle cellule
all'interno della ferita.
- TGF-b1, TGF-b2, TGF-b3 indicano i fattori di crescita b1, b2 e b3 rispettivamente
- TGF-a1 indica il fattore di crescita a
- FGF indica il fattore di crescita dei fibroblasti
- VEGF indica il fattore di crescita endioteliale
- PDGF, PDGF AB e PDGF BB indicano il fattore di crescita originato dalle piastrine, il fattore di crescita AB di origine piastrinica e il fattore di crescita BB, originato anch'esso dalle piastrine
- IGF indica il fattore di crescita insulino-simile KGF indica il fattore di crescita dei cheratinociti
I
neutrofili ripuliscono la ferita dalle particelle estranee e dai
batteri; essi sono poi allontanati dalla farita o sono fagocitati dai
macrofagi. Infatti i macrofagi, richiamati da fattori specifici
chemiotattici (frammenti della proteina della matrice extraxellulare,
fattore di crescita b, proteina 1 attraente i monociti) infiltrano la
sede della ferita e divengono macrofagi attivati, che liberano
fattori di crescita, come il fattore di crescita, originato dalle
piastrine e il fattore di crescita dell'endotelio vascolare, che
iniziano a formare il tessuto di granulazione. I macrofagi si legano
alle proteine specifiche della matrice extracellulare con i loro
recettori integrine, un'azione che stimola la fagocitosi dei
microrganismi e dei frammenti della matrice extracellulare da parte
dei macrofagi.
L'aderenza
alla matrice extracellulare stimola anche i monociti a subire una
metamorfosi per passare a macrofagi infiammatori e riparatori. Sia i
monociti che i macrofagi attivati esprimono il fattore 1, stimolante
le colonie, una citochina necessaria per la sopravvivenza dei
monociti e dei macrofagi. Essi secernono anche il tumor necrosi
factor a, una potente citochina pro-infimmatoria, il fattore di
crescita delle piastrine, un potente chemioattrattivo e i mitogeni
per i fibroblasti.
Altre
importanti citochine, espresse dai monociti e dai macrofagi, sono
rappresentate dal fattore di crescita trasformante a,
dall'interleuchina 1, dal fattore di crescita trasformante b e dal
fattore 1 di crescita insulino-simile.
I fattori
di crescita, originati dai monociti e dai macrofagi sono
indispenabili per l'inizio e la propagazione del nuovo tessuto nelle
ferite, perchè gli animali che ne sono privi hanno difficoltà
a riparare le ferite. Per queste ragioni i macrofagi sono considerati
avere un ruolo essenziale nella transizione dall'infiammazione alla
riparazione.
Epitelizzazione
La
riepitelizzazione delle ferite inizia poche ore dopo la lesione.
Le
cellule epidermiche delle appendici cutenee, come i follicoli
piliferi, rimuovono precocemente il sangue coagulato e lo stroma
danneggiato dallo spazio della lesione. Nello stesso tempo le cellule
presentano notevoli alterazioni fenotipiche, che includono la
retrazione dei tonofilamenti intracellulari, la dissoluzione della
maggior parte dei desmosomi intercellulari, che costituiscono le
connessioni fra le cellule e la formazione di filamenti di actina che
permettono i movimenti delle cellule. Contemporaneamente le cellule
epidermiche e dermiche non aderiscono più le une alle altre
per la scomparsa dei legami degli emidesmosomi che collegano
l'epidermide alla membrana basale, che segue i movimenti laterali
delle cellule epidermiche. I recettori dell'integrina sulle cellule
epidermiche li portano a interagire con una varietà di
proteine della matrice extracellulare (per esempio fibronectina e
vibronectina) che sono intercalate con il collageno stromale tipo I,
ai margini della ferita e si intrecciano con il coagulo di
fibrina nell'area della ferita. Le cellule epidermiche migranti
suddividono la ferita, separando la parti morte o sofferenti dal
tessuto vivo.
Figura
n. 2 - La ferita della cute 5 giorni dopo la lesione
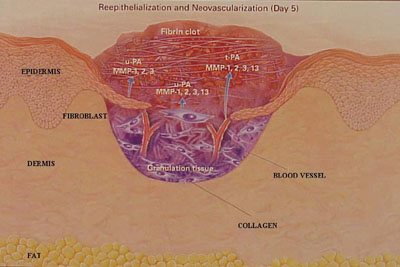
I vasi
sanguigni si avanzano nel coagulo din fibrin. Le proteinasi sembrano
siano necessarie per i movimenti delle cellule.
u-PA
indica l'attivatore del plasminogeno tipo urochinasi
MMP-1, 2,
3 e 13 indicano le metalloproteine della matrice 1, 2, 3 e 13
(collegenasi 1, gelatinasi A, stromelisina 1 e collagenasi 3
rispettivamente)
t-PA
indica l'attivatore del plasminogeno tissutale
La
degradazione della matrice extracellulare, che è necessaria
per le cellule epidermiche che migrano fra il derma collageno e
l'escara di fibrina, dipende dalla produzione di collagenasi da parte
delle cellule epidermiche, come dall'attivazione della plasmina da
parte dell'attivatore del plasminogeno, prodotto dalle cellule
epidermiche. L'attivatore del plasminogeno infatti attiva la
collagenasi e facilita inoltre la degradazione del collageno e delle
proteine della matrice extracellulare.
Da 1 a 2
giorni dopo la lesione, le cellule epidermiche ai bordi della ferita,
iniziano a proliferare in ritardo in confronto alle cellule
attivamente migranti. Lo stimolo necessario per la proliferazione e
la migrazione delle cellule epidermiche durante la riepitelizzazione
non è stato ancora identificato, ma di sicuro esso esiste.
L'assenza delle cellule vicino ai margini della ferita (l'effetto
"bordo libero") può indurrre tuttavia sia la
migrazione che la proliferazione delle cellule epidermiche. La
liberazione locale di fattori di crescita e l'aumentata espressione
dei recettori per questi fattori possono anche rappresentare lo
stimolo per questi processi (fattori di crescita epidermica, fattore
a trasformate la crescita, fattore di crescita dei cheratinociti).
Dopo il completamento della riepitelizzazione, ricompaiono le
proteine della membrana basale, in una ordinata sequenza, dai margini
verso l'interno della ferita. Le cellule epidermiche riacquistano il
loro normale fenotipo e sono di nuovo strettamente adese alla nuova
membrana basale e al derma sottostante.
Formazione
del tessuto di granulazione
Il nuovo
stroma, chiamato tessuto di granulazione, comincia a invadere lo
spazio della ferita, all'incirca 4 giorni dopo la lesione. Numerosi
nuovi capillari si sfioccano all'interno del nuovo stroma.
Macrofagi, fibroblasti e vasi sanguigni penetrano contemporaneamente
all'interno della ferita. I macrofagi costituiscono una fonte
continua dei fattori di crescita necessari a stimolare la fibroplasia
e l'angiogenesi, mentre i fibroblasti producono nuova matrice
exrtraxcellulare, necessaria per assicurare la crescita delle
cellule. Intanto i vasi sanguigni portano l'ossigeno e i nutrienti
necessari per mantenere il metabolismo delle cellule.
I fattori
di crescita, soprattutto il fattore di crescita derivato dalle
piastrine e il fattore trasformante di crescita b1, insieme con le
molecole della matrice extracellulare, stimolano probabilmente i
fibroblasti del tessuto intorno alla ferita, a proliferare , a
esprimere gli appropriati recettori per l'integrina e a migrare nello
spazio della ferita. Questi fattori hanno trovato un'utile
indicazione nella pratica corrente: il fattore di crescita, originato
dalle piastrine, accelera la guarigione delle piaghe pressorie
croniche, delle ulcere diabetiche, mentre il fattore di crescita dei
fibroblasti
basali viene usato con qualche successo nel trattare le ulcere
pressorie croniche.
Le
molecole strutturali della matrice extracellulere, di recente
formazione, chiamata matrice provvisoria, contribuiscono alla
formazione del tessuto di granulazione: queste molecole sono
rappresentate dalla fibrina, dalla fibronectina e dall'acido
ialuronico. Infatti la comparsa della fibronectina e dei recettori
dell'integrina, che legano la fibrinectina stessa, la fibrina o
ambedue ai fibroblasti, sembra essere il passo limitante la velocità
di formazione del tessuto di granulazione. I fibroblasti sono d'altra
parte responsabili della sintesi, della deposizione e del
rimodellamento della matrice extracellulare. All'inverso la matrice
extracellulare può evere un effetto positivo o negativo sulla
capacità dei fibroblasti di sintetizzare, depositare,
rimodellare e in genere interagire con la matrice extracellulare.
Tabella
n.1 - Citochine che influenzano il processo di guarigione delle
ferite
Citochine
| Origine
principale | Cellule
bersaglio ed effetti maggiori |
Famiglia
dei fattori di crescita epidermica:
- fattore di crescita epidermica -
fattore a di crescita trasformante
-
fattore di crescita epidermica legante l'eparina | -
piastrine
-
macrofagi, celluler epidermiche
-
macrofagi | Rigenerazione
epidermica e parenchimale:
-
motilità e proliferazione cellulare
-
motilità e proliferazione cellulare
-
motilità e proliferazione cellulare |
Famiglia
del fattore di crescita
fibroblastica:
-
fattore basico di crescita fibroblastica
-
fattore acido di crescita fibroblastica
-
fattore di crescita dei cheratinociti | - macrofagi, cellule endoteliali -
macrofagi, cellule endoteliali
-
fibroblasti | Vascolarizzazione
della ferita:
-angiogenesi
e proliferazione dei fibroblasti
-angiogenesi
e proliferazione dei fibroblasti
-angiogenesi
e proliferazione dei fibroblasti |
Famiglia
del fattore b di crescita trasformante
-
fattore b1 e b2 di crescita trasformante
- fattore b3 di crescita trasformante | - piastrine e macrofagi - macrofagi | Fibrosi
e aumento della forza di tensione
-
motilità delle cellule epidermiche, chemiotassi di
macrofagi e fibroblasti, sintesi e rimodellamento della matrice
extracellulare
-
effetti anticicatrici |
Altri
-
fattore di crescita derivato dalle piastrine
-
fattore di crescita dell'endotelio vascolare
-
tumor necrosis factor a
-interleuchina-1
-
fattori I di crescita insulino-simile
-
fattore I stimolanete le colonie | - piastrine, macrofagi, cellule epidermiche -
cellule epidermiche, macrofagi
-
neutrofili
-
neutrofili
-
fibroblasti, cellule epidermiche
-
numerosi tipi di cellule | - prolieferazione dei fibroblasti, chemioattrazione,
attivazione e
chemioattrazione
dei fibroblasti
- angiogenesi e aumentata permeabilità vascolare - espressione pleoiomorfica dei fattori di crescita -
espressione pleoiomorfica dei fattori di crescita
-
riepitelizzazione e formazione del tessuto di granulazione
-
attivazione dei macrofagi e formazione del tessuto di
granulazione |
I
movimenti delle cellule all'interno del coagulo sanguigno, formato
dalla fibrina, o nella matrice extracellularte fortemente compatta,
può richiedere un attivo sistema proteolitico che può
aprire la strada alla migrazione cellulare. Molti degli enzimi,
originati dai fibroblasti, oltre alla plasmina del siero, sono
adibiti a quest'opera, insieme all'attivatore del plasmionogeno,
alle collagenasi, alla gelatinasi A e alla tromelisina.
Dopo
essere migrati all'interno della ferita, i fibroblasti cominciato a
sintetizzare la matrice extracellulare, che viene successivamente
rimpiazzata dalla matrice del collageno, forse in seguito all'azione
del fattore b1 di crescita trasformante.
Dopo che
un'abbondante quantità di matrice del collageno è stata
deposittata nella ferita, i fikroblasti cessano di produrre collageno
e il tessuto di granulazione, ricco di fibroblasti, viene rimpiazzato
da una cicatrice, relativamente povera di cellule. Le cellule
presenti nella ferita vanno incontro ad apoptosi, in seguito
all'azione di un segnale sconosciuto. La mancata regolazione di
questi processi è la responsabile delle alterazioni della
fibrosi della cicatrice, che porta aslla formazione del cheloide,
della morfea e dello scleroderma.
Neovascolarizzazione
Per la
nutrizione del nuovo tessuto di granulazione è necessaria la
formazione di nuovi vasi sanguigni. L'angiogenesi è un
processo complesso che si realizza nella matrice extracellulare del
letto della ferita, al quale partecipa la migrazione e la
stimolazione mitogena delle cellule endoteliali.
L'induzione
dell'angiogenesi fu inizialmente attribuita al fattore di crescita
fibroblastica acido o basico. Ma in seguito è risultato che
molte altre molecole posseggono attività angiogenica, come il
fattore di crescita dell'endotelio vascolare, il fattore b di
crescita trasformante, l'angiotropina, l'angiopoietina I e la
trombospondina. La bassa tensione di ossigeno e l'elevata
concentrazione di acido lattico possono d'altra parte stimolare
l'angiogenesi. Anche le cellule epidermiche stimolate della ferita
secernono grandi quantià di fattore di crescita dell'endotelio
vascolare. Il fattore basico di crescita fibroblastica può
costituire la piattaforma dell'angiogenesi durante i primi 3 giorni
di riparazione della ferita, mentre il fattore di crescita delle
cellule dell'endotelio vascolare è importante per
l'angiogenesi durante la formazione del tessuto di granulazione da 4°
al 7° giorno.
Oltre ai
ricordati fattori dell'angiogenesi, sono necessari anche la matrice
extracellulare e i recettori endoteliali per la formazione della
matrice provvisoria. Durante la proliferazione, le cellule
endoteliali microvascolari, vicine o all'interno della ferita,
depositano elevate quantità di fibronectina all'interno della
parete vasale. La fibronectina perivascolare può agire come
una guida per i movimenti delle cellule endoteliali, all'interno
della ferita. Anche l'espressione e l'attività delle proteasi
sono neceasarie per l'angiogenesi.
I vari
passi, che si susseguono nella angigenesi sono ben visibili nella
Figura n.2:
- il
trauma causa distruzione di tessuto e ipossia
- i
fattori necessari per l'angiogenesi, come il fattore basico e il
fattore di crescita dei fibloblasti, sono rilasciati immediatamente
dai macrofagi, dopo la distruzione cellulare
-
l'ipossia stimola la produzione del fattore di crescita delle cellule
dell'endotelio vascolare da parte delle cellule dell'epidermide
- enzimi
proteolitici, liberati dal tessuto connettivo, degradano le proteine
della matrice extracellulare
-
frammenti di questa degradazione richiamano i monociti del sangue
periferico nella sede della lesione, dove essi iniziano ad attivare i
macrofagi a liberare i fattori dell'angiogenesi.
- alcuni
di questi fattori, come il fattire basico di crescita dei
fibroblasti, stimolano le cellule endoteliali a liberare l'attivatore
del plasminogeno e la procollagenesi
- l'att9
ivatore del plasminogeni o converte il plasminogeno in plasmina,
mentre la procollagenasi attiva la collagenasi: ambedue le proteasi
digeriscono la membrana basale
- la
frammentazione della membrana basale induce le cellule endoteliali,
stimolate dai fattori dell'angiogenesi a migrare per formare i nuovi
vasi sanguigni nella sede della lesione.
- quando
la lesione si è ricchita di nuovo tessuto di granulazione,
l'angiogenesi cessa e la maggior parte dei nuovi vasi sanguigni
scompare, come conseguenza dell'apoptosi.
- la
morte programmata di queste cellule è regolata probabilmente
da una varietà di molecole della matricre, come la
trombospondina 1 e 2, i fattori antiangiogenesi, come l'angiostatina,
l'endostatina e l'angiopoietina 2.
Vuoi citare questo contributo?