Dicembre 2004 - Volume VII - numero 11
M&B Pagine Elettroniche
Il punto su
La
rubrica riporta i risultati delle maggiori metanalisi, facendo
riferimento in particolare alla banche dati della Cochrane, Clinica
Evidence ed altri siti dedicati. Ma anche singoli studi clinici
randomizzati possono essere oggetto di interesse e di citazione.
Le
evidenze sono riportate in modo fedele rispetto ai risultati delle
revisioni. Alcune volte sono di grande aiuto per la pratica clinica,
altre volte, in assenza di informazioni, no.
Ma il
medico, di fronte ad un quesito clinico, dovrebbe sempre tenere conto
delle conoscenze disponibili che si ricavano dai livelli di evidenza
prodotti in letteratura. Le variabili di esperienza, contesto, di
scelta del paziente fanno, alla fine, l'atto medico.
Il
Pneumocisti Carinii
Clinica
Pediatrica, IRCCS, Burlo Garofolo, Trieste
Indirizzo
per la corrispondenza: marzia_lazzerini@libero.it.
Perché
occuparcene?
Le
ragioni fondamentali sono:
1. Alto
rischio in pazienti con immunodepressione (T cell)
2.
Contemporaneo aumento della prevalenza dell' immunodepressione
3. Alta
mortalità dell'infezione, se non riconosciuta e trattata
4.
Esistenza di misure di terapia e di profilassi efficaci
Pazienti
oncologici
1,2,3,4,6 | |
Trapianto
di midollo osseo 1-5 | >40% |
Leucemia
acuta linfoblastica 7 | 20-43% |
Linfoma8 | 20-30% |
Rabdomiosarcoma,
Neuroblastoma 9 | 25% |
Tumori
SNC ed altri in steroidi 10 | Reports |
Trapianti
di altro genere | |
Trapianto
di cuore e/o cuore e polmone 11,12 | 16-40%,
fino 88% |
Trapianto
di fegato 13 | 30% |
Trapianto
di rene13 | 4-10% |
Trapianto
di intestino? | |
Immunodeficienze
congenite 1,2,3,4 | |
Immunodeficienza
combinata grave | 10%
nel
20% è sintomo esordio |
Ipogammaglobulinemia1,2,3,4 | Poco
frequente |
Malattie
infiammatorie croniche | |
Granulomatosi
di Wegener 15 | frequente
in pz trattati con ciclofosfamide + steroidi
riattiva
la malattia
è
proposta la profilassi |
Altre
malattie infiammatorie-vasculiti | LES>
PAN> AIG> DM |
MICI,
Behcet 16,17 | 0.3%
in casistica 300,
due
casi fatali |
In
sostanza dipende dai farmaci utilizzati | |
Steroidi16,17,20,31 | Anche
da soli sufficienti
Wegener-linfopenia
Ad
alte dosi nella MICI
Il
meno pericoloso (reports) |
Ciclofosfamide
alte dosi +-steroidi 16,17,20,22 | |
Ciclosporina
alte dosi +- steroidi /mtx 20,22 | |
MTX | |
Malnutrizione
18,19 | Descritte
epidemie in istituzionalizzati |
HIV36 | |
Bambini | 40% |
Adulti | 70% |
Necessità
di ventilazione meccanica: 40-50%
Mortalità:
35-50%
Un
cenno di storia
-
Identificato nel 1902 da Carlo Chagas (a cui si deve
l'identificazione della tripanosmiasi americana) e Antonio Carinii,
i quali ritenevano inizialmente di trovarsi di fronte ad un nuovo
tipi di tripasonomiasi. Evidente poco dopo il tropismo per il
polmone, da cui il nome: Pneumocisti carinii (PC).
-
Epidemie in Europa nel 1930 e 1940 in prematuri e malnutriti,
soprattutto negli orfanotrofi.
- Nel
1960 la polmonite da PC (PCP) era frequente in soggetti con
immunodeficienza secondaria a malignità.
- Solo in
seguito all'alta incidenza in soggetti con trapianto d'organo si
definì la natura opportunista dell'infezione.
- Nel
1982, in seguito ad un cluster di casi in adulti maschi a San
Francisco la ricerca di un'immunodepressione sottostante ha portato
alla identificazione dell'AIDS. 23
Fungo
o protozoo?
-
Inizialmente classificato come appartenente al regno dei protozoi, in
base alla piccola forma trofica (1-4_m), la maggiore forma cistica
(8_m), ed allo sviluppo di otto progenie all'interno della forma
cistica, liberate come forme trofiche alla rottura della cisti.
- E'
stato solo nel 1988 che in base all'analisi delle prime sequenze di
mRNA si è stabilito un legame filogenetico col regno dei
miceti, e da allora tutte le successive informazioni sul genoma del
PC contribuiscono ad attribuirne la classificazione nel regno degli
ascomiceti.
-
Tuttavia in base alla morfologia e soprattutto in base alla non
sensibilità ai farmaci antifungini per alcuni autori la
classificazione più corretta è ancora nel regno dei
protozoi.
Esistono
diverse specii o genotipi?
- I
pneumocisti sono una famiglia di funghi specie-specifici. Non esiste
quindi la possibilità di infezione da contatto con animali.
- Ci sono
oltre 30 genotipi di PC che infettano l'uomo, alcuni associati a
forme gravi di polmonite , altri a quadri più moderati. 23
Ma si
chiama ancora Pneumocisti Carinii?
-
Recentemente la specie che infetta l'uomo è stata
ridenominata P. jiroveci. 24
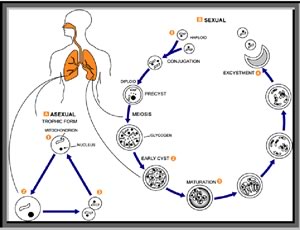
Patogenesi:
torniamo alla popolazionea rischio
- Studi
di sieroprevalenza indicano l'avvenuto contatto nel 75% dei bambini
entro i 4 anni di età.
-
Nell'individuo sano l'infezione è generalmente
asintomatica. 25
- La
maggior parte dei soggetti che sviluppa la malattia da PC ha
anormalità di funzione o di numero dei linfociti T.
- Nei
soggetti HIV+ la polmonite da PC è una malattia che definisce
lo stato di AIDS conclamato, ed avviene in genere quando la conta dei
linfociti CD4 scende al di sotto dei 200cell/mmc. E' un indicatore
forte di inadeguato accesso alle cure ( HAART) o di scarsa
compliance. La PCP è inoltre la più comune infezione
opportunista in lattanti e bambini piccoli con infezione da HIV
acquisita in epoca perinatale. L'esordio è più spesso
tra i 3-6 mesi.
- La
conta dei linfociti CD4 definisce la classe di rischio anche nei
soggetti non HIV +.
-
Soggetti con deficit dei linfociti B sono invece a rischio molto
ridotto.
- Gli
steroidi sono un fattore di rischio indipendente dalla natura e
dall'intensità dell'immunodepressione primaria.
Che
significa allora l'isolamento del PC dall'aspirato naso-faringeo
di un lattante?
-
Lattanti sani frequentemente presentano il PC nell'aspirato
naso-faringeo.
-
Tuttavia di fronte a segni clinici e/o ad altri elementi di dubbio
(emocromo, Ig, anamnesi sospetta) pensare ed eventualmente indagare
un immunodeficienza.
E'
diffuso in tutto il mondo?
-Si.
Come
si acquisisce l'infezione: reinfezione o riattivazione?
Per
lungo tempo si è ritenuto che il PC rimanesse quiescente a
livello polmonare, causando malattia in corso di immunodepressione.
Tuttavia
diverse osservazioni sono contrarie a questa ipotesi:
- PC assente su broncolavaggio o tessuto polmonare individui sani. 23
- PC assente nel 75% dei soggetti HIV+ con CD4<200/mmc 23
- Diversi genotipi identificati in pazienti di diverse zone geografiche, in relazione alla sede di espressione clinica e di residenza e non al luogo di nascita 26
- In alcuni studi dimostrata latenza limitata: massimo 1 anno
A favore
invece della possibilità di un infezione ex novo 27,28,30,32
- Nello stesso pz in diversi episodi identificati genotipi diversi di PC
- Descritte epidemie 23
- Identificato lo stesso genotipo in soggetti a contatto stretto ( familiari e sanitari) 27,28,29,30,32
Conclusioni:
E' quindi più verosimile pensare che in seguito
all'infezione il PC nell'individuo immunocompetente venga
completamente eliminato, senza rimanere latente. Un'infezione
de-novo in un individuo immunocompromesso può invece causare
malattia.
Quali
sono l'habitat naturale e le vie di trasmissione dell'infezione?
Quanto è
importante la trasmissione interpersonale rispetto alle fonti
ambientali?
-
L'habitat naturale e le vie di trasmissione non sono completamente
noti.
- Il PC è
stato isolato nelle stanze di soggetti malati, negli impianti di
areazione di ospedali, nei vasi portafrutta. 30
- La
trasmissione per via aerea è stata dimostrata negli animali,
ed è di gran lunga la più probabile nell'uomo. 28,29
- La
trasmissione interpersonale è dimostrata ( familiari e
personale sanitario a contatto con un malato). 27,28,28,29,30,31,
32
Conclusioni:
Considerate le somiglianze con il regno dei funghi l'ipotesi
maggiore è che il PC sia un equivalente di un fungo
dismorfico, ubiquitario nell'ambiente, e trasmesso con le spore per
via aerea. Resta da definire la resistenza nell'ambiente esterno,
la rilevanza della trasmissione interpersonale rispetto alle fonti
ambientali.
Quindi
quali sono le precauzioni da prendere in ospedale?
Il
personale sanitario può fungere da portatore sano e
trasmettere l'infezione? Il paziente va isolato?
- Sono
raccomandate le precauzioni standard. E' ragionevolmente prudente
evitare contatti stretti tra soggetti con PCP e soggetti
immunodepressi, anche se in base a quanto detto le precauzioni sui i
contatti interpersonali non eliminano un possibile rischio
ambientale.
Qual è
il periodo d'incubazione?
Il
periodo d'incubazione non è noto, ma studi in modelli
animali suggeriscono che possono trascorrere da 4-8 settimane
dall'infezione prima della comparsa di segni clinici.
Quali
sono le caratteristiche strutturali principali e la patogenesi?
Glicoproteina
A, o major surface glucoprotein (MSG):
- è
la maggiore proteina di superficie, pesantemente glicosilata con
carboidrati contenenti mannosio.
- Media
adesività PC alle cellule dell'ospite
-
Conferisce specificità antigenica ed immunologia
Glucano:
- è
il maggiore componente della parete cellulare
- è
in buona parte responsabile dell'intensa risposta infiammatoria
- è
un polimero costituito da molecole di glucosio legate tramite
reazione enzimatica specifica, inesistente nell'organismo
umano---potrebbe essere bersaglio di terapia specifica (inibitori
della _1-3 glucano-sintetasi efficaci in modelli animali).
Deidrofolato
redattasi
- è
il bersaglio d'azione del TRIMETROPIN
Dal
completo sequenziamento del genoma del PC si spera di identificare
ulteriori bersagli terapeutici. 23
La
risposta immunitaria nell'infezione da PC è essenzialmente
di tipo cellulare.
Cellule
responsabili della difesa:
Linfociti:
- In
particolare l'attività dei CD4 (T helper) è centrale.
- In
soggetti con HIV il rischio di malattia dipende dai valori di CD4, in
particolare aumenta per CD4<200/mmc. In questi soggetti si ha
anche il maggior rischio d'insuccesso della terapia antibiotica,
come se un certo gardo de cellularità fosse necessaria per
eliminare l'infezione.
- In topi
con immunodeficienza combinata severa (SCID) e deficit di linfociti T
e B l'infezione da PC si manifesta entro le prime 3 settimane di
vita, anche in presenza di macrofagi e neutrofili funzionanti.
- Quando
il sistema immunitario dei topi è ricostituito con cellule CD4
i topi riacquistano la capacità di risolvere l'infezione
spontaneamente.
Macrofagi:
- In
situazioni di alterata funzionalità dei macrofagi, come l'AIDS
od alcune malattie maligne, la clearance del PC è diminuita.
- In
modelli animali macrofagi-depleti la risoluzione dell'infezione è
alterata. 23
La
neutropenia ed i deficit anticorpali non si associano ad un
rischio particolarmente elevato di malattia da PC.
********
** * ** ********
Quali
sono i meccanismi di danno polmonare?
Una
volta inalato il PC aderisce ai pneumoniti di tipi 1,non è
tuttavia in grado di produrre un danno diretto ai tessuti,. Il danno
è piuttosto collegato all'intensità
dell'infiammazione.
Linfociti
e macrofagi:
- Sia nei
modelli animali ( topi SCID) che in vivo nei pz con HIV si è
osservata una minore gravità clinica della malattia in
rapporto a bassi valori di CD4.
- Nei
topi ricostituiti con cellule CD4 si assiste ad un peggioramento
clinico con alterazione della diffusione dei gas.
- Anche
nei pz post –TMO l'espressione clinica dell'infezione correla
con la rispresa della cellularità T (engraftment).
Neutrofili:
- Mentre
nei pz con neutropenia il rischio di PCP non è particolarmente
elevato, la polmonite severa da PC si caratterizza per un intenso
infiltrato neutrofilo, associato a danno alveolare ed alterata
diffusione dei gas.
Mediatori
della flogosi:
- Le
citochine fondamentali della flogosi sono il TNF _, IL-1 ed IL-2, IFN
_.
- In
particolare nel topo la somministrazione di per aereoslo ha diminuito
l'intensità dell'infezione, indipendentemente dai livelli
di CD4.
Sono
descritti due quadri istopatologici
a)
Polmonite interstiziale con ispessimento dei setti alveolari ed
esteso infiltrato a prevalenza di plasma cellule. Tipica lattante
debilitato tra 3-6 mesi.
b)
Alveolite diffusa desquamativa. All'interno degli alveoli è
presente abbondante essudato ricco di PC e macrofagi. Tipica bambino
più grande ed adulto immunodepresso.
Nel
soggetti senza AIDS la flogosi è maggiore, c'è
maggiore presenza di neutrofili e ciò correla con un esordio
più acuto ed una prognosi peggiore. 32
Qual è
la presentazione clinica?
- Nel
soggetto con grave compromissione dell'immunità cellulare ed
in particolare nel soggetto HIV + l'esordio è in genere
sub-acuto, con iniziale tachipnea senza febbre e tosse non produttiva
per giorni od anche settimane, associati alla sensazione di non poter
prendere un respiro profondo. In questi pazienti in questa fase si
enfatizza l'ossimetria (arteriosa) dopo esercizio fisico, che viene
considerata sensibile e specifica per la diagnosi di PCP (l'assenza
di desaturazione esclude virtualmente la diagnosi). La progressione è
lenta in insufficienza respiratoria.
-
Maggiormente è conservata l'integrità del sistema
immunitario più l'esordio è acuto, con tachipnea e
dispnea improvvisa, tosse, rientramenti, cianosi.
-
L'auscultazione del torace è generalmente negativa,
raramente sono auscultabili rantoli fini inspiratori.
C'è
un aspetto caratteristico dell'RX torace?
Inizialmente
L'RX può essere normale. In seguito possono comparire
infiltrati interstiziali peri-ilari, con progressione verso la
periferia. Il quadro può progredire con consolidamento degli
spazi aerei (alveolari) bilaterali, mimando un edema polmonare, ma
con risparmio degli spazi costo-frenici e degli apici
Un 20%
dei soggetti presentano quadri atipici, che includono formazioni di
pneumatoceli, infiltrati monolaterali e/o lobari,
noduli,linfoadenopatia mediastinica e versamenti pleurici.
In
seguito al trattamento l'Rx può rimanere inalterato per 7-10
gg. In alcuni casi anche dopo completa guarigione ed in assenza di
sintomi persistono anomalie radiologiche. In altri casi residuano
fibrosi e/o bronchiectasie post-infettive.
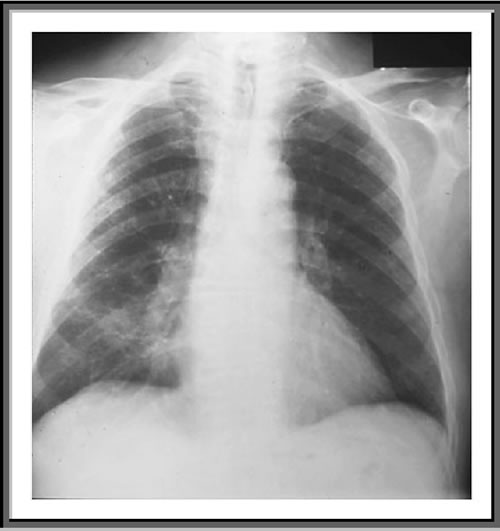
Rx
torace di un paziente con PCP: infiltrati misti interstiziali ed
alveolari, più evidenti all'emitorace di destra.
Come
fare la diagnosi?
La
diagnosi definitiva richiede l'isolamento del PC.
Diagnosi
diretta
-
induzione sputo sensibilità variabile 50-90% ( in una
metanalisi sensibilità 55%) *. Non consigliato nel paziente
compromesso (aumenta le secrezioni).
- BAL :
sensibilità 90%
Esistono
diversi tipi di colorazioni:
a)
Colorazione di Grocot e blu di toluidina per le forme cistiche
b) Giemsa
o altre colorazioni policromatiche per le forme trofiche
c) IFA
per entrambe le gorme (cisti e trofozoiti). 23,34
PCR su
aspirato orofaringeo: sensibilità 89% , specificità 94%
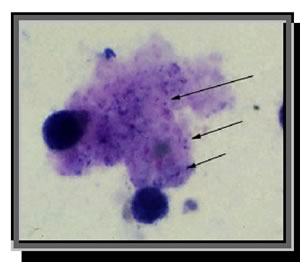 | 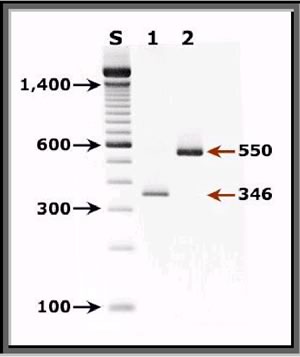 |
Colorazione
con giemsa : la colorazione con Giemsa è un metodo rapido
per mettere in evidenza le forme trofiche (trofozoiti) del PC, che
spesso, come in questo caso, appaiono all'interno di un accumulo di
essudato schiumoso. I trofozoiti sono piccoli ( 1-5_m), e solamente i
loro nuclei, colorati in violetto, sono visibili (frecce)
PCR:
elettroforesi su gel di agarosio dell'amplificazione tramite PCR
dei prodotti del DNA del PC estratti da materiale biologico (in
questo caso broncolavaggio).
Quale
è la prognosi della polmonite da PC?
Senza
terapia la PCP ha una mortalità del 100%
In
terapia la mortalità è del 10-30% se il trattamento è
iniziato precocemente.
Anche le
(rare, <3%) localizzazioni secondarie (retina, milza, fegato,
linfonodi, midollo osseo) rispondono alla terapia.
Esistono
fattori prognostici?
I fattori
prognostici negativi identificati in letteratura per il pz non HIV
sono:
-
tachipnea, tachicardia , aumento della PCR e del LDH, necessità
ventilazione meccanica
- altra
infezione polmonare concomitante, trapianto renale, storia terapia
con farmaco citotossico o ciclofosfamide
I fattori
prognostici negativi identificati per i pz HIV sono:
- secondo
episodio di PCP, storia di sintomi respiratori >4 settimane,
tachipnea, desaturazione
marcate
anormalità radiologiche, leucocitosi>10.800/mmc,
ipo-albuminemia <3.5gr/dl, LDH >300
Quale la
terapia e quanto a lungo?
INDICAZIONI
ALLA TERAPIA
Dose | Efficacia | Commento | |
TMP-SMZ | (15-20
TMP, 75-100mg SMZ in 4 dosi ) ev o per os se malattia lieve , per
3 settimane in HIV+, 2 settimane almeno negli altri casi. | 95-% | Reazioni
avverse:
rash e
neutropenia, anemia, nefropatia, nausea, vomito, diarrea
maggiori
nei pz HIV (15%) rispetto agli altri
se le
reazioni sono lievi si consiglia di continuare |
Se
intolleranza/ non risposta ( dopo 5-7 gg) alternative: | |||
Pentamidina | 4mg/kg
/24 h
dose
singola ev
od
aerosol | Uguale
efficacia al TMP-CMZ | Collaterali
frequenti:
Pancreatine,danno
epatico e renale, ipoglicemia, iperglicemia, ipotensione, febbre,
trombocitopenia, neutropenia, rash. |
Atovaquone | 30mg/kg/24h
in 2 dosi in <2 aa, 45mg/kg/24h in 2 dosi in >2 aa | Uguale
efficacia al TMP-CMZ | Pochi
effetti collaterali
Ma non
sperimentato bambino
Sperimentato
anche nel trapianto di fegato |
Altre
possibilità: | |||
Combinazioni
TMP+ dapsone, Clindamicina+primachina
Trimexato+
a. folico | Poca
esperienza | ||
C'è
indicazione agli steroidi in fase acuta di malattia?
Alcuni
studi negli adulti suggeriscono che l'utilizzo degli steroidi ad
alte dosi aumenta la sopravvivenza nelle forme moderate e gravi di
PCP. LA dose suggerita per i bambini è di 2mg/kg/24h di
prednisone per 7-10gg, poi scalare nei successivi 10-14gg. 35
Quali
sono le complicazioni della polmonite da PC?
La
maggior parte delle complicazioni sono secondarie alla terapia.
Chi deve
fare la profilassi e come?
INDICAZIONI
ALLA PROFILASSI
TMO
ALLOGENICO: RED BOOK 2003, CDC 2001 39,41
- Dal
momento del trapianto per 6 mesi (livello di evidenza AII)
- Nei pz
con GVHD cronica nei b. che ricevono terapia immunosopressiva
(steroidi, ciclosporina) per altre indicazioni il trattamento può
essere esteso oltre i 6 mesi fino alla risoluzione del problema
sottostante (evidenza BII)
- In
alcuni centri la terapia è iniziata 1-2 settimane prima del
trapianto (non evidenze pubblicate, indicazione in base al giudizio
di alcuni esperti)
TMO
AUTOLOGO:
Nei pz
che hanno ricevuto fludarabina o 2-CDA, nei pz con sottostante
linfoma o leucemia o che hanno ricevuto pesanti regimi di
condizionamento (BIII)
LEUCEMIA
ACUTA -LINEE GUIDA LLA 2000 ED LMA 2002
-Per
tutto il corso della chemioterapia
LINFOMI –
LNH 97 ED LH 2004
per tutto
il corso della chemioterapia
NEUROBLASTOMA
-
dall'inizio della chemioterapia fino a 3 m dopo la sospensione
TRAPIANTI
DI ORGANI SOLIDI:
-
Generalmente indicati per cuore, polmone e fegato un periodo di
profilassi di 12 mesi
SCID
Red Book 2003
-fino a
quando sussiste l'immunodeficienza (tentativo TMO)
MAL
INFIAMMATORIE CRONICHE:
- non
esiste alcuna indicazione condivisa, eccetto nella vasculite di
Wegener (un RCT su 89 pz con follow up a 2 anni dimostra nel gruppo
trattato un minor numero di ricadute, infezioni polmonari ed
extrapolmonari)
HIV:
Red book, CDC 2002, OMS 36,41
bambini
nati da mamma HIV + , dalle 4-6 settimane ai 12 mesi
bambini
fino ai 2 anni se CD4 ad 1 anno<750/mmc o >15%
bambini
<5 anni se CD4<500/mmc o <15%
bambini
>5 anni se CD4<200/mmc o >15%
considerare
inoltre la profilassi nei seguenti casi:
- bambini
con rapida diminuzione della conta CD4
- bambini
con HIV sintomatico
-
adolescenti con febbre inspiegata per >2 settimane o candidosi
orofaringea
Inoltre
- i
bambini con un primo episodio di PC devono essere sottoposti a
profilassi per tutta la vita (indicazione esperti, non validata da
studi).
Quali
sono gli schemi raccomandati di profilassi? Red book 2003
TMP
CMZ | TMZ
5mg/kg/24h CMZ 25mg/kg/24h come dose singola giornaliera
3
volte alla settimana in giorni consecutivi (ex lun, mart,
merc)
in
alternativa
-
Tutti i giorni della settimana
- A
giorni alterni
- Due
giorni alla settimana* | Problemi:
-tolleranza
(collaterali
20-40%)
-resistenze |
Alternative: | ||
Dapsone | 2mg/kg/24
( max 100mg)in 1 dose os, oppure
4mg/kg
1volta/settimana (max 200mg)
NO 3
volte/settimana* | Pochi
collaterali |
Atovaquone | 30mg/kg/24hin
1 dose per i b <3m e >24 m;
45mg/kg/24h
per i bambini 4-23m | Sperimentato
anche nel trapianto di fegato |
Pentamidina
aerosol | 300mg
in 1 somministrazione al mese | Problemi:
-costo |
Dapsone+
Pentamidina+
A
Folico
| ||
Acido
folico insieme al bactrim? 23,
40
-
L'acido folico è spesso somministrato in associazione al
TMT-CMZ, anche se non esistono studi che ne supportino l'uso.
Il
problema delle resistenze
23,37,38
-
Attualmente i dati sulle resistenze del PC al TMT-CMX indicano…..
- In
particolare esistono diversi report di mutazione del gene della
di-idro-pterato sintetasi (bersaglio del TMP e del dapsone).
-
Tuttavia, anche in presenza della mutazione la maggior parte dei pz
dimostra una risposta clinica al TMP.
TMT–CMZ
e methotrexate: una controindicazione formale?
-
L'indicazione a non associare il TMT-CMZ al methotrexate per il
rischio aggiuntivo di mielosopressione è attualmente
rivalutato in base alle più recenti evidenze che
indicherebbero una ragionevole sicurezza nella pratica, sempre in
associazione alla supplementazione con acido folico ed al
monitoraggio dell'emocromo.
- Arend SM, Kroon FP, van't Wout JW.Pneumocystis carinii pneumonia in patients without AIDS, 1980 through 1993. An analysis of 78 cases. Arch Intern Med. 1995 Dec 11-25;155(22):2436-41.
- Santamauro JT, White DA. Respiratory infections in HIV-negative immunocompromised patients. Curr Opin Pulm Med. 1996 May;2(3):253-8.
- Walzer PD. Pneumocystis carinii pneumonia in patients without human immunodeficiency virus infection.Clin Infect Dis. 1997 Aug;25(2):219-20.
- Chusid MJ, Heyrman KA. An outbreak of Pneumocystis carinii pneumonia at a pediatric hospital. Pediatrics. 1978 Dec;62(6):1031-5.
- Sepkowitz KA.Pneumocystis carinii pneumonia among patients with neoplastic disease.
- Semin Respir Infect. 1992 Jun;7(2):114-21.
- Sepkowitz KA.Pneumocystis carinii pneumonia in patients without AIDS.Clin Infect Dis. 1993 Nov;17 Suppl 2:S416-22.
- Hughes WT, Feldman S, Aur RJ et al. Intensity of immunosuppressive therapy and the incidence of Pneumocystis carinii pneumonitis. Cancer. 1975 Dec;36(6):2004-9.
- Mathew BS, Grossman SA.Pneumocystis carinii pneumonia prophylaxis in HIV negative patients with primary CNS lymphoma. Cancer Treat Rev. 2003 Apr;29(2):105-19.
- Sepkowitz KA.Pneumocystis carinii pneumonia among patients with neoplastic disease. Semin Respir Infect. 1992 Jun;7(2):114-21.
- Kulke MH, Vance EA. Pneumocystis carinii pneumonia in patients receiving chemotherapy for breast cancer.
- Munoz P, Munoz RM, Palomo J et al Pneumocystis carinii infection in heart transplant recipients. Efficacy of a weekend prophylaxis schedule. Medicine (Baltimore). 1997 Nov;76(6):415-22.
- Kramer MR, Stoehr C, Lewiston NJ et al .Trimethoprim-sulfamethoxazole prophylaxis for Pneumocystis carinii infections in heart-lung and lung transplantation--how effective and for how long? Transplantation. 1992 Mar;53(3):586-9.
- Torre-Cisneros J, de la Mata M, Lopez-Cillero P et al. Effectiveness of daily low-dose cotrimoxazole prophylaxis for Pneumocystis carinii pneumonia in liver transplantation--an open clinical trial. Transplantation. 1996 Nov 27;62(10):1519-21.
- Leone V, Tommasini A, Ventura et al. Elective bone marrow transplantation in a child with X-linked hyper-IgM syndrome presenting with acute respiratory distress syndrome. Bone Marrow Transplant. 2002 Jul;30(1):49-52
- Chung JB, Armstrong K, Schwartz JS et al. Cost-effectiveness of prophylaxis against Pneumocystis carinii pneumonia in patients with Wegner's granulomatosis undergoing immunosuppressive therapy. Arthritis Rheum. 2000 Aug;43(8):1841-8
- Quan VA, Saunders BP, Hicks BH, Sladen GE.Cyclosporin treatment for ulcerative colitis complicated by fatal Pneumocystis carinii pneumonia. BMJ. 1997 Feb 1;314(7077):363-4.
- Yale SH, Limper AH.Pneumocystis carinii pneumonia in patients without acquired immunodeficiency syndrome: associated illness and prior corticosteroid therapy. Mayo Clin Proc. 1996 Jan;71(1):5-13.
- Hughes WT, Price RA, Sisko F et al . Protein-calorie malnutrition. A host determinant for Pneumocystis carinii infection. Am J Dis Child. 1974 Jul;128(1):44-52.
- Dutz W, Jennings-Khodadad E, Post C, Kohout E, Nazarian I, Esmaili H.Marasmus and Pneumocystis carinii pneumonia in institutionalised infants. Observations during an endemic. Z Kinderheilkd. 1974;117(4):241-5
- Yale SH, Limper AH.Pneumocystis carinii pneumonia in patients without acquired immunodeficiency syndrome: associated illness and prior corticosteroid therapy. Mayo Clin Proc. 1996 Jan;71(1):5-13.
- Roblot F, Godet C, Le Moal G et al. Analysis of underlying diseases and prognosis factors associated with Pneumocystis carinii pneumonia in immunocompromised HIV-negative patients. Eur J Clin Microbiol Infect Dis. 2002 Jul;21(7):523-31. Epub 2002 Jul 13
- Arend SM, Kroon FP, van't Wout JW.Pneumocystis carinii pneumonia in patients without AIDS, 1980 through 1993. An analysis of 78 cases. Arch Intern Med. 1995 Dec 11-25;155(22):2436-41.
- Thomas CF,LimperAH. Pneumocystis Pneumonia NEJM 2004; 350(24):2487-2498
- Stringer JR, Beard CB, Miller RF, Wakefield AE. A new name (Pneumocystis jiroveci) for Pneumocystis from humans. Emerg Infect Dis 2002;8:891–6.
- Maskell NA, Waine DJ, Lindley A et al Asymptomatic carriage of Pneumocystis jiroveci in subjects undergoing bronchoscopy: a prospective study. Thorax. 2003 Jul;58(7):594-7.
- Beard CB, Carter JL, Keely SP et al. Genetic variation in Pneumocystis carinii isolates from different geographic regions: implications for transmission. Emerg Infect Dis. 2000 May-Jun;6(3):265-72.
- Dumoulin A, Mazars E, Seguy N, Gargallo-Viola D, Vargas S, Cailliez JC, Aliouat EM, Wakefield AE, Dei-Cas E. Transmission of Pneumocystis carinii disease from immunocompetent contacts of infected hosts to susceptible hosts. Eur J Clin Microbiol Infect Dis. 2000 Sep;19(9):671-8.
- Vargas SL, Ponce CA, Gigliotti F, Ulloa AV, Prieto S, Munoz MP, Hughes WT. Transmission of Pneumocystis carinii DNA from a patient with P. carinii pneumonia to immunocompetent contact health care workers. J Clin Microbiol. 2000 Apr;38(4):1536-8.
- Miller RF, Ambrose HE, Wakefield AE.Pneumocystis carinii f. sp. hominis DNA in immunocompetent health care workers in contact with patients with P. carinii pneumonia. Clin Microbiol. 2001 Nov;39(11):3877-82
- Lundgren B, Elvin K, Rothman LP et al.Transmission of Pneumocystis carinii from patients to hospital staff. Thorax. 1997 May;52(5):422-4
- Dunagan DP, Rubin BK, Fasano MB. Pneumocystis carinii pneumonia in a child receiving ACTH for infantile spasms. Pediatr Pulmonol. 1999 Apr;27(4):286-9.
- Senggen Manoloff E, Francioli P, Taffé P, Risk for Pneumocystis carinii Transmission among Patients with Pneumonia: A Molecular Epidemiology Study. Emerging Infectious disease 2003; 9,(1): …..
- Limper AH, Offord KP, Smith TF, Martin WJ Pneumocystis carinii pneumonia. Differences in lung parasite number and inflammation in patients with and without AIDS. Am Rev Respir Dis. 1989 Nov;140(5):1204-9.
- Cruciani M, Marcati P, Malena M, Bosco O, Serpelloni G, Mengoli C.Meta-analysis of diagnostic procedures for Pneumocystis carinii pneumonia in HIV-1-infected patients. Eur Respir J. 2002 Oct;20(4):982-9.
- Pareja JG, Garland R, Koziel H. Use of adjunctive corticosteroids in severe adult non-HIV Pneumocystis carinii pneumonia. Chest. 1998 May;113(5):1215-2
- Gill CJ, Sabin LL, Tham J, Hamer DH. Reconsidering empirical cotrimoxazole prophylaxis for infants exposed to HIV infection. Bull World Health Organ. 2004 Apr;82(4):290-7.
- Nahimana A, Rabodonirina M, Zanetti G et al. .Association between a specific Pneumocystis jiroveci dihydropteroate synthase mutation and failure of pyrimethamine/sulfadoxine prophylaxis in human immunodeficiency virus-positive and -negative patients. J Infect Dis. 2003 Oct 1;188(7):1017-23. Epub 2003 Sep 26.
- Navin TR, Beard CB, Huang L et al Hightower A, Rimland D.Effect of mutations in Pneumocystis carinii dihydropteroate synthase gene on outcome of P carinii pneumonia in patients with HIV-1: a prospective study. Lancet. 2001 Aug 18;358(9281):545-9.
- Sullivan KM, Dykewicz CA, Longworth DL et al.Preventing opportunistic infections after hematopoietic stem cell transplantation: the Centers for Disease Control and Prevention, Infectious Diseases Society of America, and American Society for Blood and Marrow Transplantation Practice Guidelines and beyond. Hematology (Am Soc Hematol Educ Program). 2001;:392-421.
- Safrin S, Lee BL, Sande MA.Adjunctive folinic acid with trimethoprim-sulfamethoxazole for Pneumocystis carinii pneumonia in AIDS patients is associated with an increased risk of therapeutic failure and death. Infect Dis. 1994 Oct;170(4):912-7.
- Stegeman CA, Tervaert JW, de Jong PE, Kallenberg CG.Trimethoprim-sulfamethoxazole (co-trimoxazole) for the prevention of relapses of Wegener's granulomatosis. Dutch Co-Trimoxazole Wegener Study Group. N Engl J Med. 1996 Jul 4;335(1):16-20.
Vuoi citare questo contributo?