Gennaio 2004 - Volume VII - numero 1
M&B Pagine Elettroniche
Contributi Originali - Casi contributivi
Difetto
interatriale Ostium Secundum chiusura transcatetere
Cardiologia
Pediatrica,*Cardiologia Invasiva, **Terapia Intensiva
Cardiochirurgica, ***Pediatria,
A.O. San
Carlo Potenza
Parole
chiave: cardiopatie congenite - difetto interatriale – chiusura
transcatetere con dispositivo di Amplatz.
Key
Words: congenital heart disease – atrial septal defect –
transcatheter closure with Amplatzer device.
Dr. Ugo
Vairo
Cardiologia
Pediatrica
Azienda
Ospedaliera San Carlo
Via
Potito Petrone
85100
Potenza
Tel/Fax
0971-613035
E-mail:cardiopedsancarlo@tiscali.it
Transcatheter
closure of ostium secundum atrial septal defect with the Amplatzer
Septal Occluder was performed in 40 patients (from March 2000 to
December 2003) ranging in age from 2 to 67 years (median 23 years).
Accurate assessment by transesophageal echocardiography before
attempting the transcatheter closure is very important in order to
recognize the variability in morphology of the defects and also to
avoid any incorrect procedure such as device embolization, residual
shunting or atrioventricular valves incompetence. A rim of 5 mm is
mandatory around the defect except at the aortic level. Three
patients had an associated aneurysm of the atrial septum. Three
patients had multiple defects. The stretched diameter of the defects
that were closed ranged from 9 to 32 mm (median 17.6 mm) and device
sizes ranged from 10 to 34 mm (median 18 mm). The defects were closed
with a single device and in one case of the multiple defects are used
two devices. At 6 month follow-up 30/31 (96.7%) patients had complete
closure of their defects. The only complication encountered was a
device embolization in a 16-year-old girl with surgical removal.
The
Amplatzer Septal Occluder device has demonstrated excellent clinical
success in the closure of secundun atrial septal defect.
Riassunto
Per la
selezione dei pazienti adulti, oltre all'ecocardiografia
transtoracica, viene eseguito un esame ecocardiografico transesofageo
al fine di escludere, a priori, i casi con anatomia sfavorevole. Per
i pazienti in età pediatrica la valutazione con
ecocardiografia transesofagea viene effettuata in sala di
emodinamica. Tutte le procedure vengono realizzate in anestesia
generale.
Tre
pazienti presentavano un difetto singolo associato ad aneurisma del
setto interatriale e tre pazienti difetti multipli.
Il
diametro del difetto, calcolato con “stretched diameter”, variava
da 9 a 32 mm (media 17.6 mm) e la misura dei dispositivi utilizzati
da 10 a 34 mm (media 18 mm). Tutti i difetti sono stati chiusi
utilizzando un singolo device ad eccezione di una paziente con
difetti multipli in cui sono stati utilizzati due device di diverso
diametro.
A sei
mesi di follow up sono stati controllati 31 pazienti. In 30 casi è
stata ottenuta la chiusura completa del difetto; in una paziente
adulta si è verificata l'embolizzazione della protesi nel
tronco dell'arteria polmonare, rimossa chirurgicamente con
contestuale chiusura del difetto.
In 26
casi (86.6%) la chiusura è stata immediata, in 2 casi è
avvenuta entro le 24 h (93.3 %), in 1 caso ad un mese (96.6 %) e,
nell' altro caso al controllo a sei mesi.
Sono
stati raccolti dati preliminari riguardanti: 1) la dilatazione del
ventricolo destro (dimensione diastolica della cavità
ventricolare destra; rapporto tra quest'ultima ed il diametro
diastolico del ventricolo sinistro); 2) movimento paradosso del setto
interventricolare; 3) pressione sistolica in arteria polmonare.
I
pazienti sono stati suddivisi in quattro gruppi: I- fino a 10 anni;
II- da 10 a 20 anni; III- da 20 a 40 anni; IV- oltre 40 anni.
In linea
con i dati della letteratura, si conferma la sicurezza e l'efficacia
del dispositivo di Amplatz nella chiusura transcatetere del difetto
interatriale ostium secundum.
Anche nei
soggetti adulti si ottiene una significativa riduzione delle
dimensioni della cavità ventricolare destra e del movimento
paradosso del setto già ad un mese dalla procedura. Al
contrario, dopo i 40 anni la pressione sistolica in arteria polmonare
declina più lentamente tanto che, nella nostra casistica, i
valori sono superiori a 35 mmHg nel 45% dei pazienti, a sei mesi
dalla procedura.
La prima
esperienza di chiusura del difetto interatriale ostium secundum, in
corso di cateterismo cardiaco, risale al 1974(1,2).
Nonostante il fiorire di numerosi nuovi sistemi di occlusione,
l'esperienza clinica è rimasta a lungo limitata(3-17).
Il device che ha ottenuto un'affermazione ampia “worldwide” è
il sistema di Amplatz(18-24).
La chiusura transcatetere con dispositivo Amplatzer è, oggi,
da tutti ritenuta sicura ed efficace tanto da poterla considerare non
più un'alternativa alla tradizionale chirurgia ma metodica
di prima scelta nella chiusura del difetto interatriale ostium
secundum.
Difetti
del setto interatriale
La
pervietà del forame ovale rappresenta non tanto un difetto
del setto quanto la persistenza della comunicazione tra i due atri,
normalmente presente in epoca fetale. In genere è priva di
significato emodinamico.
Ildifetto interatriale “tipo fossa ovale” interessa in parte
o per intero il piano della fossa ovale. La denominazione “difetto
tipo ostium secundum” viene spesso utilizzata per identificare
questo tipo di difetto. Talvolta può riscontrarsi un aneurisma
del setto più o meno cribrato. Quando sono presenti più
fori si parla di difetti multipli o di setto multifenestrato.
Il
difetto interatriale alto “tipo vena cava superiore”, anche
se compreso nella regione dell'ostium secundum, è
localizzato al di fuori del limbus della fossa ovale in prossimità
dello sbocco della vena cava superiore. Raro come difetto ittavia, è
più frequente la comparsa di aritmie atriali, rappresentate
prevalentemente da episodi parossistici di fibrillazione atriale, con
tendenza, nel tempo, alla cronicizzazione (33,34).
La
mortalità, anche per difetti interatriali molto ampi, non è
superiore al 25%. Le complicanze potenzialmente letali, quali
l'ipertensione polmonare e lo scompenso cardiaco, tendono a
manifestarsi molto tardi per cui non è escluso che
concomitanti cause non cardiache possano, infine, essere responsabili
del decesso di questi pazienti (35).Le
lesioni del letto arteriolare polmonare, da iperafflusso polmonare
cronico, raramente raggiungono il grado di vasculopatia polmonare
irreversibile.
Alla
relativa benignità assegnata alla storia naturale di questa
malattia si contrappongono alcune rare eccezioni, caratterizzate
dalla comparsa di scompenso cardiaco già nei primi anni di
vita (36).
Si ritiene che l'insorgenza di scompenso cardiaco precoce sia
dovuto non all'entità dello shunt ma ad alterazioni
extracardiache, che possono interessare il polmone, il sistema
nervoso e l'apparato gastrointestinale (37).
Entro il
primo anno di vita, è possibile assistere anche alla chiusura
spontanea del difetto con una incidenza valutata tra il 14% ed il 22%
(38,39).Ciò
può avvenire solo per difetti con diametro inferiore ad 8
millimetri (40).
Gliaspetti fisiopatologici dipendono, soprattutto, dall'entità
dello shunt, dalla durata della sua persistenza e dalla reazione del
letto vascolare polmonare. Nei difetti ampi, con significativo shunt
sinistro-destro, l'atrio destro ed il ventricolo destro vanno
incontro a dilatazione per sovraccarico di volume. Si ha aumento
della gittata polmonare, ma non delle pressioni polmonari che
rimangono quasi sempre basse. Raramente, anche nelle forme inveterate
dell'adulto, si sviluppano vasculopatia ed ipertensione polmonare.
Sotto il
profilo clinico la malattia si caratterizza, in genere, per la
presenza di un soffio sistolico moderato, presente sul focolaio
polmonare, per lo sdoppiamento fisso del secondo tono, per un soffio
diastolico da iperafflusso transtricuspidale, per un volume cardiaco
lievemente aumentato con arco medio sinistro saliente alla
radiografia del torace e per un blocco di branca destro incompleto
all'elettrocardiogramma. Un elettrocardiogramma normale, tuttavia,
è presente nel 15-20% dei casi. Eccezionalmente i ritorni
venosi polmonari parziali possono non associarsi a difetto
interatriale. In questo caso, presentano una semiologia completamente
sovrapponibile a quella del difetto interatriale.
Mentre
sono da tutti accettati ed accertati i benefici della correzione del
difetto interatriale in età pediatrica (l'epoca ideale per
la correzione è l'età prescolare), in quanto, la
chiusura determina la normalizzazione dell'anatomia e della
funzione cardiaca, ricostituendo una normale aspettativa di vita
(32),
esistono tuttora dubbi e controversie sulla effettiva utilità
prognostica di chiudere, in ogni caso, il difetto interatriale
soprattutto dopo i 40 anni (28,41-42).
In generale vi è indicazione alla chiusura quando il difetto
determina sovraccarico ventricolare destro con un rapporto tra la
portata polmonare e la portata sistemica ≥ 1.5 (43).
La
tradizionale chiusura chirurgica del difetto interatriale è
sicura e con bassa incidenza di complicanze (44).
Attualmente la mortalità è inferiore all' 1% e solo
il 2% dei pazienti necessita di reintervento per shunt residuo. La
prognosi a lungo termine dei pazienti operati è eccellente con
il solo rischio, stimato in misura non trascurabile, di tachiaritmie
sopraventricolari in età adulta e a distanza dall'intervento.
La correzione chirurgica richiede il bypass cardisolato, si associa
abitualmente a drenaggio anomalo, in atrio destro, della vena
polmonare superiore destra che per la localizzazione del difetto può
essere, in genere, solo di tipo funzionale.
Il
difetto interatriale basso “tipo vena cava inferiore” è
situato sempre al di fuori del limbus della fossa ovale ma in
vicinanza dello sbocco della vena cava inferiore. E' un difetto
estremamente raro sia in forma isolata che associato ad altre
cardiopatie.
I difetti
situati in prossimità dello sbocco delle vene cave,
localizzati nella cosiddetta porzione sinusale degli atri, vengono
indicati anche con il termine di difetti tipo seno venoso.
Il
difetto interatriale “tipo seno coronario” è esteso
all'orifizio ed alla valvola del seno coronarico (valvola di
Tebesio).
L'atrio
comune, espressione della completa assenza del setto interatriale, è
di frequente riscontro negli isomerismi atriali.
Il
difetto ostium primum è tipico del canale
atrioventricolare.
L'incidenza
dei difetti interatriali, escludendo l'ostium primum del canale
atrioventricolare parziale, varia tra il 6% e l'11% di tutte le
malformazioni cardiache (26).
Essi rappresentano circa il 10% delle cardiopatie congenite presenti
alla nascita ed oltre il 40% di quelle diagnosticate dopo i 40 anni
di età(27,
28). Il sesso femminile è interessato da questa malattia
con una frequenza doppia rispetto al sesso maschile.
Dopo la
valvola aortica bicuspide, il difetto interatriale è la più
comune cardiopatia congenita riscontrabile in età adulta (29).
Il difetto più frequente (2/3 dei casi) è l' ostium
secundum (“tipo fossa ovale”).
Nei figli
di genitori portatori di difetto interatriale, l'incidenza della
malformazione è 37 volte superiore a quella della popolazione
in generale (30).La
ricorrenza per trasmissione materna è del 4-5%, quella paterna
dell'1.5% (31).
Dagli
studi, non numerosi, riguardanti la storia naturale del
difetto interatriale si evidenzia che la mortalità entro il
primo anno di vita è appena dello 0.1%. La quasi totalità
dei pazienti raggiunge la prima e la seconda decade di vita, in
genere in pieno benessere(28).
Poiché il difetto è più frequente nel sesso
femminile, è utile segnalare che le gravidanze sono, di
solito, ben sopportate.
L'assenza
o la scarsità di sintomi può indurre a ritardare la
diagnosi in qualche caso fino ad età avanzata (32).
Dopo la terza decade di vita, tuttavia, è più frequente
la comparsa di aritmie atriali, rappresentate prevalentemente da
episodi parossistici di fibrillazione atriale, con tendenza, nel
tempo, alla cronicizzazione (33,34).
La
mortalità, anche per difetti interatriali molto ampi, non è
superiore al 25%. Le complicanze potenzialmente letali, quali
l'ipertensione polmonare e lo scompenso cardiaco, tendono a
manifestarsi molto tardi per cui non è escluso che
concomitanti cause non cardiache possano, infine, essere responsabili
del decesso di questi pazienti (35).Le
lesioni del letto arteriolare polmonare, da iperafflusso polmonare
cronico, raramente raggiungono il grado di vasculopatia polmonare
irreversibile.
Alla
relativa benignità assegnata alla storia naturale di questa
malattia si contrappongono alcune rare eccezioni, caratterizzate
dalla comparsa di scompenso cardiaco già nei primi anni di
vita (36).
Si ritiene che l'insorgenza di scompenso cardiaco precoce sia
dovuto non all'entità dello shunt ma ad alterazioni
extracardiache, che possono interessare il polmone, il sistema
nervoso e l'apparato gastrointestinale (37).
Entro il
primo anno di vita, è possibile assistere anche alla chiusura
spontanea del difetto con una incidenza valutata tra il 14% ed il 22%
(38,39).Ciò
può avvenire solo per difetti con diametro inferiore ad 8
millimetri (40).
Gliaspetti fisiopatologici dipendono, soprattutto, dall'entità
dello shunt, dalla durata della sua persistenza e dalla reazione del
letto vascolare polmonare. Nei difetti ampi, con significativo shunt
sinistro-destro, l'atrio destro ed il ventricolo destro vanno
incontro a dilatazione per sovraccarico di volume. Si ha aumento
della gittata polmonare, ma non delle pressioni polmonari che
rimangono quasi sempre basse. Raramente, anche nelle forme inveterate
dell'adulto, si sviluppano vasculopatia ed ipertensione polmonare.
Sotto il
profilo clinico la malattia si caratterizza, in genere, per la
presenza di un soffio sistolico moderato, presente sul focolaio
polmonare, per lo sdoppiamento fisso del secondo tono, per un soffio
diastolico da iperafflusso transtricuspidale, per un volume cardiaco
lievemente aumentato con arco medio sinistro saliente alla
radiografia del torace e per un blocco di branca destro incompleto
all'elettrocardiogramma. Un elettrocardiogramma normale, tuttavia,
è presente nel 15-20% dei casi. Eccezionalmente i ritorni
venosi polmonari parziali possono non associarsi a difetto
interatriale. In questo caso, presentano una semiologia completamente
sovrapponibile a quella del difetto interatriale.
Mentre
sono da tutti accettati ed accertati i benefici della correzione del
difetto interatriale in età pediatrica (l'epoca ideale per
la correzione è l'età prescolare), in quanto, la
chiusura determina la normalizzazione dell'anatomia e della
funzione cardiaca, ricostituendo una normale aspettativa di vita
(32),
esistono tuttora dubbi e controversie sulla effettiva utilità
prognostica di chiudere, in ogni caso, il difetto interatriale
soprattutto dopo i 40 anni (28,41-42).
In generale vi è indicazione alla chiusura quando il difetto
determina sovraccarico ventricolare destro con un rapporto tra la
portata polmonare e la portata sistemica ≥ 1.5 (43).
La
tradizionale chiusura chirurgica del difetto interatriale è
sicura e con bassa incidenza di complicanze (44).
Attualmente la mortalità è inferiore all' 1% e solo
il 2% dei pazienti necessita di reintervento per shunt residuo. La
prognosi a lungo termine dei pazienti operati è eccellente con
il solo rischio, stimato in misura non trascurabile, di tachiaritmie
sopraventricolari in età adulta e a distanza dall'intervento.
La correzione chirurgica richiede il bypass cardisolato, si associa
abitualmente a drenaggio anomalo, in atrio destro, della vena
polmonare superiore destra che per la localizzazione del difetto può
essere, in genere, solo di tipo funzionale.
opolmonare
e l'atriotomia destra. L'approccio sia per sternotomia mediana
(il più usato), sia sottomammario toraco-laterale o
minitoracotomico determina cicatrici spesso evidenti che possono
avere rilevanti conseguenze sotto il profilo psico-relazionale
soprattutto in adolescenti e giovani adulti, in genere asintomatici
al momento dell'indicazione al trattamento (45).
La tecnica chirurgica mediante robotica è tutt'ora in fase
di sperimentazione clinica (46).
La storia
“innaturale” (postchirurgica) del difetto interatriale è
fortemente condizionata dall'età alla correzione. Se la
chiusura del difetto viene eseguita nei primi anni di vita, o
nell'adolescenza, la sopravvivenza è del tutto
sovrapponibile a quella di una popolazione normale di controllo. La
chiusura del difetto in età giovanile (prima dei 25 anni)
ricostituisce, comunque, una normale aspettativa di vita. Al
contrario la sopravvivenza a lungo termine nei pazienti operati fra
25 e 40 anni è buona ma inferiore a quella della
popoopolmonare e l'atriotomia destra. L'approccio sia per
sternotomia mediana (il più usato), sia sottomammario
toraco-laterale o minitoracotomico determina cicatrici spesso
evidenti che possono avere rilevanti conseguenze sotto il profilo
psico-relazionale soprattutto in adolescenti e giovani adulti, in
genere asintomatici al momento dell'indicazione al trattamento
(45).
La tecnica chirurgica mediante robotica è tutt'ora in fase
di sperimentazione clinica (46).
La storia
“innaturale” (postchirurgica) del difetto interatriale è
fortemente condizionata dall'età alla correzione. Se la
chiusura del difetto viene eseguita nei primi anni di vita, o
nell'adolescenza, la sopravvivenza è del tutto
sovrapponibile a quella di una popolazione normale di controllo. La
chiusura del difetto in età giovanile (prima dei 25 anni)
ricostituisce, comunque, una normale aspettativa di vita. Al
contrario la sopravvivenza a lungo termine nei pazienti operati fra
25 e 40 anni è buona ma inferiore a quella della popolazione
generale e la mortalità tardiva risulta significativamente
aumentata in pazienti con età all'intervento ≥ 40 anni. In
pazienti operati tardivamente, scompenso cardiaco, fibrillazione
atriale ed embolie cerebrali sono riportate con un'incidenza
significativamente aumentata(32,44).
In assenza di intervento l'attesa di vita è inferiore a
quella della popolazione generale, ma la sopravvivenza si protrae,
comunque, fino all'età adulta. Con il passare del tempo,
l'intervento acquista sempre più il carattere di “intervento
palliativo” (47).
Chiusura
percutanea
Il
dispositivo di Amplatz è costituito da un doppio disco
realizzato con fili di nitinol (55% Nichel e 45% Titanio) tra loro
intrecciati. Al centro è presente, per connettere i due
dischi, un vero stent, che “riempie” e quindi occupa il difetto.
I dischi contengono Dacron che favorisce in pochissimo tempo la
deposizione di fibrina e la completa occlusione del difetto (Fig
2).(48)
La
procedura di impianto viene eseguita in anestesia generale con
intubazione del paziente. Un ruolo essenziale, in tutte le fasi della
procedura, è svolto dall'ecocardiografia transesofagea. Essa
detta le indicazioni alla “fattibilità”(diametro del
difetto, misura dei rims settali, ritorni venosi, anatomia atriale),
guida l'operatore nel posizionamento della protesi a cavallo del
difetto e nel successivo rilascio della stessa, permette una
immediata valutazione del risultato (“tenuta” del device dopo
rilascio, shunt residuo) (Fig.
1,3,4).
Dall'ottimale utilizzo e dall'esatta interpretazione dei dati
forniti dall'ecocardiografia transesofagea dipende in larga parte
la riuscita della procedura. Alcuni Autori riportano l'impiego di
altri sistemi di monitoraggio durante la procedura quale ad esempio
l'ecocardiografia intracavitaria(49).
Quest'ultima consentirebbe di evitare l'uso dell'ecocardiografia
transesofagea e quindi la necessità dell'intubazione.
Ai
pazienti viene somministrato antibiotico a largo spettro prima e per
24/48 ore dopo la procedura. Per sei mesi, in attesa della completa
endotelizzazione del dispositivo, il paziente effettuerà
terapia antiaggregante con aspirina alla dose di 5 mg/Kg/die e
profilassi dell'endocardite batterica. Nei pazienti adulti sono
sufficienti 100 mg di ASA/die (Tabella
2). Il follow-up prevede una radiografia del torace in AP ed LL
ed un esame ecocardiografico transtoracico il giorno successivo alla
procedura (Fig.
5). In questa stessa giornata, in assenza di complicanze, il
paziente può essere dimesso.
I
controlli clinici successivi, che prevedono l'esecuzione di un
elettrocardiogramma standard ed un esame ecocardiografico
transtoracico, verranno programmati ad 1 mese, 6 mesi e ad 1 anno
dalla procedura. (Tabella
3)
Casistica
Per la
selezione dei pazienti adulti, oltre all'ecocardiografia
transtoracica, è stato effettuato un esame ecocardiografico
transesofageo al fine di escludere, a priori, i casi con anatomia
sfavorevole. Per i pazienti in età pediatrica la valutazione
con ecocardiografia transesofagea è stata eseguita in sala di
emodinamica.
13
pazienti (24.5%), 4 bambini (30.8%) (età compresa tra 2 e 10
anni, media 4,5 anni) e 9 adulti (69.2%) (età compresa tra 18
e 53 anni, media 29.8 anni) sono stati ritenuti non idonei alla
chiusura transcatetere per anatomia sfavorevole del difetto e,
pertanto, sono stati affidati al chirurgo.
40
Pazienti (75.5%), 31 femmine e 9 maschi di età compresa tra 2
e 67 anni (media 23 anni) sono stati sottoposti a chiusura
transcatetere del difetto interatriale ostium secundum con
dispositivo di Amplatz.
Tutte le
procedure sono state realizzate in anestesia generale.
Tre
pazienti presentavano un difetto singolo associato ad aneurisma del
setto interatriale e tre pazienti avevano difetti multipli. In una
paziente di 14 anni veniva evidenziato all'ecocardiografia
transesofagea e confermato angiograficamente il ritorno venoso
anomalo della vena polmonare superiore destra in vena cava superiore.
La chiusura del difetto interatriale veniva praticata nel corso di un
successivo cateterismo cardiaco dopo aver richiesto ed ottenuto un
nuovo consenso dai genitori.
Il
diametro del difetto, calcolato con “stretched diameter”, variava
da 9 a 32 mm (media 17.6 mm) e la misura dei dispositivi utilizzati
da 10 a 34 mm (media 18 mm). Tutti i difetti sono stati chiusi
utilizzando un singolo device ad eccezione di una paziente con
difetti multipli in cui sono stati utilizzati due device di diverso
diametro.
A sei
mesi di follow up sono stati controllati 31 pazienti. In 30 casi è
stata ottenuta la chiusura completa del difetto; in una paziente
adulta, nella quale è stato utilizzato un dispositivo di 34
mm, si è verificata l'embolizzazione della protesi in
arteria polmonare a 30' circa dalla fine della procedura.
L'Amplatzer è stato rimosso dal chirurgo, che ha provveduto,
comunque, alla chiusura con patch del difetto interatriale.
In 26
casi (86.6%) la chiusura è stata immediata, in 2 casi è
avvenuta entro le 24 h (93.3 %), in 1 caso ad un mese (96.6 %) e,
nell' altro caso al controllo a sei mesi (Tabella
4).
La
degenza ospedaliera è stata, in media, di due giorni e mezzo.
Un
paziente di 46 anni ha mostrato, al controllo ad un mese,
fibrillazione atriale, regredita prima spontaneamente e
successivamente con Amiodarone. Sotto terapia anticoagulante ha
mostrato, al controllo a tre mesi, la ripresa dell'aritmia
nonostante il farmaco antiaritmico. Ad 1 anno dalla procedura il
paziente è in ritmo sinusale, in terapia con Propafenone.
I
pazienti sono stati suddivisi in quattro gruppi: I gruppo - fino a 10
anni; II gruppo - da 10 a 20 anni; III gruppo - da 20 a 40 anni; IV
gruppo - oltre 40 anni (Tabella
5).
Sono
stati raccolti dati preliminari ( follow-up a sei mesi) riguardanti
:1)la dilatazione del ventricolo destro (dimensione diastolica della
cavità ventricolare destra; rapporto tra quest'ultima ed il
diametro diastolico del ventricolo sinistro); 2) movimento paradosso
del setto interventricolare; 3) pressione sistolica in arteria
polmonare (calcolata al Doppler CW e derivata dal rigurgito
tricuspidale). I risultati sono riportati in Tabella
6.
Discussione
L' 80%
circa dei pazienti con difetto interatriale ostium secundum isolato
può essere sottoposto a chiusura percutanea. Nella nostra
esperienza il 24.5% dei pazienti (70% adulti) è stato
indirizzato alla chirurgia.
La
percentuale di successo (assenza di shunt residuo ad 1 anno) è
alta (98 %).
Le
complicanze, anche se notevolmente ridotte in virtù delle
migliorate esperienze tecniche, non sono trascurabili e vanno
pertanto considerate. Documentate in recenti ed ampie casistiche
(50,51),
le più importanti sono: embolizzazione del dispositivo
(1.6-2%), aritmie sopraventricolari (1.6-8%), insufficienza mitralica
(1.5%), stroke/TIA (0.5%), formazioni trombotiche formatesi
precocemente sul dispositivo (1-2%). L'incidenza di complicanze,
cosiddette maggiori e minori, non è, tuttavia, superiore al
6%. Vengono purtroppo riferiti anche episodi di morte improvvisa,
apparentemente non collegabili all'impianto della protesi (52-53).
In linea
con i dati della letteratura, anche nella nostra esperienza si
conferma la sicurezza e l'efficacia del dispositivo di Amplatz
nella chiusura del difetto interatriale ostium secundum con il 96.8%
di occlusione completa a 6 mesi dalla procedura. Nei soggetti adulti
di età superiore a 40 anni (19.3%), il dato di confronto più
rilevante con i gruppi di pazienti fino a 10 anni (54.8%), da 10 a 20
(9.7%) e da 20 a 40 (16.2%), è dato dalla pressione sistolica
in arteria polmonare che declina più lentamente, tanto che,
nella nostra casistica, i valori sono superiori a 35 mmHg nel 45% dei
pazienti a sei mesi dalla procedura.
La
degenza ospedaliera è molto breve (54).
Per
essere alternativo alla tradizionale chirurgia, un dispositivo di
chiusura percutanea deve quanto meno rispondere ai seguenti
requisiti: elevata percentuale di chiusura, bassa incidenza di
complicanze maggiori, facilità di impianto (55).
Formigari
et al (56),
in un recente confronto tra chiusura chirurgica (sternotomia mediana,
chirurgia mini-invasiva) e chiusura percutanea, in una popolazione
pediatrica, ha rilevato una minore incidenza di complicanze con
quest'ultima procedura. I tempi di degenza sono stati molto più
brevi per la procedura interventistica (in media tre giorni), mentre
i costi sia della procedura chirurgica che percutanea sono
sostanzialmente sovrapponibili a causa dell'elevato costo del
dispositivo di Amplatz (circa 9.000 Euro). Va inoltre considerato che
la tecnica percutanea è di gran lunga più accettata,
per un evidente minore impatto fisico ed emotivo (45).
Inconclusione la chiusura transcatetere del difetto interatriale
ostium secundum con dispositivo di Amplatz è ormai da tutti
ritenuta una procedura molto sicura ed efficace.
In virtù
dell'alta percentuale di chiusura, della facilità e rapidità
di impianto, della bassa incidenza di complicanze, del basso grado di
impatto fisico ed emotivo sul paziente (assenza di circolazione
extracorporea, assenza di cicatrici, tempi ridotti di ricovero
ospedaliero senza necessità di “passaggio” in terapia
intensiva), si considera la chiusura percutanea transcatetere del
difetto interatriale ostium secundum la metodica di prima scelta.
Andranno affidati comunque al chirurgo tutti quei casi che, per la
sede e le dimensioni del difetto, non si prestano alla chiusura
percutanea (difetti con anatomia sfavorevole).
Ringraziamenti
Bibliografia
1) King
TD, Mills NL. Nonoperative closure of atrial septal defect. Surgery
1974; 75: 383-388
2) King
TD, Thompson SL, Steiner C, Mills NL. Secundum atrial septal defect:
nonoperative closure during cardiac catheterization. JAMA
1986;235:2506-9
3)
Rashkind W. Transcatheter treatment of congenital heart disease.
Circulation 1983;67:711-716
4)
Sievert H, Bussmann WD, Kaltenbach M. Closure of left-to-right shunts
by catheter technique. In Invasive cardiovascular therapy edited by
Hilger HH and Hombach V, Rashkind WJ. 1987 Martinus Nijhoff
Publishers; 25-38
5) Lock
JE, Cockerham JT, Keane JF, Finley JP, Wakely PE, Fellows KE.
Transcatheter umbrella closure of congenital heart defects.
Circulation 1987;75:593-599
6)
Rashkind WJ, Mullins CE, Hellembrand WE, Tait MA. Non surgical
closure of patent ductus arteriosus: clinical application of the
Rashkind PDA occluder system. Circulation 1987; 75:583-92
7)
Ballerini L, Mullins CE, Cifarelli A, Pasquini L, Vairo U, Bermudez
Canete R, Picchio FM, Bonvicini M, Marzocchi A, Piovaccari G.
Chiusura non chirurgica del dotto arterioso pervio in età
pediatrica con dispositivo di Rashkind a doppio ombrello. G Ital
Cardiol 1990;20:805-809
8) Lock
JE, Rome JJ, Davis R, Van Praagh S, Perry SB, Van Praagh R, Keane JF.
Transcatheter closure of atrial septal defect. Experimental studies.
Circulation 1989;79:1091-1099
9) Rome
JJ, Keane JF, Perry SB, Spevak PJ, Lock JE. Double-umbrella closure
of atrial defects. Initial clinical applications. Circulation
1990;82:751-758
10)
Prieto LR, Foreman CK, Cheatham JP, Latson LA. Intermediate-term
outcome of transcathheter secundum atrial septal defect closure using
the Bard Clamshell septal umbrella. Am J Cardiol 1996;78:1310-1312
11) Justo
RN, Nykanen DG, Boutin C, McCrindle B, Freedom RM, Benson LN.
Clinical impact of transcatheter closure of secundum atrial septal
defects with the double umbrella device. Am J Cardiol 1996;77:889892
12)
Sideris EB, Sideris SE, Thanopoulos BD, Ehly RL, Fowlkes JP. Am J
Cardiol 1990;66:1524-1526
13) Das
SG, Voss G, Jarvis G, Wyche K, Gunther R, Wilson RF. Experimental
atrial septal defect closure with a new, transcatheter,
self-centering device. Circulation 1993;88 part 1:1754-1764
14) Babic
UU, Grujicic S, Popovic Z, Djurisic Z, Vucinic M, Pejcic P.
Double-umbrella device for transvenous closure of patent ductus
arteriosus and atrial septal defect: first experience. Journal of
Interventional Cardiology 1991;4:283-294
15)
Hausdorf G, Kaulitz R, Paul T, Carminati M, Lock J. Transcatheter
closure of atrial septal defect with a new flexible, self-centering
device (the STARFlex Occluder). Am J Cardiol 1999;84:1113-1116
16)
Sievert H, Wilson N, Trepels T. Catheter closure of patent forame
ovale: experience with the new Helex occluder. Eur Heart J 2001
(Abstract Supplement);22:42
17) Zahn
EM, Wilson N, Cutright W, Latson LA. Development and testing of the
Helex Septal Occluder, a new expanded polytetrafluoroethylene atrial
septal defect occlusion system. Circulation 2001;104:711-716
18)
Sharafuddin MJA, Gu X, Titus JL, Urness M, Cervera-Ceballos JJ,
Amplatz K. Transvenous closure of secundum atrial septal defects.
Preliminary results with a new self-expanding nitinol prosthesis in a
swine model. Circulation 1997;95:2162-2168
19)
Masura J, Gavora P, Formanek A, Hijazi Ziyad M. Transcatheter closure
of secundum atrial septal defects using the new self-centering
Amplatzer Septal Occluder. Cathet Cardiovasc Diagn 1997;42:388-393
20) Du
ZD, Hijazi ZM, Kleinman CS, Silverman NH, Larntz K. Comparison
between transcatheter and surgical closure of secundum atrial septal
defect in children and adult. J Am Coll Cardiol 2002;39:1836-1844
21) Cao
QL, Du ZD, Joseph A, Koenig P, Heitschmidt M, Rhodes J, Hijazi ZM.
Immediate and six-month results of the profile of the Amplatzer
Septal Occluder as assessed by transesophageal echocardiography. Am J
Cardiol 2001;88:754-759
22)
Waight DJ, Bacha EA, Kahana M, Cao QL, Heitschmidt M, Hijazi ZM.
Catheter therapy of swiss cheese ventricular septal defects using the
Amplatzer Muscular VSD Occluder. Cathet Cardiovasc Intervent
2002;55:355-361
23) Hakim
F, Madani A, Hawelech A, Tarawneh W, Hiari A, Cao QL, Hijazi ZM.
Catheter closure of perimembranous ventricular septal defect using
the new Amplatzer Membranous VSD Occluder: initial clinical
experience. PICS September 22-25,2002 Chicago,Illinois. Cathet
Cardiovasc Intervent 2002;57:99
24) Du
ZD, Cao QL, Joseph A, Koenig P, Heischmidt M, Waight DJ, Rhodes J,
Brorson J, Hijazi ZM. Transcatheter closure of patent foramen ovale
in patients with paradoxical embolism: intermediate-term risk of
recurrent neurological events. Cathet Cardiovasc Intervent
2002;55:189-194
25)
Calabrò R, Caso P, de Leva F, Iacono C, Vairo U. Difetti del
setto interatriale. In Ecocardiografia transesofagea e transtoracica
delle cardiopatie congenite. Ed. Piccin-Padova. 1998; pag.123-135
26)
Valdez-Cruz LM, Cayre RO. Atrial septal defects. Echocardiographic
diagnosis of congenital heart disease. An embryologic and anatomic
approach. Lippincott-Raven. 187-199
27)
Hoffman JIE Incidence of congenital heart disease. Postnatal
incidence. Pediatr Cardiol 1995;16:103-113)
28)
Campbell M.Natural history of atrial septal defects. Br Heart J
1970;32:820-826
29) Shan
D, Azhar M, Oakley CM, Cleland JGF, Nihoyannopoulos P. Natural
history of secundum atrial septal defect in adults after medical or
surgical treatment: a historical prospective study. Br Heart J
1994;71:224-228
30) Nora
JJ, Dodd PF, McNamara DG et al. Risk to offspring of parents with
congenital heart defects. JAMA 1969;209:2052
31) Nora
JJ, Nora AH. Update on counseling the family with a first-degree
relative with a congenital heart defect. Am J Med Genet
1988;29:137-142.
32)
Favilli S, Zuppiroli A, Mori F, Santoro G, Manetti A, Dolara A. Il
paziente con difetto interatriale riconosciuto in età adulta
deve essere sempre operato? G Ital Cardiol 1999;29:1302-1307
33)
Gatzoulis MA, Freeman MA, Siu SC, Webb GD, Harris L. Atrial
arrhythmia after surgical closure of atrial septal defects in adults.
N Engl J Med 1999;340:839-846
34)
Calabrò R, Pacileo G, Pisacane C, Russo MG. Fisiopatologia e
funzione ventricolare delle cardiopatie in età pediatrica.
Valutazione ecocardiografica. Difetto interatriale. Capitolo
6:145-161; Piccin Nuova Libraria-Padova;1997
35)
Magilligan DJ, Lam CR, Lewis JW. Late results of atrial septal defect
repair in adults. Arch Surg 1978;113:1245-1251
36)
Gordovilla-Zurdo G, Cabo-Salvator J. Surgery of symptomatic
interauricular communication in the first year of life. An Esp
Pediatr 1988;29:94-98
37)
Rudolph AM. Atrial septal defect. In Rudolph AM (ed). Congenital
disease of the heart. Chicago, Year Book Medical Publisher, 1974;264
38)
Cockerham JT, Martin TC, Gutierrez FR. Spontaneous closure of
secundum atrial defect in infant and young children. Am J Cardiol
1983;52:1267-71
39)
Ghisla RP, Hannon DW, Meye RA, Kaplan S. Spontaneous closure of
isolated secundum atrial septal defects in infants: an
echocardiographic study. Am Heart J 1985;109:1327-33
40)
Radzik D, Davignon A, Van Doesburg N. Predictive factors for
spontaneous closure of atrial septal defects diagnosed in the first 3
months of life. J Am Coll Cardiol 1993;22:851-3
41) Webb
G. Do patients over 40 years of age benefit from closure of an atrial
septal defects? Heart 2001;85:249-250
42)
Jemielity M, Dyszkiewicz W, Paluszkiewicz L, Perek B, Buczkowski P,
Ponizynski A. Do patients over 40 years of age benefit from surgical
closure of an atrial septal defect? Heart 2001;85:300-303
43)
Konstantinides S, Geibel A, Olschewski M. A comparison of surgical
and medical therapy for atrial septal defect in adult. N Engl J Med
1995;333:469-473
44)
Murphy JC, Gersh BJ, McGoon MD, Mair DD, Porter CJ, Ilstrup DM,
McGoon DC, Puga FJ, Kirklin JW, Danielson GK. Long-term outcome after
surgical repair of isolated atrial septal defect. N Engl J Med
1990;323:1645-1650
45)
Visconti KJ, Bichell DP, Jonas RA, Newburger JW, Bellinger DC.
Developmental outcome after surgical versus interventional closure of
secundum atrial septal defect in children. Circulation 1999;100(19
Suppl):II 145-150
46)
Torraca L, Ismeno G, Alfieri O. Totally endoscopic atrial septal
defect closure using robotic techniques: report of two cases. It
Heart J 2000;1:698-701
47)
Abbate M, Lomeo A, Patanè L, Urso E, Gentile M, Motta D,
Guarnera S, D'Arrigo G, Greco G. La comunicazione interatriale in
età adulta: risultati chirurgici. Il Cuore Vol. VII n. 6
Novembre/Dicembre 1990;701-707
49)
Hijazi ZM, Wang Z, Cao QL, Koenig P, Waght D, Lang R. Transcatheter
closure of atrial septal defect and patent foramen ovale under
intracardiac echocardiographic guidance. Cathet Cardiovasc Intervent
2001;52:194-199
50)
Wilkinson JL. Can transcatheter closure of atrial septal defect be
regarded as a “standard” procedure? Cardiol Young 1999;9:458-461
51)
Chessa M, Butera G, Bini RM, Rosti L, Drago M, Pomè G,
Giamberti A, Carminati M, Yousef R. Complications associated with
atrial septal defect transcatheter closure. Eur Heart J 2001
(Abstract Supplement);22:470
52)
Piéchaud JF. Transcatheter closure of atrial septal defects
with the Amplatzer Septal Occluder. 3rd International Workshop on
Interventional Pediatric Cardiology. San Donato Milanese – Italy
March 2001
53)
Carminati M, Butera GF, Bini RM, Chessa M, Drago M. Transcatheter
closure of atrial septal defects with different size and morphology:
matching device to septal anatomy. 3rd International Workshop on
Interventional Pediatric Cardiology. San Donato Milanese-Italy March
2001
54) Vairo
U, Pucci E, Fiorilli R, Argento G, Adurno G, Fasano ML, Di Segni M,
Violini R. Transcatheter closure of atrial septal defect with
Amplatzer Septal Occluder. Ital Heart J 2001;2 Suppl 4:27
55)
Aggetti A, Carano N, Barone A, Tchana B, Squarcia A, Squarcia U.
Chiusura del difetto interatriale mediante cateterismo cardiaco
interventistico: risultati con un nuovo dispositivo. Riv Ital Pediatr
2001;27:331-336
56)
Formigari R, Di Donato RM, Mazzera E, Carotti A, Rinelli G, Parisi F,
Pasquini L, Ballerini L. Minimally invasive or interventional repair
of atrial septal defects in children: experience in 171 cases and
comparison with conventional strategies. J Am Coll Cardiol
2001;37:1707-1712
Controindicazioni
alla chiusura percutanea
- anomalie associate che richiedono chirurgia
- assenza dei rims settali superiore ed infero-posteriore
- difetti multipli ed ampi
- distorsioni dell'anatomia atriale
- trombosi atriale, trombosi vena cava inferiore
- endocardite, ogni infezione < 1 mese dalla procedura
- neoplasie con aspettativa di vita inferiore a 3 anni
- impossibilità ad ottenere il consenso informato
![]()
Terapia | Profilassi
endocardite batterica | |
Bambini | Antibiotico
a largo spettro
24 h
prima e per 24/48 h dopo la procedura
Acido
acetilsalicilico
5
mg/Kg/die
per
almeno 6 mesi dopo la procedura | Per
almeno 6 mesi dopo la procedura |
Adulti | Antibiotico
a largo spettro
24 h
prima e per 24/48 h dopo la procedura
Acido
acetilsalicilico
100
mg/die
per
almeno 6 mesi dopo la procedura | Per
almeno 6 mesi dopo la procedura |
Controlli | Indagini | |
A 24 h
dalla procedura |
| |
a 1
mese
a 6
mesi
a 1
anno
dalla
procedura | { |
|
Totale
Pazienti | 31 | |||
Sesso | F
23 | |||
M
8 | ||||
Età | da 2 a
67 anni (mediana 8 aa; media 20 aa) | |||
Immediata | 24h | 1
mese | 6
mesi | |
Chiusura
completa | 26
(86.6%) | 28
(93.3%) | 29
(96.6%) | 30 |
Trivial
shunt | 3
(10.%) | 1
(3.4%) | 0 | 0 |
Minimo
shunt | 1
(3.4%) | 1(3.4%) | 1
(3.4%) | 0 |
Shunt
moderato | 1 | embolizzazione | ||
N.
pazienti | Età | |
Gruppo
I | ||
fino
a 10 aa | 17 | 2-10
(media 5,3 aa) |
Gruppo
II | ||
da
10 a 20 aa | 3 | 11-18
(media 14,3 aa) |
Gruppo
III | ||
da
20 a 40 aa | 5 | 23-40
(media 31,6 aa) |
Gruppo
IV | ||
oltre
40 aa | 6 | 45-67
(media 53,8 aa) |
DVDx
(mm) | VD/VS | MPS | PSAP
(mmHg) | ||
Pre | 19.5 | 0.64 | 11pz | 31.2 | |
Gruppo
I | 1m | 15.2 | 0.44 | 1 pz | 22.9 |
6m | 14.2 | 0.41 | 0 pz | 21.3 | |
Pre | 27.7 | 0.73 | 3 | 34.5 | |
Gruppo
II | 1m | 24.5 | 0.59 | 0 | 30.5 |
6m | 19.7 | 0.47 | 0 | 24.2 | |
Pre | 32.2 | 0.76 | 5 | 38
(3/5>35mmHg) | |
Gruppo
III | 1m | 24.4 | 0.56 | 1 | 30
(2/5>35mmHg) |
6m | 22.2 | 0.47 | 1 | 28
(2/5>35mmHg) | |
Pre | 27.8 | 0.74 | 4 | 46.6
(6/6>35mmHg) | |
Gruppo
IV | 1m | 26 | 0.57 | 2 | 39.3
(4/6>35mmHg) |
6m | 24.5 | 0.52 | 0 | 36.6
(3/6>35mmHg) |
DVDx =
dimensione diastolica della cavità ventricolare destra; VD/VS
= rapporto tra le dimensioni del ventricolo destro ed il diametro
diastolico del ventricolo sinistro; MPS = movimento paradosso del
setto; PSAP = pressione sistolica arteria polmonare
Figura 1a)
| Figura 1b)
|
a)
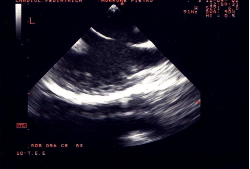
difetto del setto interatriale tipo ostium secundum. Sezione
ecocardiografica transesofagea. Il difetto è visualizzato
secondo il diametro longitudinale;
b) piano
trasverso. Entità del flusso attraverso il difetto
visualizzato al color Doppler.

Dispositivo
di Amplatz‚ per la chiusura del difetto interatriale ostium
secundum
Figura
3a)
| Figura
3b)
 | Figura
3c)
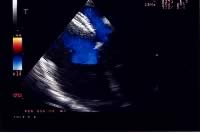 |
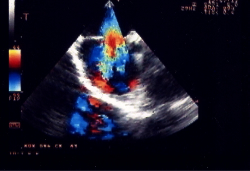
a)
sezione ecocardiografica transesofagea. Piano trasverso. La protesi
di Amplatz, ancora agganciata al delivery system, ricopre il difetto
su entrambi i lati;
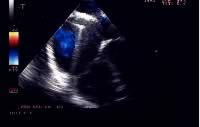
b)
la protesi, autocentrante, nel momento in cui viene sganciata dal
delivery system;
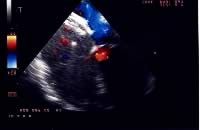
c)
il device, in sede, ha occluso completamente il difetto, già
nell'immediato post-procedura.
Figura
4a)
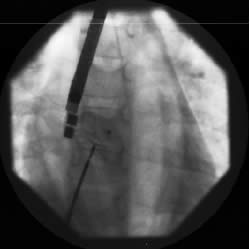 | Figura
4b)
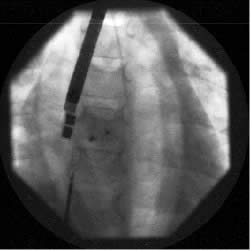 |
Immagini
angiografiche che documentano il posizionamento della protesi sul
difetto interatriale (a), lo sgancio e l' autocentraggio (b).
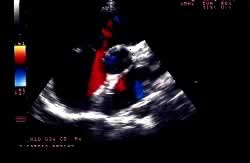
Ecocardiografia
transtoracica eseguita a 24 ore dalla procedura che documenta la
perfetta tenuta della protesi e l'assenza di shunt interatriale.
Vuoi citare questo contributo?