Dicembre 2007 - Volume X - numero 10
M&B Pagine Elettroniche
Il punto su
La
terapia antibiotica inalatoria nel paziente con fibrosi cistica
1Clinica
Pediatrica e Centro Regionale Fibrosi Cistica, IRCCS Burlo Garofolo,
Trieste.
2Centro
Regionale Fibrosi Cistica, Ospedale Meyer, Firenze.
Indirizzo
per corrispondenza: jennybua@gmail.com
INTRODUZIONE
Lo
Pseudomonas Aeruginosa (PA) è il patogeno più
frequentemente isolato nell'escreato o nel liquido di lavaggio
broncoalveolare (BAL) dei pazienti affetti da fibrosi cistica (FC),
con frequenze che variano dal 30% nei bambini fra i 2-5 anni di vita
fino all'80% nei pazienti adulti1.
La sua
presenza e crescita sarebbero favorite dalla maggiore viscosità
delle secrezioni bronchiali e dalla ridotta clearance muco-ciliare
conseguenti all'alterazione del regolatore transmembrana della
fibrosi cistica (CFTR). Inoltre, l'alterazione del CFTR sarebbe
responsabile di una maggiore affinità delle cellule epiteliali
dell'albero bronchiale verso il germe, agendo forse attraverso
un'alterazione nel numero di recettori specifici (adesine).
L'infezione sarebbe inoltre facilitata dalla mancata adesione di un
peptide neutralizzante il PA, conseguente alla elevata concentrazioni
di sali del secreto bronchiale del paziente affetto da FC2,3.
Esistono
due ceppi di PA, quelli non-mucoidi e quelli mucoidi.
I primi
vengono isolati più frequentemente nella prima infezione,
mentre l'isolamento dei secondi aumenta con la progressione
dell'infezione. I ceppi non mucoidi sono caratterizzati da maggiore
responsività alla terapia antibiotica e dalla presenza in
basse concentrazioni4. La trasformazione dei ceppi
non-mucoidi in mucoidi per meccanismi di pressione selettiva,
comporta lo sviluppo di un rivestimento di esopolisaccaride alginato,
che conferisce maggiore resistenza sia alla penetrazione degli
antibiotici che alla fagocitosi5,6 spiegando così
la impossibilità a eradicare lo PA nei colonizzati cronici. La
trasformazione dello PA dal fenotipo non-mucoide a mucoide sembra
possa già avvenire entro 3 mesi dall'iniziale infezione7.
Seppure
più raramente, l'acquisizione di ceppi mucoidi può
avvenire per contagio fra pazienti10.
E'
ormai dimostrato come la infezione cronica da PA sia fortemente
associata a una progressione del danno polmonare8. Essere
colonizzati in maniera cronica dallo PA aumenta infatti il rischio di
ridotta funzionalità polmonare e di peggioramento dello score
radiologico9, di ospedalizzazione e necessità di
cicli di terapia endovena10 e soprattutto di
mortalità11,12.
Perché
la terapia antibiotica inalatoria?
Considerato
il ruolo fondamentale dello PA nella progressione del danno
polmonare, la terapia antibiotica diretta contro questo patogeno è
uno strumento fondamentale nella gestione della FC. Le vie di
somministrazione possono essere orale, endovenosa o inalatoria. La
terapia antibiotica inalatoria è stata proposta con lo scopo
di raggiungere alte concentrazioni nel farmaco a livello polmonare,
riducendo così quelle sieriche e di conseguenza gli effetti
collaterali sistemici (i.e. nefrotossicità e ototossicità
degli aminoglicosidici). La via inalatoria offre inoltre ulteriori
vantaggi quali la più facile gestione domiciliare, aspetto di
primaria importanza nel migliorare la qualità di vita del
paziente con FC. Uno studio inglese di “cost-effectiveness”
inoltre ne dimostrerebbe i potenziali benefici in termini di
risparmio economico13.
Quando
è appropriata la terapia antibiotica inalatoria?
Esistono
3 contesti clinici in cui la terapia inalatoria anti-PA è
stata utilizzata nella gestione della FC:
- la prima infezione da PA, con lo scopo di eradicazione e prevenzione della colonizzazione cronica;
- l'infezione cronica da PA, con lo scopo di ridurre la progressione del danno polmonare (terapia di mantenimento);
- le riacutizzazioni di malattia.
Non in
tutti questi tre casi però ci sono evidenze circa la sua
efficacia. Infatti, ad oggi, la somministrazione di antibiotici
anti-PA per via inalatoria in corso di riacutizzazione non ha sortito
benefici evidenti, rimanendo la via endovenosa quella con maggior
efficacia14.
La Figura
1 riassume la storia naturale dell'infezione da PA nei pazienti
affetti da FC ed in parallelo le possibili strategie terapeutiche. Di
seguito discuteremo in maniera separata il ruolo della terapia
inalatoria antibiotica nella prima infezione e nella colonizzazione
cronica da PA.
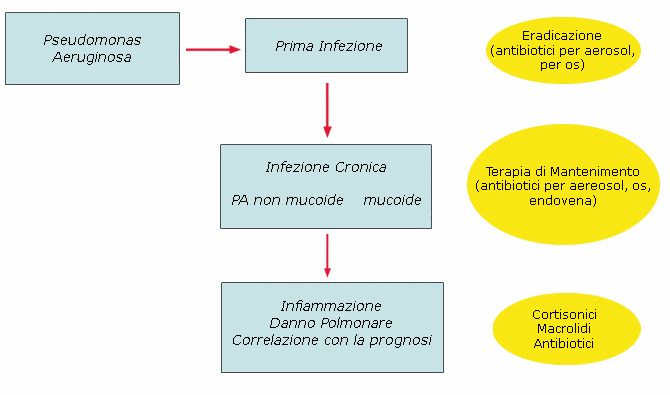
Figura
1. Storia naturale dell'infezione da PA nel paziente
fibrocistico e possibili strategie terapeutiche.
LA
PRIMA INFEZIONE
Perché
trattare la prima infezione?
Alla luce
della storia naturale dell'infezione da PA, il trattamento precoce
della prima infezione da PA è raccomandato come strategia di
eradicazione dell'infezione e prevenzione o ritardo della
colonizzazione cronica15. Si andrebbe ad agire con
maggiore probabilità sui ceppi di PA non-mucoide, che
possiedono caratteristiche di maggiore suscettibilità alla
terapia antibiotica. La prima infezione costituisce così un
periodo “finestra” estremamente favorevole alla eradicazione e di
conseguenza alla prevenzione della colonizzazione cronica e dei
rischi ad essa correlati16.
Chi è
il paziente con la prima infezione?
Il
paziente con prima infezione è quello in cui abbiamo per la
prima volta isolato lo PA. Possiamo ricercare lo PA nel BAL,
nell'escreato, o nelle secrezioni orofaringee, preferibilmente dopo
fisioterapia respiratoria o inalazione di soluzioni ipertoniche. In
ambito pediatrico, l'escreato però non costituisce
un'alternativa, vista l'incapacità dei bambini – ad
eccezione dei più grandi – ad espettorare. Il BAL
rappresenta così il gold standard in questa fascia di età
ma presenta dei limiti legati alla sua invasività (i.e.
necessità di ricorrere a broncoscopia, e di conseguenza a
procedure di sedazione o anestesia) ed al fatto che il prelievo
avviene in una specifica zona dell'albero bronchiale rischiando di
non essere rappresentativo della reale situazione di colonizzazione
delle basse vie aeree. Per tale motivo, il suo utilizzo nell'ambito
clinico è poco diffuso.
La
coltura delle secrezioni orofaringee rimane così la
metodologia più ampiamente utilizzata in pediatria, e si è
dimostrata avere un buon valore predittivo positivo17. E'
caratterizzata da un'elevata specificità (fino al 95%)18,
che però tende a diminuire all'aumentare dell'età,
e da una minore sensibilità (fino all'82%)19.
Dal punto
di vista pratico lo PA può dirsi eradicato solo quando almeno
tre colture consecutive dalle vie aeree sono negative in un periodo
di sei mesi. Quando il germe ricompare nell'espettorato entro un
intervallo di tempo inferiore a 6 mesi dalla fine del trattamento è
ipotizzabile che non si sia verificata eradicazione, ma piuttosto una
ricrescita dello stesso ceppo, soppresso ma non eradicato
dall'antibiotico. Se la ricomparsa avviene in un lasso di tempo
superiore a 6 mesi dalla fine del trattamento, si ritiene in genere
che il paziente sia colonizzato da un nuovo ceppo batterico. Solo
studi microbiologici condotti con tecniche molecolari, difficilmente
eseguibili nella pratica clinica routinaria, sono in grado di
distinguere tra ricrescita dello stesso ceppo e nuova ulteriore
colonizzazione.
Per
ovviare al problema dei falsi negativi – specie nel caso del
bambino non-espettorante – si è proposto il dosaggio di
anticorpi contro antigeni specifici dello PA, basandosi sul fatto che
l'organismo reagisce all'attacco del batterio producendo anticorpi a
scopo difensivo, il cui rilievo testimonierebbe l'avvenuta infezione.
Il loro ruolo è però ancora controverso. Secondo alcuni
lavori, il dosaggio degli anticorpi anti-PA sarebbe in grado ad
identificare precocemente un'infezione da PA20,21. Un
recente studio ha invece dimostrato come gli anticorpi anti-PA siano
positivi solo nel 43% dei pazienti con prima infezione22.
Lo stesso studio dimostra come nei pazienti positivi per gli
anticorpi e che eliminavano dalle vie aeree lo PA a seguito di
trattamento con aerosol antibiotico, gli anticorpi diminuivano di
livello, mentre i livelli aumentavano nei soggetti nei quali era
fallito il tentativo di eradicazione. In conclusione, il dosaggio
degli anticorpi non sembra aiutare a prendere decisioni terapeutiche
in caso di prima infezione da PA, ma il loro dosaggio può
essere utile per monitorare il decorso dell'infezione ed
eventualmente per rendere più frequenti le colture batteriche
e aggiustare le terapie antibatteriche nei casi che continuano a
mantenere nel tempo livelli significativi di anticorpi. In questo
senso alcuni Autori hanno usato il dosaggio anticorpale per meglio
definire l'eradicazione (tre colture successive negative per PA e
anticorpi negativi o negativizzati)23.
Quali
sono le evidenze di efficacia?
A
supporto dell'efficacia della strategia di eradicazione esistono
alcune evidenze riassunte da una metanalisi della Cochrane24
che include 3 studi clinici randomizzati (RCTs) e da una revisione
sistematica critica della letteratura che, oltre ai 3 RCTs, include 8
studi di coorte25. Di recente altri 2 studi prospettici
sono stati pubblicati sull'argomento23,26. Il paragone e
la sintesi dei risultati di questi studi sono però resi
difficili dalla disomogeneità della terapia inalatoria
utilizzata (tobramicina, colistina in associazione o meno con
antibiotico orale o per via venosa), dalla estrema variabilità
delle misure di efficacia scelte da ciascuno studio (i.e.
eradicazione - per di più definita in maniera differente nei
singoli studi -, modificazione della funzionalità
respiratoria, rischio di ospedalizzazione) e del tempo di
follow-up27.
I 3 RCTs
hanno incluso un numero complessivo di 69 pazienti, con età
variabile dai 6 mesi ai 18 anni; due hanno valutato l'efficacia
della tobramicina per aerosol rispetto al placebo28,29 (a
dosaggi diversi: rispettivamente tobramicina in soluzione inalatoria
300 mg x 2/die per 28 giorni, l'altro tobramicina in soluzione
parenterale nebulizzata a dosi di 80 mg x2/die per 12 mesi); il terzo
l'efficacia della colistina per aerosol in associazione con la
ciprofloxacina orale (colistina 1.000.000 U x 2/die e ciprofloxacina
250-750 mg x 2/die per 21 giorni) rispetto al placebo30.
Gli outcome valutati sono stati diversi (eradicazione, tempo alla
cronicizzazione) e misurati in tempi diversi (da un minimo di 1 mese
a un massimo 24 mesi dal trattamento). Nonostante queste differenze i
tre RCT hanno dimostrato la superiorità della terapia
inalatoria nell'eradicazione dello PA (Figura 2 e 3).
I
risultati della combinazione dei due trials sulla tobramicina
evidenziano una eradicazione dell'88% ad 1 mese e dell'85% a 2
mesi (OR combinato ad 1 mese 0,12; 95% CI 0,03-0,54 e 0,15; 95% CI
0,03-0,65)24.Dei tre lavori, solo quello di Wiesemann 29
ha valutato l'efficacia della terapia eradicante con tobramicina
sulla funzionalità respiratoria, riportando però
l'assenza di un miglioramento. Il trial di Valerius30 ha
dimostrato come il trattamento per aerosol con colistina associato
alla somministrazione di ciprofloxacina per 21 giorni sia associato a
una riduzione della probabilità di essere colonizzato in
maniera cronica da PA a 2 anni dell'88% (OR 0,12, 95% ci 0,02-0,79)
(Figura 2).
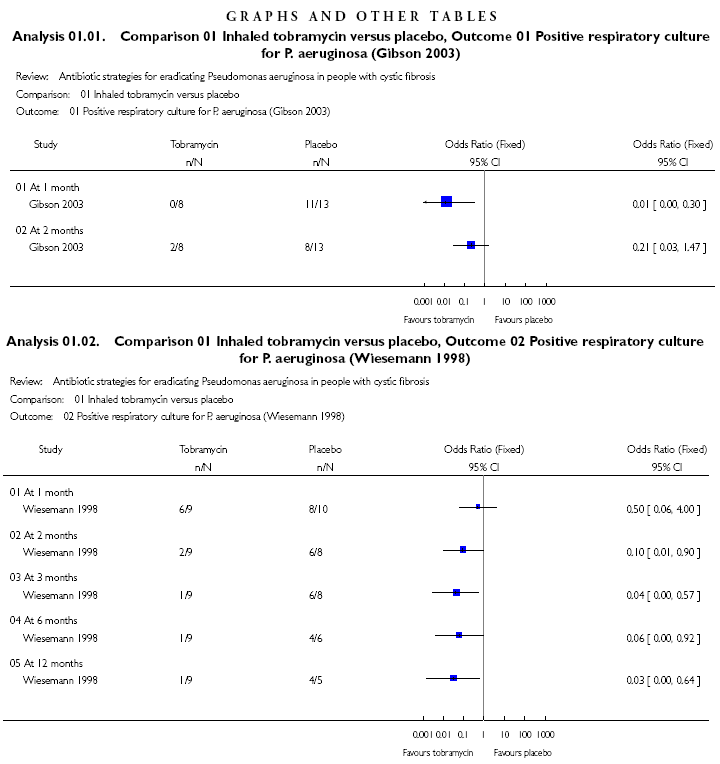
Figura
2. Effetto della tobramicina inalatoria rispetto al placebo
sull'eradicazione del PA (tratto da ref. 24).
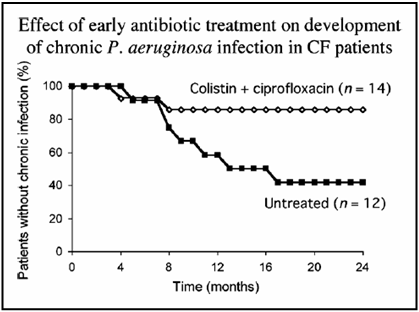
Figura
3. Effetto della colistina inalatoria in associazione con la
ciprofloxacina nel ritardare la colonizzazione cronica da PA (tratto
da ref 30)
Gli studi
di coorte hanno reclutato un numero complessivo di 224 pazienti, con
età variabile da 6 mesi a 32 anni. Anche questi studi, presi
complessivamente, dimostrano una riduzione significativa delle
culture positive per PA con frequenze variabili a un anno di
follow-up fra l'81% e il 93%25.Solo tre studi hanno
mostrato anche una riduzione del declino della funzionalità
respiratoria23,26,31. Nello studio di Taccetti il declino
annuo della percentuale predetta del FEV1 è risultato
significativamente inferiore nel gruppo trattato con ciprofloxacina
per os e colistina inalatoria per 3 settimane (∆FEV1 annuo -1.63% ±
1.6) rispetto a un gruppo di controllo con infezione cronica da PA
(∆FEV1 annuo - 4.69% ± 2.95)23. Nello studio di
Stelmach26,il declino del FEV1 è risultato ridotto
nei due anni dopo terapia inalatoria di mantenimento con TOBI
rispetto ai 2 anni prima della avvio (∆FEV1 biannuale -7.6% prima
del TOBI rispetto -1.5% dopo TOBI).
A
supporto dell'efficacia della terapia antibiotica per aerosol nella
prima infezione da PA, vanno considerati i risultati di una
sorveglianza post-marketing sul TOBI condotta in 21 centri italiani
per la cura della FC, che ha dimostrato l'eradicazione dello PA
nell'81% dei pazienti con nuovo isolamento di PA (N=84) alla fine
di 12 mesi di follow-up, con maggiore probabilità di
eradicazione entro i primi 6 mesi di trattamento32,33
(Figura 4). Lo schema terapeutico utilizzato ha previsto nel 69% dei
pazienti l'uso combinato del TOBI e di un altro antibiotico (nel
90% dei casi la ciprofloxacina), mentre il restante 31% dei pazienti
è stato trattato solo con il TOBI.
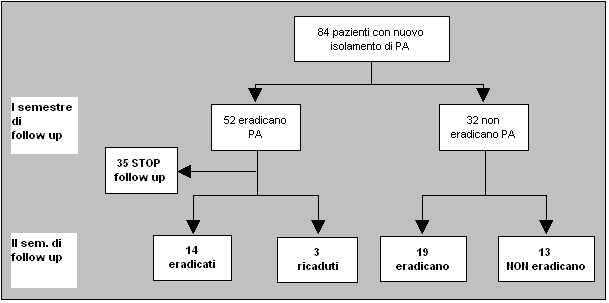
Figura
4. Effetto del TOBI inalatorio in pazienti con prima
infezione da PA in uno studio di post-marketing condotto in 21 centri
di fibrosi cistica italiana.
Quali
le implicazioni per la pratica?
Alla luce
delle evidenze, nel paziente con FC con primo isolamento dello PA, la
terapia antibiotica precoce sembra in grado di ridurre il numero di
colture positive (seppure senza evidenti benefici sulla funzionalità
respiratoria) e perciò dovrebbe essere sempre tentata. Al
momento il come trattare la prima infezione risulta ancora oggetto di
discussione e di controversie.
Il primo
aspetto di rilievo riguarda la precoce identificazione dello PA, che
dipende dalla frequenza con cui vengono eseguite le colture
dell'escreato o delle secrezioni orofaringee nei pazienti
fibrocistici. Le scelte operative variano da centro a centro, ma
secondo l'ultima Consensus le colture delle secrezioni respiratorie
dovrebbero essere eseguite almeno ogni 3 mesi (che corrispondono al
periodo minimo in cui si potrebbe avere la trasformazione del ceppo
di PA da non-mucoide a mucoide)14.
I due
antibiotici inalatori che andrebbero utilizzati sono la tobramicina e
la colistina. Al momento, dei due solo la tobramicina è stata
approvata dall'EMEA ed ha una formulazione per via inalatoria nella
forma di due prodotti: il TOBI (fiale 300mg/5ml, costo per scatola
con 56 fiale di euro 2825,85) e il BRAMITOB (fiale 300mg/4ml, costo
per scatola con 56 fiale di euro 2974,58 – si differenzia dal TOBI
solo per essere iso-osmolare). Entrambi sono licenziati per l'uso
esclusivo nei pazienti FC con età maggiore o ugale a 6 anni e
con infezione cronica del tratto respiratorio da parte dello PA.
Il loro
utilizzo nel contesto clinico della prima infezione è quindi
off-label per indicazione e verosimilmente anche per età.
Tuttavia vi sono alcune evidenze preliminari che ne dimostrano
l'efficacia e il profilo di sicurezza anche in bambini piccoli con
prima infezione, anche se rimane controverso il dosaggio che deve
essere utilizzato26.La colistina non ha invece una
formulazione inalatoria specifica, ma solo fiale ad uso parenterale
contenenti 1.000.000 U di colimicina (prezzo euro 6,12). Il suo
utilizzo risulta quindi off-label per via di somministrazione ed
indicazione.
I dosaggi
consigliati dei due farmaci per via inalatoria sono riportati in
Tabella 1.
Sulla
durata del trattamento e lo schema terapeutico da utilizzare non vi è
consenso. In modo particolare resta da chiarire se la tobramicina per
via inalatoria vada utilizzata per un solo ciclo di un mese di
terapia o, come suggerito in alcune sorveglianze di popolazione per
periodi più lunghi, anche di un anno. Gli studi che hanno
utilizzato la colistina per aerosol (utilizzata anche in questo caso
e in modo continuativo, anche per un anno) hanno previsto sempre
l'uso combinato della ciprofloxacina per via orale (utilizzata per
2-3 settimane). In un bilancio tra costi/rischi/benefici, quello che
al momento sembra ragionevole fare è adottare uno schema di
eradicazione per un periodo sufficientemente breve, ripetendo il
ciclo in caso di mancata eradicazione, e poi stare a guardare,
ri-trattando i nuovi isolamenti con lo stesso schema (se è
stato efficace).
Dosaggi
per terapia inalatoria antibiotica | |||
Dose
|
Volte/die |
Dose
massima/die | |
Tobramicina |
150-300
mg |
1-2 |
600 mg |
Colistina |
1.000.000
– 2.000.000 U |
2 |
4.000.000
U |
Tabella
1
Quali
le implicazioni per la ricerca?
Le
domande aperte sono ancora molte. Se le evidenze indicano che
trattare è utile, siamo invece ancora lontani dal sapere quale
sia la strategia terapeutica più efficace da instaurare nel
paziente con prima infezione da PA, quali i dosaggi ottimali (in
particolare nei bambini piccoli), le combinazioni di antibiotici.
Attualmente si discute molto su quale sia la strategia migliore da
seguire per cercare di ottenere l'eradicazione dello PA (solo il TOBI
per via aerosolica; il TOBI+la ciprofloxacina per os; la colistina+la
ciprofloxacina per os; la terapia aereosolica antibiotica combinata
con un ciclo di antibiotici e.v), la durata del trattamento, quanto
tempo dopo l'eradicazione dello PA si debba interrompere la terapia
antibiotica o come trattare il nuovo isolamento dello PA a distanza
di un periodo di eradicazione34.Al momento sono in corso
RCTs multicentrici che hanno l'obiettivo di dare una risposta ad
alcuni di questi quesiti16.
Perché
trattare l'infezione cronica?
Come già
discusso, una volta che la infezione cronica da PA si è
instaurata, l'eradicazione diventa impossibile. Scopo della terapia
diviene quindi quello di “mantenimento”, di riduzione della
carica batterica e della patogenicità del germe, di
rallentamento della progressione del danno polmonare e di riduzione
delle riacutizzazioni infettive respiratorie14.
Chi è
il paziente con infezione cronica?
La
cronicità dell'infezione viene definita dal riscontro dello
PA per almeno 6 mesi o in almeno tre colture successive (intervallate
l'una dall'altra da almeno un mese) in combinazione con la
positività degli anticorpi specifici anti-PA14.
Quali
sono le evidenze di efficacia?
Una
recente metanalisi sulla terapia antibiotica aerosolica nei pazienti
con infezione cronica da PA ha considerato 14 RCTs35, con
una popolazione totale di 1100 pazienti (range 7-520 per studio), di
età compresa fra 6 mesi e 50 anni, di cui il 53% dei pazienti
reclutati da un unico trial sull'efficacia del TOBI rispetto al
placebo36. Tredici dei 14 RCTs hanno paragonato una
antibiotico inalatorio rispetto a placebo, due hanno confrontato due
trattamenti antibiotici: uno la tobramicina rispetto alla colistina36
uno il ceftazidime rispetto ad una combinazione di gentamicina e
carbenicillina38.Quest'ultimo lavoro è però
caratterizzato da un campione molto esiguo di pazienti (n=18), e da
limiti metodologici. Il farmaco maggiormente studiato è stato
la tobramicina (7 studi su 14).
La
revisione sistematica ha evidenziato un'ampissima eterogeneicità
degli RCTs in termini di farmaci utilizzati (tobramicina,
gentamicina, colistina, ceftazidime, gentamicina in associazione con
carbenicillina), di formulazioni specifiche per la somministrazione
inalatoria (solo 2 RCTs), di schema terapeutico (dosaggi e numero di
somministrazioni), di durata del trattamento (1-32 mesi). Gli autori
della revisione hanno sottolineato come i trials condotti fra il 1986
ed il 1989 (7 su 14) sono quelli che hanno reclutato il numero minore
di pazienti, sono stati condotti in un unico centro, hanno presentato
maggiori limiti metodologici e hanno utilizzato dosaggi antibiotici
bassi rispetto a quelli che si sa essere necessari per raggiungere
sufficienti concentrazioni a livello polmonare.
Fra i
limiti della metanalisi aggiungiamo l'inclusione dei trials di
Gibson28 e Wiesemann29, la cui finalità
era verificare l'efficacia della terapia per aerosol nella prima
infezione e non nell'infezione cronica da PA. Comunque, nel
complesso (escludendo anche questi ultimi due lavori) gli studi
inclusi nella metanalisi hanno mostrato l'efficacia della terapia
nel migliorare la funzionalità respiratoria (con aumenti delle
percentuali predette del FEV1 variabili da 6% a 3 mesi fino a 12% a
12 mesi) e ridurre la frequenza delle riacutizzazioni respiratorie
(valutata come riduzione del numero delle ospedalizzazioni del 37-
49% in 3 anni, e riduzione dei cicli antibiotici endovena pari al
40%). Gli Autori sottolineano però che le evidenze raccolte
sono troppo poche per stabilire quale siano il farmaco, i dosaggi e
la durata ottimali, seppure sembri che il maggior beneficio si abbia
dopo 6 mesi di terapia35.In particolare, ci pare
importante riportare nel dettaglio i risultati del RCT multicentrico
che reclutava il 53% di tutta la popolazione inclusa nella metanalisi
(n=520, età > 6 anni con FEV1 compreso tra il 25% e il 75%
del predetto)36.Questo studio ha evidenziato come la
terapia con TOBI “intermittente” o “on-off” (condotta cioè
per un totale di 6 mesi con 3 cicli di 1 mese “on”, intervallati
da un mese senza terapia, “off”) sia associata nei pazienti
trattati, alla fine del periodo previsto di trattamento, ad un
incremento del 10% del FEV1 predetto rispetto al valore basale
rispetto a un decremento del FEV1 pari al 2% in quelli trattati con
il placebo (Figura 5). Viene inoltre riportata una riduzione del
numero di cicli di antibiotici richiesti per via orale e/o iniettiva
(- 36%) e dei giorni di ospedalizzazione (- 26%) nei trattati con
TOBI rispetto a quelli trattati con placebo. L'efficacia del TOBI
sembra essere più evidente nei pazienti in età
adolescenziale.
La
somministrazione “on-off” era stata scelta sulla base di studi
precedenti che mostravano come la somministrazione continua di
tobramicina in maniera continuativa per lunghi periodi (3 mesi) fosse
associata all'insorgenza di ceppi di PA resistenti (dal 29% al 73%
dopo 3 mesi), a differenza di studi con somministrazione
“intermittente” associati a minore o persino assente insorgenza
di resistenze14.
Questo
dipenderebbe dal fatto che lo PA presenta una “resistenza adattiva”
caratterizzata dal fatto che i ceppi resistenti avrebbero una
crescita più lenta rispetto ai sensibili e che quindi, al
cessare della terapia, sarebbero spiazzati dalla crescita più
rapida dei ceppi sensibili14.
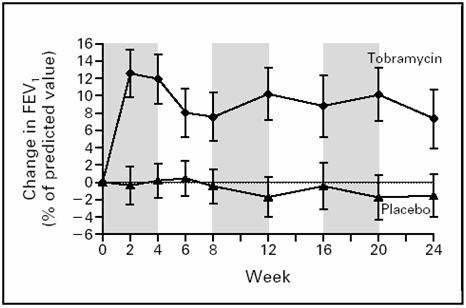
Figura
5. Effetto del TOBI inalatorio come terapia “on-off” in
pazienti con infezione cronica da PA sulla funzionalità
respiratoria (da ref. 33)
Una
osservazione successiva in aperto della coorte dei pazienti trattati
con placebo nel RCT di Ramsey e che hanno iniziato il TOBI, ha
dimostrato come anche in questo gruppo vi sia un miglioramento del
FEV1, seppure inferiore a quello osservato nel gruppo randomizzato a
ricevere il TOBI durante lo studio39.Due studi di coorte
dimostrerebbero la maggiore efficacia del TOBI rispetto ad un
trattamento standard in pazienti in età adolescenziale40,41.
L'unico
RCT che ha valutato in modo comparativo la terapia inalatoria per 28
giorni con tobramicina rispetto alla colistina su un numero
complessivo di 115 pazienti (età tra 7 ed i 50 anni)
dimostrerebbe un maggiore beneficio della tobramicina rispetto alla
colistina sul FEV1 (+6.7% versus +0.37% della percentuale predetta
del FEV1), con il grosso limite di aver valutato la funzionalità
respiratoria a un solo mese di distanza dalla fine della terapia37.
Recentemente
sono stati poi pubblicati due RCTs42,43 che hanno
paragonato il BRAMITOB, una nuova formulazione inalatoria di
tobramicina (vedi sopra), rispetto al placebo nell'infezione
cronica, che confermerebbero gli effetti benefici della tobramicina
inalatoria.
Anche la
sorveglianza post-marketing sul TOBI condotta in Italia su 517
pazienti, di cui 422 hanno continuato la terapia per 12 mesi, ha
dimostrato una stabilizzazione della percentuale predetta del FEV 1
dopo l'avvio del TOBI. (Figura 6). Come si evince dalla figura,
dopo un calo del FEV1 di circa -3.5% nell'anno precedente all'avvio
del TOBI (in linea con i dati della letteratura che riportano un calo
medio del FEV1 2% annuo nei pazienti con FC) dopo 6 mesi di
trattamento si assiste ad un incremento medio percentuale del FEV1
del 2,4%. Dopo altri 6 mesi di trattamento (al 12° mese) non si
assiste ad un ulteriore incremento del FEV1, ma ad un lieve riduzione
rispetto al dato dei 6 mesi precedenti e pertanto ad una sostanziale
stabilizzazione del valore spirometrico medio in un anno di terapia.
Limite insito nelle caratteristiche del disegno dello studio
(sorveglianza post-marketing) è l'assenza di un gruppo di
controllo, che non rende possibile attribuire al TOBI con certezza
tale stabilizzazione.
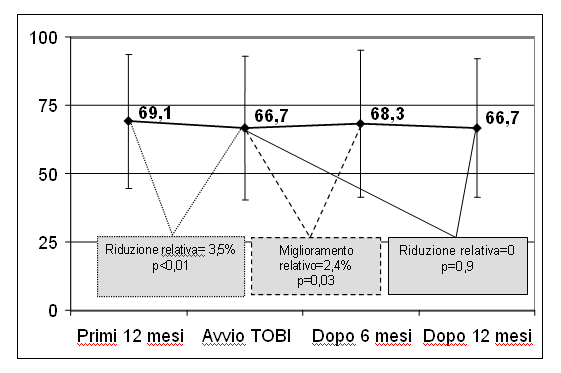
Figura
6. Andamento della percentuale predetta del FEV1 nei diversi
momenti della rilevazione dello studio post-marketing del TOBI in
pazienti con infezione cronica da PA
A
differenza di quanto riportato nel trial multicentrico della Ramsey
et al36,nello studio di post-marketing, l'uso del TOBI
non sembra aver ridotto, rispetto al periodo antecedente all'utilizzo
del trattamento inalatorio, il numero medio di giorni di
ospedalizzazione, i giorni di terapia antibiotica endovena (per
esacerbazione e programmati) e quelli per os programmati; si riduce
invece il numero di giorni di terapia antibiotica per os per
esacerbazione. Durante il periodo in studio l'altra variabile
clinica che mostra un lieve miglioramento è il BMI. La
stratificazione dei pazienti rispetto al valore del FEV1 ed all'età
non mostra rilevanti variazioni nei risultati rispetto a quelli
osservati sul totale dei pazienti.
Il
giudizio complessivo che si ricava sull'uso di TOBI nella
valutazione post-marketing condotta in Italia e con l'indicazione
per colonizzazione cronica da PA (pur nel limite espresso di una
valutazione comparativa temporale sulla stessa coorte di pazienti,
senza gruppo di controllo) è che rispetto alla situazione
ideale del RCT condotto36, (ma con a sua volta il limite
di una sorveglianza molto controllata e con un breve follow-up e
quindi poco rispondente ad un contesto clinico reale) è che:
1) l'uso del farmaco sembra essere in grado di stabilizzare il
valore spirometrico del FEV1 (come dato medio di riferimento) e di
influenzare poco alcune variabili indicative di benessere clinico
(giorni di ospedalizzazioni, di terapia antibiotica); 2) rispetto al
contesto “controllato” dello studio clinico, molti di più
sono i pazienti che sospendono il trattamento per effetti collaterali
e/o inefficacia clinica e/o scarsa compliance (circa il 20% dei
pazienti).
Quali
le implicazioni per la pratica?
Come nel
caso della prima infezione, le evidenze suggeriscono che la terapia
di mantenimento con antibiotici inalatori sia efficace, ma manca
chiarezza su quali siano gli schemi terapeutici da mettere in
pratica. Lo schema “intermittente”, alla luce degli studi clinici
e microbiologici, sembra il più efficace e quello più
sicuro in termini di insorgenza di resistenze. Il farmaco ad oggi più
studiato e di cui (vedi sopra) è disponibile una formulazione
per uso inalatorio è la tobramicina. La terapia di
mantenimento con tobramicina risulterebbe però molto costosa e
il suo utilizzo dovrà quindi essere valutato in termini di
efficacia, compliance e di effetti collaterali nel singolo paziente.
In particolare la proposta di un trattamento con la tobramicina per
aerosol deve rispondere, sul singolo paziente, a misure rilevanti, in
termini di efficacia, da valutare in un arco temporale di 6 mesi. Se
non vi fosse un chiaro miglioramento o stabilizzazione della
funzionalità respiratoria e/o una riduzione della necessità
di cicli di terapia antibiotica la terapia, a giudizio anche del
paziente e/o del genitore, andrebbe sospesa.
Quali
le implicazioni per la ricerca?
Anche
nell'ambito della colonizzazione cronica le domande aperte sono
numerose ed in parte analoghe a quelle nell'ambito della prima
infezione dello PA.
Mancano
sufficienti dati circa dosaggi, durata e frequenza del trattamento
con tobramicina; molto limitate sono le informazioni disponibili
sulla colistina che merita, alla luce anche dei costi minori (vedi
sopra) di essere studiata con maggiore rigore. Utile sarebbe una
valutazione clinica comparativa in termini di efficacia/costi tra le
formulazioni disponibili. Un'altro degli aspetti da approfondire,
visto il trattamento prolungato nella colonizzazione cronica, è
quello degli effetti collaterali nel lungo termine (i.e.
ototossicità, nefrotossicità, insorgenza di germi
resistenti - vedi sotto). Il contesto clinico è poi di
fondamentale importanza per valutare in maniera più
approfondita aspetti quali la compliance, la qualità della
vita, la reale efficacia sul lungo periodo del trattamento.
GLI
EFFETTI COLLATERALI DELLA TERAPIA ANTIBIOTICA INALATORIA
Uno dei
vantaggi della terapia inalatoria è la riduzione delle
concentrazioni sieriche antibiotiche e di conseguenza della loro
tossicità a livello sistemico. Questo è di estremo
rilievo per quanto concerne gli aminoglicosidici alla luce della loro
nota ototossicità e nefrotossicità. Ad oggi gli studi
sulla tobramicina inalatoria somministrata per lunghi periodi di
tempo nel paziente con infezione cronica (fino ad 1 anno di terapia)
non hanno mostrato un'aumento né dei danni renali né
uditivi nei pazienti trattati35.
Fra gli
effetti collaterali transitori della tobramicina vi è il
tinnito, la disfonia e il broncospasmo. Nel trial di Ramsey36,il
tinnito ha interessato il 3% dei pazienti trattati con TOBI (nessuno
di quelli trattati con placebo), ma era di entità moderata e
non ha portato all'interruzione della terapia. Il 12% dei pazienti
trattati con TOBI ha manifestato alterazioni transitorie della voce
rispetto al 6% dei pazienti in placebo. Nello studio di
post-marketing condotto in Italia il 12% dei pazienti ha sospeso in
modo definitivo il TOBI per la comparsa di questi effetti
collaterali.
Un altro
effetto collaterale della terapia inalatoria antibiotica
indipendemente dal farmaco utilizzato è il broncospasmo. In
passato questo effetto era legato all'utilizzo di preparazioni non
specifiche per l'uso per aerosol e ricche in conservanti,
potenzialmente bronco-irritanti (quali fenoli e metabisulfiti). Con
preparazioni specifiche e a concentrazioni isotoniche il rischio
viene ad essere ridotto. Lo studio di Ramsey ha mostrato come dopo
inalazione sia del TOBI che del placebo vi era una transitoria
riduzione del FEV1. In un numero non indifferente di casi, l'effetto
anche se a volte transitorio di broncospasmo da terapia antibiotica
inalatoria, richiede una premedicazione con il Beta2agonista.
I
risultati riportati in merito al profilo di sicurezza della terapia
antibiotica inalatoria non possono essere considerati come
definitivi. In particolare anche nei casi di inalazione della
tobramicina l'assorbimento sistemico è intorno al 10%.
Alcuni pazienti trattati con la tobramicina in aerosol hanno
riportato un calo dell'udito in studi di post-marketing e come
sintomo iniziale riferivano il tinnito44. Un monitoraggio
quindi della funzionalità uditiva deve fare parte del
follow-up del paziente in trattamento cronico.
Insito in
qualsiasi trattamento antibiotico – quale che sia la via di
somministrazione – è l'insorgenza di resistenze. Come
abbiamo già discusso sopra la suscettibilità dello PA
viene riacquistata dopo periodi fuori terapia, osservazione che ha
portato schemi di terapia inalatoria antibiotica “on-off”.
L'insorgenza però di resistenze è sicuramente uno
degli aspetti da monitorizzare nel lungo termine specie alla luce di
un recente lavoro che ha mostrato fra i fattori di rischio nei
pazienti fibrocistici con PA multiresistenti del registro americano
l'avere eseguito terapia inalatoria con la tobramicina (RR 2.08;
95% CI 1.56-2.77)45. Gli Autori però consigliano
cautela nell'interpretare questo dato in quanto mancano dati circa
la durata e la modalità di somministrazione della tobramicina
(continua, intermittente, da sola o in associazione con antibiotico
orale) che potrebbero far variare notevolmente il rischio di
resistenza.
Un altro
potenziale effetto avverso, che ad oggi sembra essere negato ma che
chiede tempi di osservazione molto lunghi, è la selezione di
germi altamente antibiotico-resistenti, quali la Burkholderia
cepacia, lo Stenotrophomonas maltophila e l'Alcaligenes
xylosoxidans.
ASPETTI
DI GESTIONE: TECNICI E INFORMATIVI
Antibiotici
in soluzione o in polvere?
La
terapia per aerosol ha lo svantaggio di richiedere inalazioni di
circa 15-20 minuti (che quindi possono portare ad una bassa
compliance) e di richiedere appropriati (vedi sotto) nebulizzatori.
Sono in via di studio e di sperimentazione formulazioni di
tobramicina inalatoria in polvere che hanno il vantaggio di una più
rapida somministrazione tramite inalatori portatili ma che richiedono
anche capacità di generare flussi inspiratori maggiori (i.e.
adatti in bambini più grandi)46. Sembrerebbero però
dare maggiori effetti collaterali locali quali tosse ed alterazione
nel gusto.
Quale
il nebulizzatore più appropriato?
Perché
la nebulizzazione raggiunga i bronchioli, i nebulizzatori dovrebbero
generare particelle di 2-5 micron; particelle più piccole
vengono infatti espirate, mentre se più grandi impattano a
livello delle vie respiratorie alte. Per questo motivo si raccomanda
l'uso di nebulizzatori in grado di produrre un particolato di
queste dimensioni. Un sistema appropriato di filtro per ridurre la
quantità di antibiotici espirata nell'aria dovrebbe essere
disponibile per ridurre la dispersione degli antibiotici. In alcuni
ospedali la terapia inalatoria viene per questi motivo condotta in
locali separati.
Le
cose da fare e non fare nella pratica
La
terapia antibiotica inalatoria è uno dei presidi importanti
per la cura dei pazienti con FC. E' spesso tuttavia abusata ed
utilizzata in modo molto eterogeneo tra i diversi centri di cura a
livello nazionale ed internazionale. Questo rappresenta un problema,
come documentato in diversi studi, di cui uno molto significativo
condotto in 54 Centri che si occupano di pazienti con FC47.
Uno degli aspetti spesso trascurato dai medici è che
l'aereosolterapia è un impegno gravoso sia per il bambino (e
la sua famiglia) che per il paziente adulto, e che quindi la scelta
dovrebbe essere sempre discussa e condivisa in merito ai benefici
potenziali, alla compliance, ai potenziali rischi. Un altro aspetto
da tener in conto è quello dei costi della terapia che sono
straordinariamente elevati per il SSN.
A fronte
di queste considerazioni, in ambito di terapia inalatoria
antibiotica, bisogna quindi ricordare che:
- non ha nessun vantaggio utilizzare l'aereosol terapia antibiotica in assenza di isolamento dello PA e in corso di riacutizzazione infettiva, anche in presenza di una coltura positiva per PA;
- in caso di scelta condivisa di iniziare il trattamento in caso di colonizzazione cronica, il programma di follow-up deve essere rigoroso e deve tenere conto di risultati obiettivi di efficacia e deve tenere in massima considerazione il giudizio del paziente e/o del genitore.
Bibliografia
- Anonymous. Cystic fibrosis foundation patient registry 2000 annual data report. Bethesda, MD, USA. Cystic fibrosis Foundation 2001.
- Wilson R, Dowling RB. Pseudomonas aeruginosa and other related species. Thorax 1998;53:213-19.
- Rowe SM, Miller S, Sorsher EJ. Cystic fibrosis. NEJM. 2005 12;352:1992-2001.
- Burns JL, Gibson RL, McNamara S, et al. Longitudinal assessment of Pseudomonas aeruginosa in young children with cystic fibrosis. J Infect Dis 2001;183:444-52.
- Hoiby N. Microbiology of lung infection in cystic fibrosis patients. Acta Pediatric Scand Suppl 1982;301:33-54.
- Cabral DA, Loh BA, Speert DP. Mucoid Pseudomonas aeruginosa resists nonopsonic phagocytosis by human neutrophils and macrophages. Pediatr Res 1987;22:429-31.
- Govan JRW, Deretic V. Microbial pathogenesis in cystic fibrosis: mucoid Pseudomonas aeruginosa and Burkholderia cepacia. Microbiol Rev 1996;60:539-74.
- FitzSimmons SC. The changing epidemiology of cystic fibrosis. J Pediatr 1993;122:1-9.
- Kosorok MR, Zeng L, West SE, et al. Accelaration of lung disease in children with cystic fibrosis after Pseudomonas aeruginosa acquisition. Pediatr Pulmonol 2001;32:277-87.
- Nixon M, Armstrong DS, Carzino R, et al. Clinical outcome after early Pseudomonas aeruginosa infection in cystic fibrosis. J Pediatr 2001;138:659-704.
- Henry RL, Mellis CM, Petrovic L. Mucoid Pseudomonas aeruginosa is a marker of poor survival in cystic fibrosis. Pediatr Pulmonol 1992;12:158-161.
- Emerson J, Rosenfeld M, McNamara S, Ramsey B, Gibson RL. Pseudomonas aeruginosa and other predictors of mortality and morbidity in young children with cystic fibrosis. Pediatr Pulmol 2002;34(2):91-100.
- Iles R, Legh-Smith J, Drummond M, Prevost A, Vowlers S. Economic evaluation of tobramycin nebuliser solution in cystic fibrosis. J Cyst Fibros 2003;2:120-8.
- Doring G, Conway SP, Heijerman HGM, et al. Antiobitic therapy against Pseudomonas aeruginosa in cystic fibrosis: a European consensus. Eur Respir J 2000;16:749-67.
- Doring G, Hoiby N. Early intervention and prevention of lung disease in cystic fibrosis: a European consensus. J Cystic Fibros 2004;3:67-91.
- Treggiari MM, Rosenfeld M, Retsch-Bogart G, Gibson R, Ramsey B. Approach to eradication of initial Pseudomonas aeuginosa nfection in children with cystic fibrosis. Pediatr Pulmonol 2007;42:751-6.
- Ramsey BW, Wentz KR, Smith AL et al. Predictive value of oropharyngeal cultures for identifying lower airway bacteria in cystic fibrosis patients. Am Rev Respir Dis 1991;144:331-7.
- Rosenfeld M. Emerson J, Accurso F et al. Diagnostic accuracy of oropharyngeal cultures in infants and young children with cystic fibrosis. Pediatr Pulmonol 1999;28:321-8.
- Armstrong DS, Grimwood K, Carlin JB et al. Bronchoalveolar lavage or oropharyngeal cultures to identify lower respiratory pathogens in infants with cystic fibrosis. Pediatr Pulmonol 1996;21:267-75.
- West SE, Zeng L, Lee BL, Kosorok MR, et al. Respiratory infections with Pseudomonas aeruginosa in children with cystic fibrosis: early detection by serology and assessment of risk factors. JAMA. 2002 12;287(22):2958-67.
- Li Z, Kosorok MR, Farrell PM, et al. Longitudinal development of mucoid Pseudomonas aeruginosa infection and lung disease progression in children with cystic fibrosis. JAMA 2005 2;293(5):581-8.
- Ratjen F, Walter H, Haug M et al. Diagnostic value of serum antibodies in early Pseudomonas aeruginosa infection in cystic fibrosis patients. Pediatr Pulmonol 2007;42:197-201.
- Taccetti G, Campana S, Festini F, Mascherini M, Doring G. Early eradication therapy against Pseudomonas aeruginosa in cystic fibrosis patients. Eur Respir J 2005;26:458-61.
- Wood DM, Smyth AR. Antibiotic strategies for eradicating Pseudomonas aeruginosa in people with cystic fibrosis. The Cochrane Database of Systematic Reviews 2006. CD004197.
- Marchetti F, Giglio L, Candusso M, Faraguna D, Assael BM. Early antibiotic treatment of pseudomonas colonisation in cystc fibrosis: a critical review of the literature. Eur J Clin Pharmacol 2004;60:67-74.
- Stelmach I, Korzeniewska A, Stelmach W. Long-term benefit of inhaled tobramycin in children with cystic fibrosis:first clinical observations from Poland. Respiration 2007 [Epub ahead of print].
- Marchetti F, Bua J. More evidence is needed in the antibiotic treatment of Pseudomonas aeruginosa colonisation. Arch Dis Child. 2005;90(11):1204.
- Gibson RL, Emerson J, McNamara S et al. Significant microbiological effect of inhaled tobramycin in young children with cystic fibrosis. Am J Respir Crit Care Med 2003;17:841-9.
- Wiesemann HG, Steinkamp G, Ratjen F et al. Placebo-controlled double-blind, randomised study of aerosolised tobramycin for early treatment of Pseudomonas aeruginosa colonisation in cystic fibrosis. Pediatr Pulmonol 1998;25:88-92.
- Valerius NH, Kovh C, Hoiby N. Prevention of chronic Pseudomonas aeruginosa colonisation in cystic fibrosis by early treatment. Lancet 1991;338:725-6.
- Frederiksen B, Koch C, Hoiby N. Antibiotic treatment of initial colonization with Pseudomonas aeruginosa postpones chronic infection and prevents deterioration of pulmonary function in cystic fibrosis. Pediatr Pulmonol 1997;23:330-5.
- Marchetti F, Ronfani L, Bua J, Montico M, Braggion C, per il Gruppo Italiano di Fibrosi Cistica. Post marketing surveillance sull'uso razionale del TOBIÒ(tobramicina per somministrazione aerosolica) nei pazienti con fibrosi cistica. Rapporto Generale. Maggio 2006.
- Marchetti F, Ronfani L, Bua J. et al. Effect of aerosolized tobramycin on the eradication of Pseudomonas colonisation in cystic fibrosis. J Cystic Fibrosis 2006;5:s22.
- Jones AM. Eradication therapy of early Pseudomonas aeruginosa infection in CF: many questions still unanswered. Eur Resp J 2005;26:373-5.
- Ryan G, Mukhopadhyay S, Singh M. Nebulised anti-pseudomonal antibiotics for cystic fibrosis. Cochrane Database Syst Rev 2003;(3):CD001021.
- Ramsey BW, Pepe MS, Quan JM, et al. Intermittent administration of inhaled tobramycin in patients with cystic fibrosis. NEJM 1999;340(1):23-33.
- Hodson ME, Gallagher CG, Govan JRW. A Randomised clinical trial of nebulised tobramycin or colistin in cystic fibrosis. Eur Resp J 2002;20:658-64.
- Stead RJ, Hodson ME, Batten JC. Inhaled ceftazidime compared with gentamicin and carbenicillin in older patients with cystic fibrosis infected with Pseudomononas aeruginosa. Brit J Dis Chest 1987;81:272-9.
- Bowman CM. The long-term use of inhaled tobramycin in patients with cystic fibrosis. J Cyst Fibros. 2002;1(Suppl 2):194-8.
- Murphy TD, Anbar RD, Lester LA, et al. Treatment with tobramycin solution for inhalation reduces hospitalizations in young CF subjects with mild lung disease. Pediatr Pulmonol 2004;38(4):314-20.
- Moss RB. Long-term benefits of inhaled tobramycin in adolescent patients with cystic fibrosis. Chest 2002;121(1):55-63.
- Chucalin A, Csiszer E, Gyurkovics K et al. A formulation of aerosolised tobramycin (Bramitob) in the treatment of patients with cystic fibrosis and Pseudomonas aeruginosa infection. A double-blind, placebo controlled, multicenter study. Paediatr Drugs 2007;Suppl 1:21-31.
- Lenoir G, Antypkin YG, Miano A, et al. Efficacy, safety and local pharmacokinetics of highly concentrated nebulised tobramycin in patients with cystic fibrosis colonised with Pseudomonas aeruginosa. Paediatr Drugs 2007;Suppl 1:11-20.
- Cheer SM, Waugh J, Noble S. Inhaled tobramycin (TOBI). A review of its use in the management of Pseudomonas aeruginosa infections in patients with cystic fibrosis. Drugs 2003;63:2501–20.
- Merlo CA, Boyle M, Diener-West M, et al. Incidence and risk factors for multiple antibiotic resistant Pseudomonas aeruginosa in cystic fibrosis. Chest 2007;132:562-8.
- Geller DE, Konstan MW, smith J. Et al Novel tobramycin inhalation powder in cystic fibrosis subjects: pharmacokinetics and safety. Pediatr Pulmonol 2007;42:307-13.
- Borsje P, de Jongste JC, Mouton JW, et al. Aereosol therapy in cystic fibrosis: a survey of 54 CF centers. Pediatr Pulmonol 2000;30:368-76.
Vuoi citare questo contributo?