Marzo 2006 - Volume IX - numero 3
M&B Pagine Elettroniche
Contributi Originali - Casi contributivi
La
fibrosi retroperitoneale idiopatica
Descrizione
di due casi
Clinica
Pediatrica, IRCCS Burlo Garofolo, Trieste
Indirizzo
per corrispondenza: ebarbi@libero.it
Key
words: Idiopathic retroperitoneal fibrosis, Abdominal pain,
Hypertension, Renal failure
Summary
Idiopathic
Retroperitoneal Fibrosis (IRF) is a rare syndrome of unknown origin,
possibly of autoimmune nature, which leads to the compression and
obstruction of ureteres and other adjacent organs. We describe two
paediatric cases of IRF which represent the wide spectrum of clinical
expression and evolution of this disease. The diagnosis of IRF should
be suspected in front of a patient with abdominal pain, hypertension,
hydronephrosis and ESR elevation. An early diagnosis is fundamental
to prevent renal failure.
La
fibrosi retroperitoneale idiopatica (IRF) è una patologia poco
frequente la cui incidenza si attesta attorno ad 1 caso su
200000 abitanti, con picco massimo di incidenza tra i 40 e i 60 anni.
E' nota, comunque, la possibilità di esordio anche in età
pediatrica.(1) Si evidenzia una prevalenza, seppur modesta, a carico
del sesso femminile (rapporto uomini: donne 0,66:1).(2)
Si tratta
di un processo infiammatorio non specifico, benigno, caratterizzato
istologicamente da una proliferazione di tessuto fibroadiposo a
carico del distretto retroperitoneale.
La storia
clinica di M., 15 anni, esordisce a 13 anni con l'insorgenza di una
sintomatologia dolorosa lombare dx per la quale viene eseguita una
ecografia renale che evidenzia un aumento di spessore parenchimale a
carico del rene destro con dilatazione delle vie escretrici
prossimali.
I
sospetti clinici si orientano verso una probabile Sindrome del Giunto
e vengono, pertanto, successivamente eseguite una urografia ed una
scintigrafia con Mag3; tali indagini, di fatto, avvalorano il
sospetto diagnostico.
Vi è,
quindi, indicazione per un intervento chirurgico di plastica
correttiva.
In sede
operatoria, però, si evidenzia la presenza di un quadro di
fibrosi retroperitoneale confermata dal successivo esame
istologico eseguito sul campione chirurgico. Nel sospetto di
un'origine secondaria viene indagato un possibile quadro di
autoimmunità o di vasculite ma le indagini condotte in questo
senso negano tali ipotesi. Inoltre, viene eseguita una Tc che non ha
evidenziato masse o deviazioni in sede retroperitoneale.
Da allora
M. è sempre stato bene senza il ricorso ad alcuna terapia
farmacologia. E' stato, invece, avviato un programma di follow-up
laboratoristico (VES inizialmente mossa in seguito negativizzata) ed
ecografico che ha dimostrato una progressiva riduzione della
dilatazione a carico del rene destro con recente comparsa di modica
dilatazione a sinistra.
Al
successivo controllo ecografico (3 mesi dopo) si evidenzia una
dilatazione bilaterale delle vie escretrici calico-pieliche.
A questo
punto si pone il sospetto di un possibile aggravamento del quadro e
si decide di valutare l'opportunità di un eventuale
approccio terapeutico.
Dal punto
di vista laboratoristico, M. presenta una modesta ipereosinofilia
(Eos: 1260/ml) con restante emocromo nella norma, indici di flogosi
negativi, funzionalità renale ed epatica nella norma, adeguati
livelli di immunoglobuline e di elettroliti sierici. Riconsiderando
l'ipotesi di un quadro secondario si ripete il dosaggio delle
frazioni del complemento e degli anticorpi anticitoplasma dei
neutrofili (ANCA) che risultano entrambi normali.
Ripetuta
l'ecografia renale, si evidenzia solo una lieve pielectasia a
carico del rene destro, originariamente interessato, mentre il
sinistro non sembra presentare dilatazione delle vie escretrici
intrarenali. Tale rilievo strumentale si dimostra, pertanto, del
tutto confortante ed esclude, di fatto, anche in ragione del quadro
laboratoristico “silente”, ogni ipotesi di peggioramento. Alla
luce di tali evidenze non si ritiene ragionevole avviare alcun
trattamento farmacologico mantenendo, però, in atto il
programma di follow-up clinico-strumentale.
Segnaliamo,
infine, come il rilievo di ipereosinofilia possa essere inquadrato
nel contesto della stessa malattia di base secondo un modello di
risposta Th2 mediata. Come evidenziato in altri quadri di patologia
fibrotica, infatti, il complesso citochinico indotto dalla risposta
Th2 (in particolare IL-4) sarebbe responsabile dell'attivazione
chemiotattica dei fibroblasti inducendo, allo stesso tempo, la
formazione di un diffuso infiltrato eosinofilo (3).
J. è
un ragazzo di 12 anni affetto da un quadro di FRI per la quale,
invece, si è reso necessario fin da subito un adeguato
approccio farmacologico.
La sua
storia clinica esordisce all'età di 8 anni con un riscontro
occasionale (dopo trauma banale) di ipertensione ed
idroureteronefrosi sinistra da infiltrazione di massa
retroperitoneale localizzata in regione ischiatica sinistra.
Clinicamente si evidenzia stasi venosa a carico dell'arto inferiore
di sinistra con elevazione degli indici di flogosi (VES 124, PCR
11.6). In seguito, l'indagine scintigrafica ha dimostrato la
presenza di un quadro di rene escluso in ragione del quale si è
reso necessario procedere con intervento di nefrectomia con parziale
resezione della massa fibrosa. L'istologia ha poi confermato il
sospetto di Fibrosi Retroperitoneale.
La
persistenza degli indici di flogosi elevati ha imposto l'avvio di
una terapia cortisonica (2.5-5 mg/die di desametasone) mantenuta in
modo continuativo per circa 6 mesi, salvo un breve scalo seguito da
un'immediata risalita degli indici di flogosi. Dopo circa 6 mesi
dall'inizio della terapia steroidea si assiste ad una
negativizzazione degli indici di flogosi e viene, inoltre, eseguita
una valutazione complessiva dello stato autoimmunutario che nega
l'ipotesi di una natura secondaria del quadro di fibrosi
retroperitoneale.
A seguito
dell'avvio della terapia steroidea entro breve si è
sviluppato un importante eccesso ponderale (+ 67% con peso di 67.5
kg) accompagnato da marcati segni di cortisonizzazione (strie rubrae
e acantosi nigricans agli arti e all'addome). Allo scopo di poter
effettuare uno scalo della terapia cortisonica (pur se a basso
dosaggio) è stato introdotto in terapia un secondo farmaco,
l'azatioprina (100 mg/die), la quale, però, dopo circa un
mese, è stata sospesa vista la comparsa di un quadro di
epatite ad impronta colestatica correlabile al farmaco stesso (GOT
526, GPT 245, GGT 98, bilirubina tot. 6.48, bilirubina diretta 4.12).
Le
indagini di imaging (RMN) eseguite dopo circa 8 mesi di terapia
cortisonica dimostrano la necessità di prosecuzione della
terapia stessa in ragione dell'evidenza di un lieve aumento della
massa fibrosa specie nei piani pelvici inferiori.
In questa
fase, quindi, la malattia di J. appare complessivamente ben
controllata ma non completamente spenta (indici di flogosi che
tendono all'immediato rialzo al tentativo di scalo del cortisone)
al prezzo, però, della comparsa di evidenti effetti
collaterali del farmaco stesso.
Alla luce
di queste considerazioni, si impone un pensiero che valuti
l'opportunità di introdurre in terapia un secondo farmaco
che possa garantire un miglior controllo della malattia consentendo
di poter scalare il cortisone.
Visto il
fallimento della terapia con Azatioprina, le più recenti
evidenze di letteratura suggeriscono l'utilizzo del Tamoxifene. Si
tratta di un farmaco antiestrogeno la cui azione farmacologica in
questo contesto clinico è da ricondurre al suo effetto anti
FGF (fattore di crescita dei fibroblasti); tale farmaco si è
dimostrato efficace, come segnalato in numerosi casi presenti in
letteratura, in termini di riduzione della massa fibrosa. Esso
presenta, inoltre, il vantaggio di scarsi effetti collaterali (anche
in ragione del sesso maschile) rispetto alle altre terapie
immunosoppressive eventualmente prospettabili per la malattia di
Johnny nonchè una efficacia di terapia misurabile in tempi
ragionevolmente brevi (3-6 mesi).
Si avvia
pertanto la terapia con Tamoxifene 10 mg x 2/die mantenendo lo
steroide ancora per 6 mesi con il programma di ripetere una RMN dopo
4-5 mesi dall'inizio della terapia.
La
fibrosi retroperitoneale si caratterizza per una notevole variabilità
in termini di eziologia, di modalità di esordio clinico e di
corrispettivi radiologici. La diversa manifestazione clinica dei
nostri due recenti casi conferma questa estrema variabilità di
espressione.
A
dispetto del termine, in una percentuale di casi valutabile
nell'ordine del 15%, la presenza di tessuto fibrotico può
estendersi anche al di fuori della sede retroperitoneale; in questi
casi si parla più propriamente di Fibrosi Multifocale. Accanto
alla FR, che ne rappresenta certamente la più comune
manifestazione, possono evidenziarsi quadri quali la tiroidite di
Riedel, lo pseudotumor dell'orbita, la fibrosi mediastinica e la
colangite sclerosante (4). In letteratura esistono segnalazioni di
associazione con coinvolgimenti pericarditici, periaortici e con la
pancreatite autoimmune (5,6). A livello addominale la fibrosi può
coinvolgere sia le strutture del retroperitoneo che quelle presenti
nella cavità peritoneale determinando, pertanto, a volte il
coinvolgimento di multiple strutture anche non contigue. Una
valutazione condotta su una casistica di 30 pazienti con FR (con
conferma diagnostica istologica) pubblicata sul British Journal of
Radiology del 2000, dimostra come a fronte di una prevalente
localizzazione della placca fibrotica nella regione lombare inferiore
(a livello dell'aorta distale e delle arterie iliache comuni) sia
possibile riscontrare, in un restante 40% di casi, una localizzazione
in sedi ”atipiche” quali i distretti peripancreatici,
periduodenali e pelvici (7).
Per
quanto riguarda l'eziologia va sottolineato come in circa
due-terzi dei casi la fibrosi retroperitoneale resti di natura
indefinita, “origine idiopatica (FRI)”, mentre nel rimanente
terzo dei casi questa si dimostri secondaria a malignità,
malattie autoimmuni, vasculiti, emorragie, infezioni e aneurismi
dell'aorta addominale. In una piccola percentuale di casi, inoltre,
essa può essere secondaria ad una causa iatrogena
riconducibile a terapie farmacologiche (in primis ergotamina e
derivati), interventi chirurgici e radioterapia.
L'eziopatogenesi
dei quadri di FRI risulta ancora ignota. Alcuni autori ritengono che
questa possa rappresentare l'epifenomeno di un disordine autoimmune
sistemico per altri versi misconosciuto; altri, invece, sostengono
che questa possa generarsi come conseguenza di una reazione locale
autoimmune contro antigeni della placca aterosclerotica,
sottolineando, però, come questa stessa ipotesi sia da porre
in relazione in misura pressocchè esclusiva ai casi ad esordio
in età adulta (8-10).
Negli
stadi precoci di formazione della massa fibrosa, istologicamente si
dimostra la presenza di una importante componente cellulare
costituita in particolare da linfociti, eosinofili, leucociti
polimorfonucleati ed altre cellule dell'infiammazione immerse in
una matrice di collagene; progressivamente, però, tale tessuto
fibrotico tende a divenire sempre più acellulare.
Clinicamente
più frequentemente la FRI si caratterizza per la comparsa di
segni e sintomi sistemici aspecifici quali astenia, anoressia,
anemia, calo ponderale, febbricola, malessere… A questi possono,
poi, accompagnarsi sintomi conseguenti all'intrappolamento e alla
compressione delle strutture retroperitoneali, in particolare una
sintomatologia dolorosa lombare. La progressività evolutiva e
la notevole aspecificità sintomatologica possono essere spesso
causa di un importante ritardo diagnostico; non infrequentemente,
quindi, la diagnosi può essere posta tardivamente quando,
cioè, vi è ormai un importante danno renale (vedi il
caso di J.).
In
sostanza si tratta di una patologia molto rara, con manifestazioni
aspecifiche ma in cui una diagnosi ragionevolmente precoce può
cambiare la sostanza delle cose (vedi nefrectomia del secondo caso).
In questo senso ci pare importante sottolineare come un alto indice
di sospetto debba essere posto a fronte di sintomatologia addominale
vaga, dilatazione del bacinetto renale, in diagnosi differenziale con
sindrome del giunto, o in corso di movimento degli indici di flogosi
senza localizzazione in un adolescente.
Dal punto
di vista strumentale, in passato, per la diagnosi si ricorreva
all'urografia intravenosa con evidenza della triade: deviazione
mediale degli ureteri, compressione estrinseca e idronefrosi. Si
trattava, peraltro, di evidenze non specifiche di tale patologia
essendo riconducibili esclusivamente all'effetto massa determinato
dalla fibrosi e pertanto ascrivibili anche ad altri quadri quali
malignità, processi infiammatori e adenopatie.
Oggi si
ricorre più spesso alla ecografia che consente spesso di
individuale la lesione come una massa ben definita, retroperitoneale,
ipoecogena con frequente reperto consequenziale accessorio di
idronefrosi. L'ecografia addominale è molto utile, inoltre,
per il monitoraggio della risposta alla terapia. Altre tecniche di
imaging quali la TC e la RMN si rivelano importanti per valutare
l'estensione del processo. (11)
Indiagnosi differenziale è opportuno tenere presente la
localizzazione tendenzialmente più craniale del linfoma e
delle altre adenopatie maligne che solitamente si trovano a livello
dell'ilo renale e talvolta dislocano l'aorta anteriormente e gli
ureteri lateralmente. Può essere utile ricordare, inoltre,
come la fibrosi retroperitoneale non si associ a quadri osteolitici,
cosa che invece può avvenire in conseguenza a neoplasie
maligne retroperitoneali come esito di localizzazione metastatica o
di diffusione per contiguità. Altre patologie da considerare
in diagnostica differenziale sono, inoltre, le emorragie, le
infezioni e l' amiloidosi. Ovviamente la diagnosi differenziale
diventa più difficile quando la fibrosi si trova in siti
atipici (7).
La
diagnosi definitiva, comunque, si pone esclusivamente mediante
biopsia (12) e conseguente esame istologico del campione. A volte,
però, può accadere che permangano dei dubbi diagnostici
anche alla luce di biopsie ripetute, motivo per cui secondo alcuni è
da preferire la biopsia escissionale. A causa della crescita invasiva
della lesione non sempre tale modalità di campionamento
bioptico può essere condotta, in questi casi, pertanto, si
tende a preferire l'escissione completa della massa “a cielo
aperto” (13,14).
Per
quanto riguarda il trattamento non è possibile
identificare in letteratura un orientamento univoco. Allo stato
attuale, infatti, nessuna terapia medica o chirurgica per tale
patologia è stata effettivamente valutata in un contesto di
trial clinico controllato e randomizzato (causa, certamente, la
scarsa incidenza del quadro patologico) (15).
In
generale, comunque, si ritiene che il ricorso combinato ad entrambi
gli approcci, medico e chirurgico, rappresenti probabilmente la
migliore strategia terapeutica (16). In particolare, il ricorso alla
terapia chirurgica dovrebbe essere considerato in presenza di una
importante ostruzione ureterale ed in tutti i casi che si dimostrano
scarsamente responsivi alla sola terapia medica. In linea con questo
orientamento alcuni autori (7) consigliano di risolvere l'eventuale
ostruzione ureterale (mediante inserzione di stent o ureterolisi) in
modo da ristabilire la funzione renale e instaurare un trattamento
con cortisonici così da consentire la regressione completa o
comunque il controllo della malattia. Tale tipologia di approccio
consentirebbe, peraltro, di ridurre al minimo il rischio di
ricorrenza della malattia valutabile nell'ordine dell'8% (17).
Riferendoci
alla sola terapia medica, i corticosteroidi rivestono un ruolo di
primo piano (18,19) anche se non esiste, ancora, un univoco
orientamento in termini di dose e durata della terapia stessa. (20)
Nel caso di pazienti non rispondenti alla terapia steroidea, quota
valutabile nell'ordine del 25% (21) o in presenza di effetti
avversi della stessa terapia (vedi il caso di J.) vanno considerate
altre strategie terapeutiche, in particolare segnaliamo il ricorso
alla terapia immunosoppressiva ed antiestrogenica.
Alcuni
autori, peraltro, ritengono che la stessa terapia immunosoppressiva
possa essere considerata come prima scelta nei pazienti con FRI. In
particolare, segnaliamo l'utilizzo di Azatioprina, Metotrexate,
Ciclofosfamide e Ciclosporina (22-24).
Infine,
sono sempre più numerose le segnalazioni di evidenza di
efficacia della terapia con Tamoxifene (25-27).
Si tratta
di un antiestrogeno non steroideo il cui ruolo terapeutico nei
confronti della FRI è stato ipotizzato in ragione
dell'efficacia dimostrata nell'indurre la regressione di tumori
desmoidi, lesioni caratterizzate anch'esse da un'anomala
proliferazione di elementi fibroblastici. La sua azione specifica
sembrerebbe riconducibile all'inibizione dell'ossidazione di
lipoproteine come la ceratide incriminate nel meccanismo
fisiopatologico della fibrosi retroperitoneale. Inoltre, il
tamoxifene determinerebbe la formazione di una forma “anomala” di
TGF-b (trasforming growth factor b) da parte dei fibroblasti presenti
nel tessuto fibrotico. Il TGF-b anomalo, così prodotto, è
in grado di determinare un'azione inibitoria nei confronti del
processo infiammatorio e dell'attività fibroblastica (azione
antiFGF-like) attraverso un meccanismo di feed-back negativo sui
macrofagi (28). Il farmaco andrebbe somministrato con un dosaggio di
10 mg x2/die per un tempo variabile dai 10 mesi ai 2 anni di terapia.
L'efficacia sul piano clinico si dimostrerebbe già nei primi
mesi di terapia con una evidenza di miglioramento sul piano
radiologico valutabile dopo 3-6 mesi (29,30). In corso di terapia con
Tamoxifene è opportuno procedere al monitoraggio della
funzionalità epatica (possibile rialzo reversibile delle
transaminasi) e della coagulazione con d-dimero (effetto
pro-trombotico). Ulteriori effetti collaterali riguardano la
possibilità di insorgenza di cisti ovariche, osteoporosi e
tumori uterini (solo in caso di trattamenti a lungo termine).
Il
follow-up a lungo termine è comunque mandatorio nei pazienti
affetti da FRI indipendentemente dalla terapia avviata, soprattutto
in considerazione del rischio di ricorrenza della patologia che si
dimostra particolarmente “imprevedibile” potendo questa
ripresentarsi in un periodo variabile dai 3 mesi ai 10 anni dopo
l'iniziale diagnosi e trattamento (31). Il monitoraggio deve essere
effettuato principalmente ricorrendo a tecniche di imaging a distanza
(ecografia, Tc, RMN) in associazione alle valutazioni
laboratoristiche (funzionalità renale, indici di flogosi…).
Laprognosi a lungo termine della FRI è eccellente, con
tasso di guarigione superiore al 90% per i pazienti senza
compromissione renale. Per quanto riguarda invece i soggetti con
coinvolgimento renale, se non trattati, la malattia può
determinare nella maggior parte dei casi una progressione fino a
giungere all'insufficienza renale grave. Ovviamente, tali dati si
riferiscono alle sole forme idiopatiche; nei pazienti con FR
secondaria a malignità è riportata una sopravvivenza
media di 3-6 mesi dalla diagnosi (32).
1. Brooks
MT, Magil HL, Hanna SL, et al. Case of the day. Pediatric Idiopathic
retroperitoneal fibrosis. RadioGraphics 1990; 10: 1096-1100
2. Tralce
L, Antonelli A, Dotti P, Cunico SC. Epidemiology, clinical features
and treatment of
idiopathic
retroperitoneal fibrosis: our experience. Arch Ital Urol Androl
2004;76(3):135-9
3.
Marcolongo R, Tavolini IM, Laveder F, Busa M et al. Immunosuppressive
Therapy for Idiopathic Retroperitoneal Fibrosis: A retrospective
analysis of 26 cases. The American Journal of Medicine 2004;1:194-197
4. Ergen
FB, Arslan EB, Turkbey B, Akinci D et al. Unilateral Perirenal
Fibrosis. Journal of computer assisted tomography 2005;29(4): 477-480
5.
Kamisawa T, Matsukawa M, Ohkawa M. Autoimmune pancreatitis associated
with Retroperitoneal Fibrosis. J Pancreas 2005; 6(3):260-263
6. Amiya
E, Ishizaka N, Watanabe A, Endo Y et al. Retroperitoneal Fibrosis
with Periaortic and Pericardial Involvement. Circ J 2005;69:760-762
7. Vivas
I, Nicolas AI, Velazquez P. Retroperitoneal fibrosis: typical and
atypical manifestations. The British Journal of Radiology
2000;73:214-222
8. Greco
P, Vaglio A, Manenti L, et al. Idiopathic retroperitoneal fibrosis. G
Ital Nefrol 2004; 21(2):132-8
9. Tralce
L, Antonelli A, Dotti P, Cunico SC. Epidemiology, clinical features
and treatment of idiopathic retroperitoneal fibrosis: our experience.
Arch Ital Urol Androl 2004;76(3):135-9
10.
Vaglio A, Salvarani C, Buzio C. Retroperitoneal Fibrosis. Lancet
2006; 367:241-251.
11. Meier
P., Gilabert C., Burnier M., Blanc E. Retroperitoneal fibrosis, an
unrecognized inflammatory disease. Clinical observations and review
of the literature. Nephrologie 2003;24(4):173-80
12. Monev
S. Idiopathic retroperitoneal fibrosis: prompt diagnosis preserves
organ gunction. Cleve Clin J Med 2002; 69 (2):160-166
13.
Takashima T, Onoda N, Ishikawa T, Koyama T, Inaba M, Nishizawa Y,
Nakatani T, Wakasa K, Hirakawa K. Tumor-forming idopathic
retroperitoneal fibrosis: report of a case. Surg Todey
2004;34(4):374-8
14.
Czauderna P, Schaarschmidt K, Komasara L, harms D, Lempe M, Vorpahl
K, Szumera M, Balanda A. Abdominal inflammatory masses mimicking
neoplasia in children-experience of two centers. Pediatr Surg Int
2005;21(5):346-50
15.
Estrade V, Traxer O, Sibony M, Haab F. Retroperitoneal fibrosis. Ann
Urol 2004; 38(1):3-13
16.
Heidenreich A, Derakhshani P, Neubauer S, Krug B. Treatment outcomes
in primary and secondary retroperitoneal fibrosis. Urologe A. 2000
Mar; 39 (2) : 141-148
17.
Tziomalos K, Krikis N, Karagiannis A, Perifanis V et al. Treatment of
idiopathic retroperitoneal fibrosis with combined administration of
corticosteroids and tamoxifen. Clinical Nephrology, Vol 62 1/2004
18.
Kubota Y, Nomura Y, Tamaki M, Maeda S, Deguchi T. Four cases of
idiopathic retroperitoneal fibrosis markedly responsive to steroid
therapy. Hinyokika Kiyo. 2005; 51 (5):315-319
19.
Kaaroud H, Jeri E, Beji S, Ben Moussa F, Ben Hamida F et al.
Retroperitoneal fibrosis. Presse Med. 2005 Feb 12; 34 (3) :213-217
20.
Kardar AH, Kattan S, Lindsted E, Hanash K. Steroid therapy for
idiopatic retroperitoneal fibrosis: dose and duration. J urol 168:
550-555
21.
Brechignac X, de Wazieres B, Desmurs H, Gil H et al. New medical
treatments of systemic idiopathic fobrosis. Rev Med Interne. 1997; 18
(12): 967-971
22.
Kurzawska-Firlej D, Suchanek-Krawiec A, Pirnik T, Oko A. Outcome of
immunosuppressive treatment of a patient with renal failure due to
retroperitoneal fibrosis. Pol Arch Med Wewn 2004;112 (1):845-848
23.
Oosterlinck W, Derie A. New data onn diagnosis and medical treatment
of retroperitoneal fibrosis. Acta Urol belg. 1997; 65(2): 3-6
24.
Scavalli AS, Spadaro A, Riccieri V, Ricciuti GP, Taccari E et al.
Long-term follow-up of low dose methotrexate therapy in one case of
idiopathic retroperitonealfibrosis. Clin Rheumatol. 1995;14(4)
:481-484
25.
Manero C, Navas-Parejo A, Prados MD, Garcia-Valdecasas J et al. Acute
obstructive renal failure to retroperitoneal mass. Nefrologia.
2004;24 Suppl 3: 49-55
26. Del
Peso G, Bajo MA, Gil F, Aguilera A, Ros S etal. Clinical experience
with tamoxifene in peritoneal fibrosing syndrome. Adv Perit Dial.
2003; 19 :32-35
27. Ihsan
Ergun, Kenan Keven, Basol Canbakan, Yakup Ekmekci, & Bulent
Erbay. Tamoxifen in the treatment of idiopatic retroperitoneal
fibrosis, International Urology and Nephrology 2005;37:341-343
28. Al
Rabi N, Graziani R, Cerruto MA, Baldassarre R, Ficarra V, Artibani W.
Clinical and radiological evolution of a case of idiopathic
retroperitoneal fibrosis treated with tamoxifen. Scand J Urol Nephrol
36; 391-392, 2002
29.
Dedeoglu F, Rose DC, Balu H, Athreya, Conard K et al. Succesful
Treatment of Retroperitoneal fibrosis with Tamoxifen in a Child. J
Rheumatol 2001; 28: 1693-1695
30. Van
Bommel E FH, Hendriksz TR, Huiskes A, Zeegers A. Brief comunication:
Tamoxifen Therapy for Nonmalignant Retroperitoneal Fibrosis. Ann
Intern Med. 2006; 144: 101-106
31. van
Bommel EF. Retroperitoneal fibrosis. Neth J Med 2002; 60; 231-242
32.
Kurzawska-Firlej D, Suchanek-Krawiec A, Piernik T, Oko A. Outcome of
immunosoppressive treatment of a patient with renal failure due to
retroperitoneal fibrosis. Pol Arch Med Wewn 2004;112(1):845-8
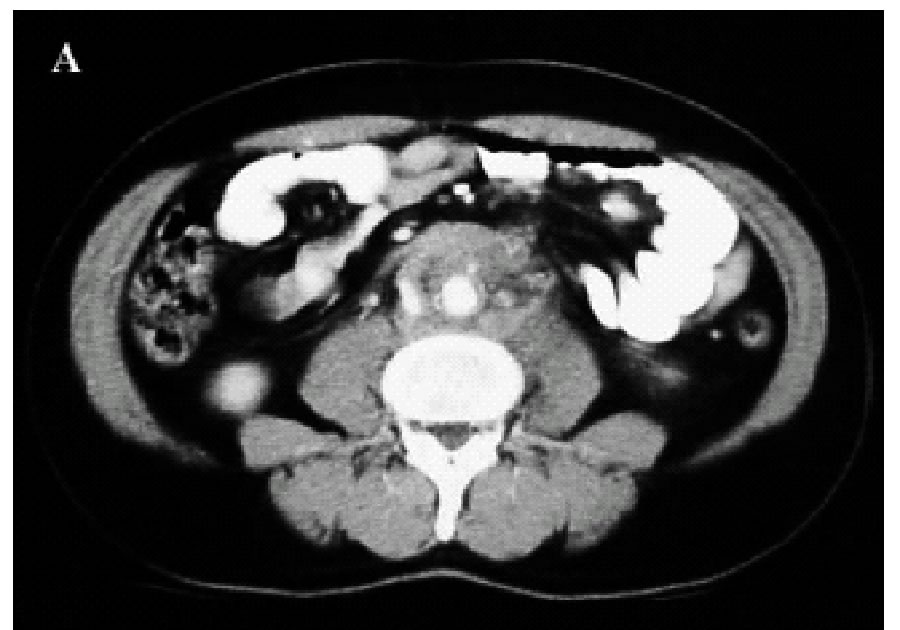
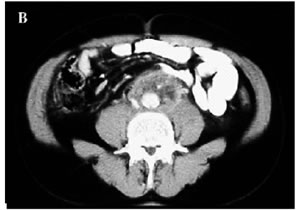
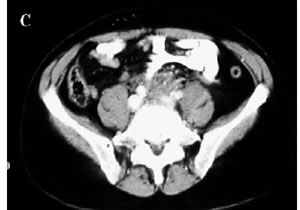
Figura
1. A-C: Tc spirale con MdC; evidenza di tessuto fibroso in sede
retroperitoneale disposto attorno all'aorta,alla vena cava
inferiore e alla biforcazione iliaca.(Da referenza 30)
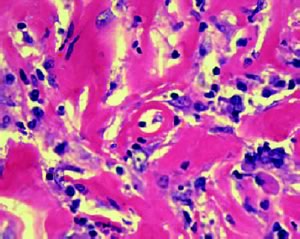
Figura
2. Preparato istologico di fibrosi retroperitoneale; importante
infiltrato infiammatorio immerso tra bande di tessuto collagene. (S.
Jogai, A. Al-Jassar and L. Temmim. Cytopathology 2005, 16, 49–54)
Figura
3: ecocolor doppler; massa fibrotica che circoscrive l'aorta e la
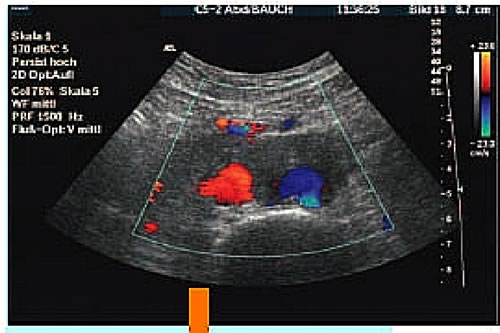
vena cava inferiore.(Ultraschall Med 2005; 26: 91-93)
Figura
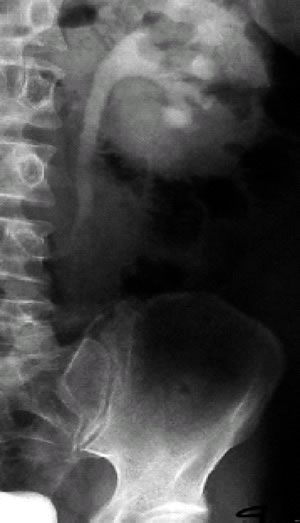
4: urografia intravenosa; idronefrosi sx. con evidenza di stenosi
ureterale all'altezza di L-4.(Da referenza 30)
Vuoi citare questo contributo?