Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Marzo 2005 - Volume VIII - numero 3
M&B Pagine Elettroniche
Seminari degli specializzandi
L'ipotiroidismo
dalla nascita in poi
Clinica
Pediatrica, IRCCS Burlo Garofolo, Trieste
Indirizzo
per corrispondenza: iberti@yahoo.com
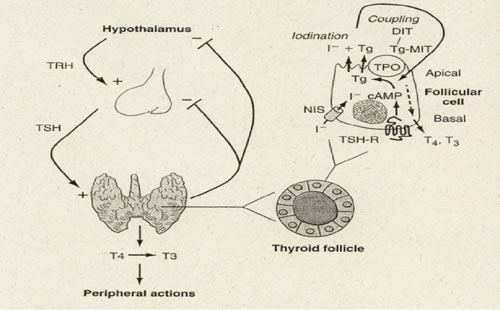
LA
FISIOLOGIA TIROIDEA
La
ghiandola tiroide concentra lo ione ioduro di derivazione alimentare
di 20-40 volte rispetto al suo livello ematico; questo ione viene
trasportato all' interno del follicolo tiroideo, dove si lega, sotto
forma di iodio, ad una proteina di deposito: la tireoglobulina (TG).
All'interno delle cellule ghiandolari, lo ione ioduro viene
organificato a formare gli ormoni tiroidei (triiodiotironina o T3 e
tetraiodiotironina o T4) che sono rilasciati nel sangue a seguito
della stimolazione da parte dell'ormone ipofisario tireotropina o
TSH.
A livello
ematico gli ormoni tiroidei sono veicolati per oltre il 99% dalle
proteine di trasporto (per la maggior parte dalla globulina legante
la tiroxina o TBG, poi dall'albumina e dalla prealbumina), mentre
solo la quota libera degli ormoni tiroidei (fT3 e fT4) è
biologicamente attiva a livello tessutale.
Le
funzioni dell'ormone tiroideo sono:
-
Favorire lo sviluppo del SNC: a livello cerebrale ci sono 3 isoforme
per il recettore degli ormoni tiroidei.
-
Stimolare la sintesi delle proteine soprattutto muscolari.
- Agire
sulla crescita (stimolando la pulsattilità del GHRH,
stimolando la sintesi epatica dell'IGF1, stimolando la sintesi dei
recettori del GH)
.

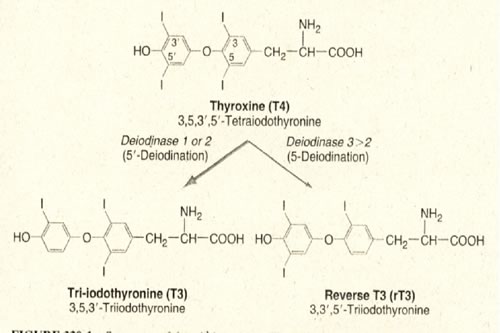
L'ormone
prodotto in quantità maggiore dalla tiroide, cioè il
T4, subisce perifericamente una conversione a T3 o alla sua forma
biologicamente inattiva, il corrispondente stereoisomero rT3. Il
rapporto tra T3 ed rT3 nel siero non è costante e può
sensibilmente variare in diverse situazioni.
La
regolazione della funzionalità tiroidea ruota attorno alla
stimolazione della tiroide da parte del TSH e al feedback negativo
esercitato dagli ormoni tiroidei sulla stessa secrezione di TSH da
parte dell'ipofisi. Un feedback negativo è esercitato dagli
ormoni tiroidei anche a livello ipotalamico sulla secrezione di TRH e
somatostatina, due ormoni che stimolano e inibiscono rispettivamente
il rilascio di TSH
Nel feto
è presente un abbozzo di tessuto tiroideo già a partire
dall'ottava settimana di gestazione, in un quadro di ipotiroidismo
relativo fisiologico, spiegato dal concomitante riscontro di basse
concentrazioni di ormoni liberi e di TSH, il che suggerisce
l'esistenza nel feto di una soglia del TSH inusualmente bassa;
inoltre, a livello periferico il T3 risulta basso per la presenza di
una maggiore trasformazione del T4 in rT3 inattivo, situazione anche
conosciuta col termine “sindrome da basso T3”. I livelli ematici
di T4 totale aumentano gradualmente durante la gravidanza,
parallelamente ad un aumento sia della TBG che dell'fT4, e
progressivamente la quota di T3 cresce rispetto alla rT3. La barriera
placentare è del tutto impermeabile al TSH, è
parzialmente permeabile a T4 e T3, mentre lo è
significativamente allo iodio, al TRH, agli anticorpi tireostimolanti
e ai farmaci antitiroidei. Gli ormoni materni passano la placenta a
partire dalla seconda metà della gravidanza in piccola
quantità (30-40% del fabbisogno); questi ormoni tuttavia sono
sufficienti per uno sviluppo intrauterino adeguato del SNC anche
nell'ipotiroideo non grave.
Dopo la
nascita l'aumento del TSH e degli ormoni T3 e T4 in un primo
momento è intenso: nelle prime ore dopo la nascita il neonato
si trova in una sorta di ipertiroidismo fisiologico, una situazione
indispensabile per l'adattamento alla vita extrauterina e per la
produzione di calore in un ambiente termicamente sfavorevole rispetto
a quello intrauterino. Nel giro di 3-5 giorni questi valori si
normalizzano attraverso un riassetto del feed-back
ipofisi-tiroide-ipofisi per poi stabilizzar si a circa 3-4 settimane
di vita (1-3).
L'ipotiroidismo
è una delle malattie endocrinologiche di più frequente
riscontro. In età pediatrica è sicuramente l'affezione
più frequente della tiroide; esistono due forme di
ipotiroidismo, una congenita (IC) e una acquisita (IA)
o a insorgenza post-natale.
Inoltre
un'altra distinzione può essere fatta in base alla sede del
danno patologico in:
-
Ipotiroidismo primario, per una disfunzione primitiva della tiroide.
-
Ipotiroidismo secondario, dato da un danno a livello ipofisario.
-
Ipotiroidismo terziario, per un danno a livello ipotalamico.
Ognuna di
queste tre forme di ipotiroidismo riconosce diverse cause.
IPOTIROIDISMO
CONGENITO
L'IC ha
un'incidenza di 1/4000 casi/anno, il rapporto maschi/femmine è
di 2,5/1. La sua patogenesi è poligenica-multifattoriale,
sembra implicata anche l'autoimmunità che probabilmente gioca
un ruolo importante (di fatto alcuni studi ipotizzano la presenza di
anticorpi materni che bloccano la crescita della tiroide fetale). La
precocità della diagnosi è sempre stata considerata
indispensabile per prevenire un danno neurologico severo ed è
per questo che si attua lo screening neonatale della malattia tramite
un dosaggio alla nascita del TSH e del FT4.
Classificazione.
Le forme
di ipotiroidismo congenito sono :
1.IPOTIROIDISMO
PRIMITIVO MALFORMATIVO: conta per il 90% casi (ipo-a-genesia della
tiroide, ectopia )
Le
agenesie totali sono il 36% dei casi, le ipoplasie sono il 18% dei
casi, le ectopie sono il 45% dei casi. Il tessuto tiroideo può
localizzarsi a livello sublinguale, lungo il decorso del dotto
tireoglosso e in sede intratoracica.
2.IPOTIROIDISMO
PRIMITIVO DA DIFETTO MOLECOLARE: conta per il 10% casi. Si tratta dei
difetti di captazione dello iodio, del difetto di organificazione
dello Iodio, del difetto della tireoglobulina, del difetto di
deiodinasi della iodotirosina o di difetti di attività del TSH
o degli ormoni tiroidei.
3.IPOTIROIDISMO
SECONDARIO/TERZIARIO da difetto molecolare ipofisario o ipotalamico
(sintesi di TSH o TRH o di panipotiroidismo sporadico o familiare).
E' un evento raro (1:60000, 1:140000 casi).
4.
IPOTIRIDISMO TRANSITORIO NEONATALE. E' stato scoperto grazie
all'avvio dello screening: i soggetti affetti risultano falsamente
positivi a causa di una carenza o di un eccesso di iodio durante la
gravidanza, a di una sofferenza neonatale o di un'immaturità
dell'asse ipotalamo-ipofisario.
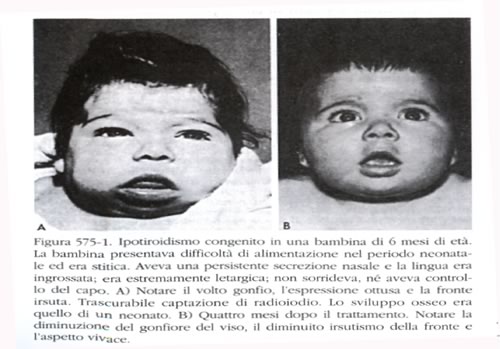
La
situazione clinica.
L'ipotiroideo
alla nascita si presenta di peso e di lunghezza normali, ma le
dimensioni della testa possono essere leggermente aumentate a causa
del mixedema.
Il
protrarsi dell'ittero fisiologico del neonato, dovuto alla ritardata
maturazione degli enzimi deputati alla glucuronazione della
bilirubina, può essere il primissimo segno della malattia.
Altri segni presenti durante il primo mese di vita sono la difficoltà
di alimentazione, la scarsa interazione con l'ambiente, la
sonnolenza, gli episodi di soffocamento durante l'allattamento.
Difficoltà respiratorie dovute in parte alla macroglossia (si
possono contare anche episodi asfittici), una respirazione rumorosa,
l'ostruzione nasale possono essere altri segni d'accompagnamento. I
bambini affetti piangono poco, dormono molto, hanno scarso appetito e
sono poco reattivi. Vi può essere stipsi che non risponde al
trattamento convenzionale. L'addome è globoso e può
essere presente un'ernia ombelicale. Spesso è presente anemia
refrattaria al trattamento. Col passare del tempo il piccolo stenta a
crescere, gli arti si presentano corti, le fontanelle sono ampie, la
dentizione è ritardata. La cute appare secca, squamosa,
mixedematosa.
I segni
dell'ipotiroidismo congenito si fanno progressivamente più
evidenti con il passare dell'età (progressivo deterioramento
delle facoltà mentali, caratteristico rallentamento della
velocità di crescita staturale) e le percentuali di diagnosi,
in assenza di screening neonatale, salgono fino al 100% dopo i 3-4
anni.
SEGNI
CLINICI DI IC E LORO FREQUENZA NEL NEONATO | |
ITTERO
PROTRATTO | 90% |
FONTANELLA
POSTERIORE >0.5 CM | 80% |
ERNIA
OMBELICALE | 68% |
SUZIONE
TORPIDA | 65% |
ASSENZA
DEL NUCLEO DISTALE DEL FEMORE | 60% |
ASSENZA
DEL NUCLEO PROSSIMALE DELLA TIBIA | 50% |
STIPSI | 48% |
MACROGLOSSIA | 40% |
MOVIMENTI
SPONTANEI TORPIDI (FLOPPY CHILD) | 25% |
BRADICARDIA
(<100 AL MINUTO) | 20% |
ASPETTI
CLINICI RILEVANTI NELLE FORME CONGENITE NEONATALI E IN QUELLE
CONGENITE ED ACQUISITE NELLE ETA' SUCCESSIVE. | |
Nel
neonato (forme congenite) | Nelle
età successive (forme congenite e acquisite) |
ERNIA
OMBELICALE
PERSISTENZA
DELL' ITTERO FISIOLOGICO
PERSISTENZA
FONTANELLA POSTERIORE
MACROGLOSSIA
IPOTONIA
SONNOLENZA
DEFICIT
DI SUZIONE
BRADICARDIA
(<125/M)
IPOTENSIONE
STIPSI
GOZZO
(IN CASI PARTICOLARI)
RITARDO
DELLA MATURAZIONE OSSEA | MIXEDEMA
CUTE
SECCA
CAPELLI
RADI
IPOTONIA
SONNOLENZA
PALLORE
GOZZO
(SOPRATTUTTO NELLE FM ACQUISITE)
BRADICARDIA
IPOTENSIONE
STIPSI
RITARDO
DI ACCRESCIMENTO (EPIFIDI DISTALE DEL FEMORE E PROSSIMALE DELLA
TIBIA)
RITARDO
DELL'ETA' OSSEA
RITARDO
NELL'IDEAZIONE E MENTALE (NELLE FM CONGENITE NON TRATTATE |
La
diagnosi.
Se il
piccolo risulta positivo allo screening, i comportamenti sono diversi
a seconda del livello di TSH rilevato. Per un valore di TSH < 40
mU/ml con T4 6.5 mcg/dl sarà opportuno ripetere lo screening,
se invece il TSH è >100 mU/ml allora sarà opportuno
iniziare da subito la terapia senza aspettare il “rescreening”,
perché si tratta di un ipotiroidismo certo.
Il quadro
ormonale dell'ipotiroidismo primitivo è dato da bassi valori
di T4 con TSH elevato, invece l'ipotiroidismo secondario è
caratterizzato da livelli bassi sia di T4 che di TSH. Sarà
opportuno eseguire anche un dosaggio della tireoglobulina, che
risulterà indosabile in un'agenesia totale della tiroide,
perchè prodotta dalla ghiandola stessa. Tecniche di imaging
come l'ecografia tiroidea e la scintigrafia tiroidea con Iodio 123
sono utili per localizzare le possibili ectopie tiroidee e fare
diagnosi di difetto di organificazione dello iodio.
La
terapia
La
terapia sostitutiva con L-tiroxina sintetica si effettua al mattino,
a digiuno, 20 minuti prima di colazione con una dose iniziale nel
neonato pari a 10-15 mcg/Kg/die; il fabbisogno ormonale si abbasserà
poi nel corso degli anni fino ai 2-3 mcg/Kg/die dell'adolescente. In
passato la dose iniziale di terapia non superava i 10 mcg/Kg/die
perché alcuni lavori avevano segnalato possibili effetti
indesiderati sull'attenzione (4), la memoria e il comportamento,
senza in effetti ottenere un miglioramento significativo delle
performance intellettive. Molto recentemente sono invece stati
pubblicati dati convincenti che dimostrano come le dosi di 10-15
mcg/Kg/die non solo non provochino disturbi, ma anzi favoriscono il
raggiungimento di un QI finale più alto, con minore differenza
tra i casi di ipotiroidismo grave e moderato (5). Pertanto le
raccomandazioni attuali sono quelle relative alle alte dosi.
Follow-up
e prognosi
Nel primo
anno di vita sarà opportuno un controllo mensile degli ormoni
tiroidei, poi nel secondo anno di vita ogni 3-6 mesi. Nel corso del
follow-up sarà opportuno un controllo periodico dell'età
ossea e della crescita, una valutazione NPI e della funzionalità
uditiva e visiva (PEV/PEU). Recentemente si è visto (6) che i
pazienti con diagnosi di ipotiroidismo congenito tramite screening
neonatale possono avere un QI inferiore rispetto ai fratelli sani
alla stessa età (QI 6.2 punti in meno nella scala
WISC-R=Wechsler Intelligence Scale for Children). Questo lavoro
conferma quanto già detto in precedenti lavori che hanno
confrontato ipotiroidei diagnosticati allo screening con coetanei,
compagni di scuola sani (7). Questa riduzione del QI si ha negli
ipotiroidei da agenesia totale della ghiandola, e in quelli a cui
viene data una dose iniziale di L-tiroxina < a 8 mcg/Kg/die.
Nessuna differenza invece di età ossea tra i gruppi
confrontati, mentre sembrano essere inifluenti i livelli di tiroxina
alla diagnosi, o l'età all'inizio del trattamento.
IPOTIROIDISMO
ACQUISITO NELL'ETÀ PEDIATRICA
L'IA
(insorgenza post-natale) nell'età pediatrica è una
patologia generalmente giovanile.
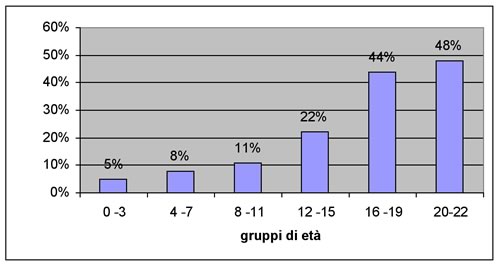
Epidemiologia:
La reale incidenza e prevalenza dell'IA nell'età
pediatrica in realtà non è ben documentata. Hunter e
coll. in uno studio del 2000 hanno calcolato la prevalenza
dell'ipotiroidismo in Inghilterra in base alla prescrizione di
tiroxina nei diversi gruppi di età, dimostrando che le
prescrizioni di ormone tiroideo sostitutivo aumentano in modo
sostanzialmente regolare con l'aumentare dell'età, con un
picco nella fascia di età tra i 16 e i 19 anni (8).
Nello
stesso studio sono state considerate le diagnosi per cui la tiroxina
veniva prescritta: tralasciando l'IC (27%), le restanti diagnosi di
ipotiroidismo riguardavano la tiroidite linfocitaria presentatasi con
ipotiroidismo (49%), quella che si è presentata con
ipertiroidismo (8%), l'ipotiroidismo secondario a morbo di Graves
(9%), il panipopituitarismo acquisito (4%), l'ipotiroidismo
secondario a carcinoma tiroideo (2%), l'ipotiroidismo secondario a
nodulo caldo (1%) ed infine l'ipotiroidismo secondario a altre
neoplasie (6%).
Classificazione
dell'ipotiroidismo acquisito
- IPOTIROIDISMO PRIMITIVO
- a. Tiroiditi
- - Tiroidite cronica linfocitaria o autoimmunitaria
- - Tiroidite subacuta di De Quervain,
- - Tiroidite silente
- b. Deficit o eccesso di iodio (sostanze o farmaci gozzigeni)
- c. Irradiazione o chirurgia tiroidea
- d. Malattie infiltrative o da accumulo (Cistinosi, emocromatosi, istiocitosi X, amiloidosi, etc…)
- IPOTIROIDISMO SECONDARIO O TERZIARIO
- a. Tumori ipotalamici/ipofisari (craniofaringiama)
- b. Terapia radiante/chirurgica (tumori cerebrali)
- c. Processi infiltrativi/granulomatosi (sarcoidosi)
La
situazione clinica
Le
caratteristiche cliniche dell'IA nell'età pediatrica non
neonatale sono molteplici, ma il quadro può anche essere
sfumato e di difficile interpretazione. Si può sospettare un
ipotiroidismo in caso di:
â¢Mixedema,
gozzo e voce rauca.
â¢Diminuzione
della velocità di crescita, ritardo della maturazione ossea e
dentale, sproporzione tronco-arti.
â¢Letargia,
ipotonia, riflessi torpidi, stipsi, umore depresso.
â¢Intolleranza
al freddo.
â¢Pelle
secca, pallida, perdita di capelli e irsutismo.
â¢Difficoltà
di concentrazione e di memoria.
â¢Ingrandimento
cardiaco (se visto all'Rx può essere spiegato sia dal
versamento pericardio che dalla dilatazione cardiaca), bradicardia,
ascite.
â¢Pubertà
tardiva, ma a volte pubertà precoce parziale (l'aumento del
TSH può causare un aumento per trascinamento anche di PRL e
FSH) (9).
In alcuni
casi la clinica è così sfumata che solo l'occasionale
riscontro di alcuni valori di laboratorio alterati possono indurre il
sospetto di ipotiroidismo, come ad esempio:
â¢Anemia
(normo o macrocitica).
â¢Aumento
di Colesterolo e trigliceridi.
â¢Aumento
di CPK.
â¢Aumento
della creatinina (stato ipodinamico) (10).
â¢Diminuzione
di fattore di Von Willerbrand, fattore V e VIII (11).
La
diagnosi
Nell'ipotiroidismo
acquisito primario, oltre ovviamente ad una diminuzione dell'fT4,
troveremo il TSH aumentato. In caso di ipotiroidismo acquisito
secondario o terziario, invece, diminuiscono notevolmente sia l'fT4
che il TSH. Per completare le indagini nel primo caso sarà
opportuno eseguire un'ecografia (in questi ultimi anni l'ecografia
è ritenuta l'indagine più importante in caso di
tiroidine), mentre l'unica situazione in cui la scintigrafia può
realmente essere utile riguarda l'ipertiroidismo, perchè
permette di distinguere una tiroidite di Hashimoto in fase
ipertiroidea, in cui la ghiandola è diffusamente ipocaptante,
da una tiroidite di Basedow, ipercaptante. Utile nella diagnosi
differenziale è anche la ricerca degli autoanticorpi
anti-tiroide.
Il test
al TRH è utile invece nel distinguere l'ipotiroidismo
secondario dal terziario. La cosa prioritaria, in caso di
ipotiroidismo secondario o terziario, è però eseguire
una RMN cerebrale per verificare la presenza di processi espansivi o
infiltrativi che possano essere la causa della disfunzione ipofisaria
o ipotalamica.
Tiroiditi
La
tiroidite di gran lunga più frequente in età pediatrica
è la tiroidite cronica linfocitaria o autoimmunitaria, che
viene comunemente chiamata tiroidite di Hashimoto. In verità
bisogna precisare che questa ultima definizione si riferisce in modo
particolare alla forma di tiroidite ipofunzionante che manifesta il
gozzo. Rappresenta circa il 63% di tutti gli ipotiroidismi acquisiti,
cioè circa l'1% della popolazione pediatrica (il rapporto
femmine/maschi è di 4/1, soprattutto in età
adolescenziale). La sua frequenza è maggiore nella sindrome di
Turner, di Down e di Klinefelter, inoltre si può notare
un'associazione con altre patologie autoimmunitarie (ricordiamo ad
esempio che l'ipotiroidismo rientra nelle poliendocrinopatie tipo I
e II, ma anche che si trova con una frequenza del 16,4 % nel diabete
mellito tipo I, nella celiachia nelle malattie reumatiche). E'
stata provata una predisposizione genetica (associazione con HLA-DR3)
e sembra anche che l'esposizione agli estrogeni ne aumenti
l'incidenza.
La
patogenesi di questa malattia non è ancora del tutto spiegata,
in modo particolare non si conoscono le cause che scatenano la
risposta autoimmunitaria dell'organismo. In pratica si verifica
un'attivazione dei linfociti T CD4+ specifici per gli antigeni
tiroidei, che porta ad un'attivazione dei linfociti T CD8+
citotossici e ad un danno parenchimal, caratterizzato da
infiltrazione linfocitaria diffusa, presenza di plasmacellule e
atrofia follicolare; come epifenomeno si può osservare la
comparsa di anticorpi anti-tireoperossidasi (anti-TPO) e
anti-tireoglobulina (anti-TG). Clinicamente si possono distinguere
tre fasi: una fase di ipertiroidismo iniziale (causato da lisi
follicolare e auto-anticorpi stimolanti), una fase di eutiroidismo e
infine una fase di ipotiroidismo (danno tissutale e auto-anticorpi
bloccanti il TSH). La diagnosi si basa su un riscontro di un
ipotiroidismo primario e di un danno tissutale all'ecografia (si
può notare un aumento dell'ipoecogenicità del
parenchima con alterazioni della struttura ghiandolare); gli
anticorpi anti-TPO e anti-TG sono solitamente presenti, ma non sono
da considerarsi diagnostici perché non sono sempre
strettamente correlati.
La
terapia si basa, come per l'ipotiroidismo congenito, sull'utilizzo
dell'ormone tiroideo sintetico: L-tiroxina 100-60 _g/m2 circa, da
iniziare gradualmente per evitare tremori, agitazione e insonnia e da
assumere la mattina a digiuno circa mezz'ora prima di colazione
(12). Il dosaggio della terapia andrà poi aggiustato e
monitorato in base all'fT4, che dovrà essere compreso nei
range di normalità e al TSH (che dovrà essere compreso
tra 4,5 – 5 e 8 _U/ml). Nel 10-15% dei casi si può assistere
ad un recupero funzionale, ma la sospensione della terapia dovrà
essere cauta poiché spesso vi è una recidiva
dell'insufficienza tiroidea, essendo molto frequenti, quasi
costanti, i fenomeni di atrofia ghiandolare più o meno
marcati.
Un
aumento di TSH con fT4 nella norma viene definito ipotiroidismo
subclinico. L'opportunità di trattare l'ipotiroidismo
subclinico è attualmente controversa. Tutti gli autori sono
comunque concordi nell'affermare che non esiste attualmente un
trattamento che impedisca l'evoluzione verso l'ipotiroidismo
franco. Alcuni giustificano la terapia sostitutiva prima che si
instauri un vero e proprio ipotiroidismo al fine di prevenire la
formazione del gozzo (13), ma bisogna ricordare che quest'ultimo è
causato sia dall'aumento del TSH, sia dall'infiltrazione
linfocitaria della ghiandola e da auto-anticorpi stimolanti la
crescita e la funzione cellulare. Altri autori preferiscono un
atteggiamento di attesa con controllo periodico di fT4 e TSH ogni 6
mesi oppure in occasione dell'insorgenza di sintomi di
ipotiroidismo; il motivo di questa scelta è il fatto che
alcuni pazienti non sviluppano mai un ipotiroidismo (14).
La
seconda forma più comune di infiammazione che causa
ipotiroidismo è la tiroidite subacuta di De Quervain, la cui
incidenza non è conosciuta ma è sicuramente
sottostimata. E' caratterizzata clinicamente da dolore a livello
della ghiandola che si irradia verso il capo, accompagnata da
disfagia e febbre. Da un punto di vista laboratoristico si può
osservare un aumento di VES e PCR più un modesto e incostante
aumento degli anticorpi anti-tireoperossidasi (anti-TPO) e
anti-tireoglobulina (anti-TG). L'eziologia è probabilmente
virale ed è caratterizzata da un ipertiroidismo iniziale
seguito da modico ipotiroidismo transitorio (12 mesi). La terapia si
basa sull'uso di antinfiammatori (aspirina o cortisonici); nella
prima fase ipertiroidea può essere necessario l'uso del
Propranololo, mentre nella fase ipotiroidea sono necessari dei
controlli ormonali ripetuti, visto che il 10% residua in
ipotiroidismo permanente.
Molto
rara in età pediatrica, tanto da poter essere considerata
quasi una curiosita, è la tiroidite silente. Questa presenta
un quadro clinico simile alla tiroidite subacuta ma è,
rispetto a questa, più limitata nel tempo; non si manifesta
con il gozzo ma causa dolore. Il quadro istologico è simile,
però, a quello della tiroidite cronica linfocitaria.
Il
deficit di iodio può essere causato da diversi tipi di farmaci
(antitiroidei, antiepilettici, litio e interferon _) ma anche da
alimenti che inibiscono l'assorbimento di iodio (come ad esempio
broccoli, cavoli, crauti, ecc…). Esistono inoltre zone (anche in
Italia) con deficit iodico nell'acqua e nel suolo (15), ma bisogna
ricordare che anche un eccesso di iodio può causare un blocco
tiroideo tramite l'effetto di Wolff-Chaikoff, per cui bisogna fare
attenzione a disinfettanti iodurati (soprattutto nei neonati),
amiodarone, creme e prodotti orali dimagranti a base di iodio, alghe
marine e tiroxina (16).
Altra
causa importante di deficit tiroideo è l'irradiazione o la
chirurgia tiroidea come cura di un precedente ipertirodismo
intrattabile, a causa di una neoplasia, di un trapianto di midollo
osseo o incidenti nucleari (17).
Parlando
di ipotiroidismo si può ricordare, forse un po'
impropriamente, l'Euthyroid Sick Syndrome, che a dispetto del nome
non rappresenta una patologia, ma una situazione di adattamento a
stati di carenza energetica; si caratterizza da un'aumenta la
produzione di rT3 (forma inattiva della T3) e conseguente diminuzione
della forma attiva. Questa condizione è tipica nel pretermine
o nei neonati con sofferenza perinatale, ma è caratteristica
anche dell'anoressia nervosa, delle malattie croniche, della
malnutrizione, etc…Tutto ciò permette una diminuzione del
metabolismo basale e non va trattato.
Altra
forma rarissima di ipotiroidismo (quasi una curiosità) si può
riscontrare nell'ambito della resistenza agli ormoni tiroidei.
Questa condizione può essere caratterizzata da aumento di TSH,
fT3 e fT4 con gozzo ma resistenza generalizzata a questi ormoni
(eu-ipotiroidismo clinico); la resistenza dei recettori può
essere invece a livello pituitario, causando perciò un aumento
del valore degli ormoni tiroidei (il loro livello viene infatti
erroneamente percepito dall'ipofisi come basso, viene perciò
stimolata la sintesi di TSH e secondariamente di altri ormoni
tiroidei); un'ultima forma è la resistenza dei recettori
tiroidei con distribuzione a mosaico: in questo caso possono
coesistere organi che sono resistenti agli ormoni tiroidei ed altri
che invece rispondono in modo adeguato alla loro stimolazione. E'
importante in questi casi non trattare il paziente in base ai valori
ormonali ma basare la terapia solo sui sintomi presentati dai
pazienti.
LO
SCREENING DELL'IPOTIROIDISMO CONGENITO: LE RAGIONI DEL “SÌ”,
LE RAGIONI DEL “NO”.
Per
affrontare il problema dello screening, partiamo da una semplice
domanda: è possibile diagnosticare in maniera efficace l'IC
senza ricorrere allo screening? La risposta che troviamo in un
articolo sull'argomento di Giorgio Tonini e Marzia Lazzerini
pubblicato su Medico e Bambino qualche anno fa (1999;18:481-488) (2),
è molto perentoria: “lo screening dell'IC è senza
possibilità di appello, INDISPENSABILE per la diagnosi precoce
di tutti i soggetti potenzialmente affetti”.
Nei
paragrafi che seguono analizzeremo in maniera approfondita gli
elementi che supportano la tesi dello screening e quelli che invece
non lo ritengono necessario e vedremo quale sarà la nostra
conclusione.
Un buon
punto di partenza potrebbe essere la valutazione dei criteri generali
di appropriatezza di uno screening secondo Cochrane con
un'applicazione nello specifico nei riguardi dell'IC.
Criteri
di Cochrane: la malattia da sottoporre a screening deve essere:
1.
frequente
2. ad
elevata mortalità/morbilità
3.
difficile da diagnosticare senza screening
4. deve
esserci una terapia efficace e praticabile
5. deve
essere disponibile un test sensibile e specifico
L'IC è
frequente. La prevalenza attuale si attesta tra 1:2000 e 1:4000, ed è
quella rilevata grazie proprio all'introduzione dello screening,
che ha permesso di fare più diagnosi e perdere meno casi.
Infatti negli anni '70-'80 la prevalenza era compresa tra 1:5000
e 1:10.000.
L'IC
può sfuggire senza lo screening, perché non sempre
i segni e i sintomi presenti alla nascita o nei primi giorni di vita
sono così espliciti. La tabella mostra la frequenza delle
diagnosi su base clinica in relazione all'età e fa vedere
molto chiaramente come solo il 10% dei casi verrebbe diagnosticato
entro il primo mese di vita, mentre la totalità dei casi si
rileverebbe solo all'età di 3-4 anni.
FREQUENZA
DELLE DIAGNOSI IN BASE AI SEGNI CLINICI
- 10% nel
primo mese di vita
- 35% nei
primi 3 mesi
- 70% nel
primo anno
- 100%
solo dopo il 3°-4° anno di vita
L'IC è
anche gravato da un'importante morbilità. Infatti il
trattamento sostitutivo deve essere iniziato il più presto
possibile ed è stato descritto un chiaro vantaggio in termini
di corretto accrescimento e soprattutto di prevenzione del ritardo
mentale legato alla tempestività della diagnosi e del
trattamento (18,19). Questo è così vero che non viene
considerato sbagliato, in caso di sospetto, iniziare la terapia con
L-tiroxina in attesa degli esami per poi eventualmente sospenderla.
D'altra
parte molti lavori dimostrano che purtroppo un bambino affetto da IC
a prescindere dalla precocità della diagnosi e della terapia
avrà comunque un deficit intellettivo misurabile, tanto
maggiore quanto più grave era il quadro clinico all'esordio
(18,20). Ed è proprio basandosi su queste affermazioni che i
difensori dell'inutilità dello screening sostengono la loro
tesi, ovvero ritengono che nei casi gravi la diagnosi è ovvia
e la terapia, per quanto precoce, probabilmente non sufficiente ad
evitare il ritardo mentale, mentre nei casi più lievi, anche
un ritardo diagnostico non sarebbe determinante per la prognosi (21)
.
Continuando
la nostra analisi dei 5 punti di Cochrane, per l'IC sicuramente
esiste una terapia efficace e praticabile ed infine va
valutata la disponibilità di test di screening che abbiano unabuona sensibilità e un'altrettanto buona
specificità (22). Ed è proprio questo il punto più
dolente. Infatti per cominciare a sostenere le ragioni del NO,
potremmo proprio partire dal fatto che la scelta del test è
molto importante e ad es. non in tutti i centri italiani si usano gli
stessi test.
Quali
sono le possibilità:
- solo
TSH, che ovviamente risulta alto in caso di IC: test
gravato da un 8-10% di falsi positivi, in grado di identificare sì
le forme di IC primario ma non quelle secondarie e terziarie, in cui
il TSH è basso o aumenta tardivamente.
- solo
T4, che al contrario sarà basso in caso di IC.
Questo approccio è gravato da un 10-20% di falsi negativi ed è
in grado di identificare l'IC primario ed anche quello secondario e
terziario, ma non vede le forme di IC primario“compensato”.
Esiste
poi il problema del difetto della globulina legante la tiroxina
(TBG), malattia X-linked dominante con una frequenza comparabile a
quella dell'IC (1:2400 neonati maschi), in cui il T4 è
basso, ma sono normali il TSH e fT4. Per questo, ma anche per i
motivi ricordati sopra, sicuramente il test migliore deriva dallacombinazione del dosaggio di TSH e T4, che viene attuato nel
50% dei centri italiani.
Le
ragioni a sostegno del NO, quindi, si basano non solo sull'idea che
la clinica da sola è in grado di identificare i casi più
seri, in cui comunque la terapia non sarà del tutto
“curativa”, ma soprattutto il rischio di errore, legato alla
sensibilità molto elevata dei test, ma la loro scarsa
specificità. Un problema è quello dei falsi positivi
derivanti per lo più dalla condizione di ipotiroidismo
transitorio neonatale (frequenza 1:2500-1:4000), che si assesta senza
terapia, in cui il TSH è transitoriamente basso in seguito a
carenza o eccesso di iodio oppure alla presenza di una tiroidite
autoimmune materna. Ma esistono anche i falsi negativi, che invece
dipendono da un ritardo nell'attivazione dell'asse
ipotalamo-ipofisario, da considerarsi fisiologico solo nei prematuri.
In questi casi il TSH e il T4 sono bassi, di solito non è
necessario alcun trattamento, ma secondo alcuni autori sarebbe
indicato un “retesting” per evitare di perdere reali IC.
Alla fine
delle fini questi inconvenienti sono superabili solo con dei test di
conferma (retesting da prelievo venoso, scintigrafia, ecografia).
L'approccio migliore rimane probabilmente quello dello screening di
massa, con la consapevolezza che lo screening da solo non può
bastare a fare la diagnosi di IC.
Prima di
chiudere vale la pena sottolineare l'importanza di uno screening
nelle donne in gravidanza, in particolare nel I trimestre (23).
Situazioni di ipotiroidismo subclinico o conclamato correlano infatti
con un ritardo nelle acquisizioni psicomotorie del bambino,
assolutamente prevenibile con la terapia sostitutiva alla madre.
Bibliografia
1.
Giovanelli G, Bona G, Chiorboli E e coll. Patologia tiroidea. In:
Bernasconi S, Iughetti L, Ghizzoni L, Endocrinologia Pediatrica.
McGraw-Hill, Milano, 2001.
2. Tonini
G. Lazzerini M. L'ipotiroidismo congenito. Medico e Bambino
1999;18:481-488
3.
Behrman, Kliegman, Jenson . Nelson Texbook of Pediatrics, 17 Th
Edition. Sander ed. Pagg 1872-1878
4. Fish
LH, Schwartz HL, Cavanaugh J et al. Replacement dose, metabolism and
bioavailability of levothyroxine in the treatment of hypothyroidism.
Role of triiodothyronine in pituitary feedbackin humans. NEJM
1987;316:764-770
5.
Oerbeck B, Sundet K, Kase B F, Heyerdahl S. Congenital Hypothyrodism:
no adverse affects of high dose thyroxine treatment on adult memory,
attention and behaviour. Arch Dis Child 2005;90:132-137
6. Joanne
F. Rovet Children With Congenital Hypothyroidism and Their Siblings:
Do They Really Differ? Pediatrics 2005 January;115:e52-e57
7.
Derksen-Lubsen G, Verkerk PH. Neuropsychologic development in
early-treated congenital hypothyroidism: analysis of literature data.
Pediatr Res. 1996;39 :561 –566
8. Hunter
I, Green SA, MacDonald TM, Morris AD. Prevalence and aetiology of
hypothyroidism in the young. Arch Dis Child 2000;83:207-210
9.
Niedziela M, Korman E. Severe hypotyroidism due to autoimmune
atrophic thyroiditis-predicted target height and a plausible
mechanism for sexual precocity. J Pediatr Endocrinol Metab 2001
Jul-Aug; 14(7):901-7
10.
Del-Rio Camacho G, Tapia Cebellos L, Picazo Angelin B et al. Renal
failure and acquired hypothyroidism. Pediatr Nefrol 2003 Mar;
18(3):290-2
11.
Setian N, Tenaka CM, Damiani D, Dichtchekenian V, Carneiro JD,
D'Amico EA. Hypopituitarismo, deficiency of factor V and VIII and
von Willebrand factor: an uncommon association. J Pediatr Endocrinol
Metab 2002 Mar; 15(3):331-3
12. Syper
AH, Swenerton P. Experience with low-dose replacement therapy in the
initial management of severe pediatric acquired primary
hypothyroidism. J Pediart Endocrinol Metab. 1998;11(4):543-7
13.
Rother KI, Zimmerman D, Schwenk WF. Effect of thyroid hormone
replacement on thyromegaly in children and adolescent with Hashimoto
disease. J Pediatr 1994; 124(4):599-601
14.
Jaruratanasirikul S, Leethanaporn K, Khuntigij P, Sriplung H. The
clinical course of Hashimoto's thyroiditis in children and
adolescent: 6 years longitudinal follow-up. J Pediart Endocrinol
Metab 2001 Feb;14(2):177-84
15.
Zimmermann MB, Moretti D, Chaouki N, Torresani T. Introduction of
iodized salt to severely iodine-deficient children does not provoke
thyroid autoimmunity: a one year prospective trial in northen
Morocco. Tyroid. 2003 Feb; 13(2):199-203
16.
Markou K, Georgopoulos N, Kyriazopoulou V, Vagenakis AG.
Iodine-induced hypothyroidism. Thyroid 2001 May; 11(5):501-10
17.
Pacini F, Vorontsova T, Molinaro E et al. Prevalence of thyroid
autoantibodies in children and adolescents from Belarus exposed to
the Chernobyl radioactive fallout. The Lancet 1998;352;763-66.
18.
Oerbeck B. Sundet K, Kase BF, Heyerdahl S. Congenital hypothyrodism:
influence of disease severity and L-thyroxine treatment on
intellectual, motor, and school-associated outcomes in young adults.
et al. Pediatrics 2003;112:923-930
19.
Delange F. Neonatal screening for congenital hypothyroidism: results
and perspective. Horm Res 1997;48:51-65
20. Weber
G. Mora S. et al. Cognitive function and neurophysiological
evaluation in early-treated hypothyroid children. Neurol Sci 2000 ;21
:307-314
21.
Siragusa V, Terenghi A, Rondanini GF, Vigone MC, Galli L, Weber G,
Chiumello G. Congenital hypothyroidism: auxological retrospective
study durino the first six years of age. J Endocrinol Invest
1996;19:224-229
22. Rovet
J. Daneman D. Congenital hypothyroidism: a review of current
diagnostic and tretaemnt practices in relation to neuropsychologic
outcome. Paediatr Drugs 2003 ;5:414-149
23.
Fliers E. Wiersinga WM. Screening pregnant women for hypothyroidism:
as yet only in high risk groups. Ned Tijdschr Geneeskd
2003;147:1159-1161
Vuoi citare questo contributo?
