Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Settembre 2010 - Volume XIII - numero 7
M&B Pagine Elettroniche
Il punto su
L’
emocromatosi neonatale o, meglio, l’epatite congenita alloimmune:
nuove definizioni per nuove terapie
Clinica
Pediatrica, IRCCS “Burlo Garofolo”, Trieste
Indirizzo
per corrispondenza: sara83lega@hotmail.com
Neonatal
haemochromatosis or, better, congenital
alloimmune hepatitis: new definitions for new therapies Keywords Neonatal
haemochromatosis, Acute liver failure, Alloimmune disease,
Intravenous immunoglobulin Summary Neonatal
Haemochromatosis (NH) is a rare gestational disease often
presenting with foetal death or acute liver failure in the
newborn. The disease is historically described as severe with low
survival rates despite treatments. The mechanism leading to
develop NH phenotype has been object of debate for long, and in
recent years observations about the high rate of recurrence in
siblings have led to hypothesize that NH is an alloimmune disease
for which the definition of congenital alloimmune hepatitis would
fit better. Based on the alloimmune hypothesis, intravenous
immunoglobulin (IVIg) therapy was applied both to prevent
recurrence in mothers at risk of bearing infants with NH and to
treat neonates with the disease. The significant improvement in
survival rates observed in both fields with IVIg treatment
further supports the alloimmune hypothesis and represents a
turning point for the history of the disease. |
|
L’emocromatosi
neonatale (EN) è una malattia gestazionale caratterizzata sul
piano clinico dall’associazione di danno epatico grave a
esordio precoce (già dalla fine del II trimestre di
gravidanza) e siderosi extraepatica, con una distribuzione del ferro
depositato nei tessuti simile a quello dell’emocromatosi
ereditaria1-4. Una delle modalità più
frequenti di presentazione della malattia, a causa della severità
del danno epatico, è la morte del feto che si verifica in
genere tra il II e il III trimestre di gravidanza5,6.
Nel
neonato, l’EN è una delle cause più frequenti di
insufficienza epatica7,8, rappresenta inoltre una delle
principali indicazione al trapianto di fegato (OLT, orthotopic liver
transplantation) nei primi tre mesi di vita9,10. La
prognosi è spesso severa, con una percentuale di sopravvivenza
intorno al 20% nei pazienti trattati con l’associazione di
ferrochelanti e antiossidanti8,11,12 e di circa il 50% nei
pazienti sottoposti a OLT9; la probabilità di
recidiva in una gravidanza successiva a un caso è inoltre
molto elevata, circa l’80%5,6.
In
passato sono state proposte numerose ipotesi per spiegare l’origine
dell’EN; l’ipotesi a oggi più convincente è
che si tratti di una malattia alloimmune, causata cioè dal
passaggio transplacentare di anticorpi materni diretti contro
antigeni epatici non ancora identificati, e che la siderosi
extraepatica tipica della malattia sia di fatto un epifenomeno del
danno epatico severo e precoce10.
Proprio a
partire dall’ipotesi alloimmune è stata proposta e
sperimentata una terapia semplice (le immunoglobuline) che sembra
essere efficace sia nel migliorare la sopravvivenza dei neonati
affetti da EN che nel prevenire la ricorrenza del danno epatico nelle
gravidanze successive6,13,14.
In epoca
neonatale il quadro di presentazione dell’EN è spesso
quello di un neonato pretermine con una storia gestazionale
caratterizzata da segni di sofferenza fetale (IUGR,
oligoidramnios, segni ecografici indiretti di danno epatico con edema
placentare o fetale al III trimestre)1 che a poche ore
dalla nascita, o più raramente a distanza di giorni o
settimane15, presenta ittero, edemi diffusi con
o senza ascite, e segni di insufficienza multiorgano
associati ai reperti laboratoristici dell’insufficienza
epatica: ipoglicemia, ipoprotidemia con ipoalbuminemia,
iperbilirubinemia (in molti casi sia diretta che indiretta) e
coagulopatia marcata10.
La
diagnosi differenziale in un quadro di questo genere si pone con le
altre principali cause di insufficienza epatica: cause metaboliche,
principalmente tirosinemia, mitocondriopatie, difetti congeniti del
ciclo dell’urea che però non danno mai un quadro di
sofferenza fetale e in genere si presentano a qualche settimana dalla
nascita e le cause infettive (principalmente HSV 1 e 2, CMV, HHV6)
che possono condizionare il decorso dell’ultimo periodo della
gravidanza ma che raramente si presentano con un danno epatico
isolato7,8.
Gli
elementi clinici e laboratoristici più importanti, anche se
non strettamente specifici, che devono mettere in allarme sulla
possibilità che si possa trattare di una EN sono gli edemi
diffusi e l’ascite spesso severa (si potrebbe dire che
un’ascite neonatale è un’emocromatosi fino a prova
contraria), la ipotransferrinemia con ipersaturazione della
transferrina, l’aumento solo modesto delle aminotranferasi
(come nel caso di N., vedi Box), e l’aumento
invece importante dell’α-fetoproteina, dai 100.000
ai 600.000 ng/ml con valori normali < 80.000 ng/ml5
(che N. non aveva). L’iperferritinemia (> 800 ng/ml) è
un reperto costante ma aspecifico, potendosi riscontrare in tutte le
cause di insufficienza epatica neonatale12,16; di
frequente riscontro è anche l’anemia10 (vedi Tabella
I).
- Glucosio
↓ ↓
INR≥ 2
PT≥ 20
Albumina↓ ↓
Bilirubina↑ ↑
ASTN/↑
ALTN/↑
AFP↑ ↑
Ferritina> 800 ng/ml
% sat. transferrina↑ ↑
Transferrina↓
Una volta
avanzato il sospetto, ed escluse le altre cause di insufficienza
epatica in epoca neonatale, la diagnosi di certezza si ottiene
documentando l’accumulo di ferro nei tessuti extraepatici10.
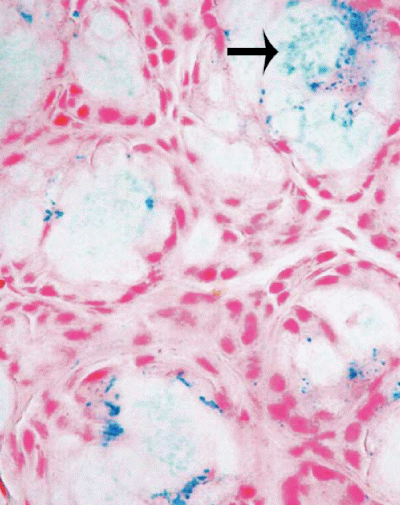
Le indagini proposte a questo proposito sono la biopsia delle
ghiandole salivari17,18 (Figura 1),
che di per sé è un'indagine aspecifica, ma che assume
un significato diagnostico importante inserita nel contesto clinico e
laboratoristico4, e la risonanza magnetica (RM)8,19. Nel neonato con EN i depositi di ferro interessano tipicamente
cuore, pancreas esocrino, tiroide e ghiandole sottomucose, che
risultano quindi ipointensi nelle sequenze RM pesate in T2,
risparmiando i tessuti del sistema reticolo endoteliale2,3:
milza e linfonodi (Figura 2). Anche la siderosi
epatica è evidente all’RM ma si tratta di un reperto non
esclusivo di EN che in alcuni casi può addirittura
mancare19,20.
La
biopsia epatica non viene in genere indicata come esame diagnostico,
anche perché può essere un esame rischioso vista la
coagulopatia, può comunque essere indicata per stabilire la
severità del danno epatico e guidare la scelta
terapeutica21,22. Il quadro istologico mostra danno
epatico severo e cirrosi; il normale parenchima può essere
completamente sostituito da elementi necrotici e tessuto fibroso.
Possono poi essere presenti noduli di rigenerazione e depositi
granulari di ferro, frequenti ma non sempre presenti, a livello
epatocitario5.
Figura
1. Depositi granulari di emosiderina nelle ghiandole salivari
(freccia). Da voce bibliografica 17.
Figura
2. Siderosi epatica e pancreatica (frecce): l’intensità
del segnale è marcatamente ridotta alle sequenze RMN pesate in
T2. La milza è risparmiata. Da voce bibliografica 31.

Perché
si verifica?
L’ipotesi
a oggi più convincente, avanzata da Whitington et al., circa
la patogenesi dell’emocromatosi neonatale è che si
tratti di una malattia alloimmune, sul modello dell’eritroblastosi
fetale, e che la siderosi tipica di questa malattia sia di fatto un
epifenomeno del danno epatico immunomediato10,22. Per
questo motivo gli stessi autori suggeriscono la definizione, più
appropriata, di “epatite congenita alloimmune”10.
Sia
l’alto tasso di recidive (circa l’80%) nelle gravidanze
successive a un caso indice5,23, sia la possibilità
per una donna di avere un secondo bambino affetto seppur con un padre
diverso, ma non viceversa5,6, sono evidenze a favore
dell’ipotesi immunologica e del fatto che l’EN sia una
malattia allo immune causata dal sistema immunitario della madre e
rivolta contro il feto e non una malattia primitiva fetale. L’ipotesi
alloimmune proposta da Whintington et al. ha ribaltato quanto si
riteneva in passato, ovvero che il danno epatico fosse secondario
all’accumulo di ferro geneticamente determinato (in analogia
con le forme di emocromatosi ereditaria), aprendo nuove importanti
prospettive circa il trattamento dei neonati con EN di cui parleremo
di seguito.
Per
capire come la siderosi possa essere conseguenza del danno epatico è
necessario ricordare il ruolo del fegato nella regolazione
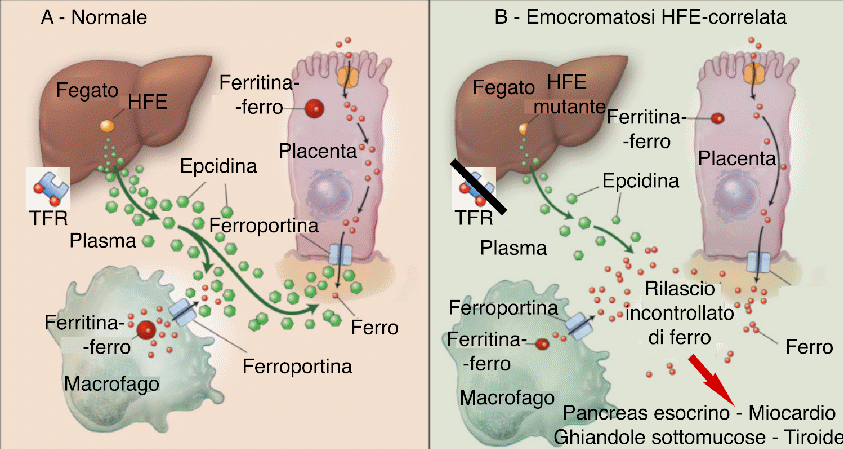
dell’omeostasi del ferro. Il fegato produce alcune proteine
fondamentali per lo stoccaggio e la distribuzione del ferro
nell’organismo, tra queste la transferrina e l’epcidina.
Il ruolo della transferrina è quello di trasportare il ferro
nel sangue e favorirne l’introduzione nelle cellule. L’epcidina
d’altra parte ha la funzione di limitare l’ingresso del
ferro nel circolo in condizioni di bilancio positivo (Figura
3a). L’epcidina agisce inducendo l’internalizzazione
e la distruzione della ferroportina5,24, una proteina
transmembrana che funziona come porta di ingresso nel circolo del
ferro proveniente dal duodeno nella vita postnatale e dalla placenta
nel feto, e dal sistema reticolo endoteliale25.
In
presenza di un danno epatico imponente come quello che si verifica
nell’emocromatosi neonatale, la produzione di epcidina e
transferrina risulterebbe compromessa. In assenza di epcidina ci
sarebbe un ingresso incontrollato di ferro nel circolo fetale
(attraverso la placenta e dai depositi del sistema
reticolo-endoteliale). Il ferro rimarrebbe per lo più libero a
causa della carenza di transferrina e andrebbe a depositarsi in quei
tessuti in grado di captare il ferro non legato alla transferrina5,22
ovvero pancreas esocrino, miocardio, tiroide e ghiandole submucose
che sono di fatto i tessuti dove il metallo si accumula nella EN
(Figura 3b). Il perché tutto ciò
avvenga esclusivamente nell’epatite congenita alloimmune e non
nelle altre cause di insufficienza epatica neonatale non è del
tutto chiaro ma si ipotizza possa essere correlato alla peculiare
severità e precocità di insorgenza del danno
epatocitario22.
Figura
3. (a) In condizioni normali il fegato produce transferrina ed
epcidina che regolano l’omeostasi del ferro nell’organismo.
La transferrina trasporta il ferro nel plasma mentre l’epcidina
regola negativamente l’ingresso del ferro nel sistema dalla
placenta e dalle cellule del sistema reticolo endoteliale. (b) In
condizioni di danno epatico severo transferrina ed epcidina non sono
prodotte si verifica quindi un ingresso incontrollato di ferro che si
deposita a livello dei tessuti in grado di internalizzare il ferro
senza l’aiuto della TRF. Modificata da voce bibliografica 32.
Nella
maggior parte dei casi la prognosi dell’EN è infausta,
con una aspettativa di vita di giorni o settimane1,10,12.
In alcuni casi tuttavia è stata descritta una guarigione
spontanea (con la sola terapia di supporto) con normalizzazione dei
parametri clinici e laboratoristici, risoluzione della cirrosi e
normalizzazione quadro istologico a livello epatico10,21,26-28.
Le
opzioni terapeutiche più a lungo utilizzate con l’intento
di modificare la storia naturale della malattia, sono una terapia
medica, che prevede l’associazione di ferrochelanti
(desferroxamina) e antiossidanti (acetilcisteina, selenio, vitamina
E, PGE1)10 e il trapianto di fegato.
Il
trattamento con la sola terapia medica, utilizzata partendo
dall’ipotesi, oggi difficile da sostenere, che l’accumulo
di ferro potesse essere il primum movens del danno epatico, sembra di
fatto scarsamente efficace nel modificare il decorso della malattia
se non nei casi meno severi12.
Il
trapianto di fegato, d’altro canto, anche se sembrerebbe dare
maggiori possibilità di sopravvivenza28,29, può
essere di difficile esecuzione per la prematurità, il basso
peso e l’insufficienza d’organo multisistemica30.
Inoltre sembra non poter essere l’unica opzione terapeutica,
vista la possibilità della malattia di regredire completamente
a livello istologico lasciando il fegato indenne21.
Un
approccio più razionale al trattamento dell’EN, alla
luce delle acquisizioni sulla patogenesi alloimmune della malattia,
si basa sull’utilizzo delle immunoglobuline endovena (IgIV).
Le IgIV
sono state studiate sia nel trattamento del neonato con EN che nella
prevenzione della ricorrenza della malattia nelle donne con
precedente neonato affetto da EN e il loro utilizzo sembra di fatto
poter modificare la storia naturale della malattia e migliorare la
prognosi dei pazienti.
In un
recente studio di Rand et al.13, 16 neonati con diagnosi
di EN e insufficienza epatica sono stati trattati con alte dosi di
IgIV, con l’associazione di exanguinotrafusione (ET) in 13
casi. Scopo dello studio era di valutare la percentuale di
sopravvivenza senza ricorso al trapianto di fegato dei pazienti
trattati con ET/IgEV a confronto con una gruppo di controlli storici
(131 pazienti) trattati con le terapie convenzionali (antiossidanti e
ferrochelanti o sola terapia di supporto). Nei soggetti trattati con
ET/IgEV la percentuale di sopravvivenza senza ricorso all’OLT è
stata del 72% (12/16 neonati) contro il 17% (23/131) dei controlli
storici. Tra i pazienti sopravvissuti, trattati con ET/IgEV, tutti
sono andati incontro a completa guarigione normalizzando il quadro
clinico e laboratoristico.
Per
quanto riguarda invece la profilassi delle recidive nei neonati da
madri con una storia di EN in una precedente gravidanza, ci sono
crescenti evidenze circa l’efficacia delle IgIV, somministrate
settimanalmente endovena a partire dalla 18a settimana di gestazione
alla dose di 1 g/kg di peso corporeo, nell’attenuare
l’espressione della malattia nelle gravidanze successive.
Nonostante infatti in molti neonati ci sia evidenza laboratoristica
di danno epatico (aumento dell’alfafetoproteina,
iperferritinemia, INR > 2), la perdita fetale è un
evenienza rara e non si verifica mai una insufficienza epatica
clinicamente evidente14. La maggior parte di questi
neonati guarisce senza alcuna terapia, e senza segni di danno epatico
residuo6,14.
L’EN
rappresenta una delle cause più frequenti di insufficienza
epatica nel neonato e il suo esordio si colloca già in epoca
fetale. La prognosi di questa malattia è severa nella maggior
parte dei casi non trattati o trattati con le terapie convenzionali e
la percentuale di recidiva nelle gravidanze successive a un caso è
estremamente elevata.
L’EN
è certamente una malattia rara, ma merita di essere conosciuta
soprattutto alla luce delle recenti acquisizioni sulla patogenesi che
hanno aperto nuove prospettive terapeutiche rappresentando una svolta
importante nella storia della malattia.
L’utilizzo
IgIV a scopo terapeutico sembra infatti poter migliorare la
probabilità di sopravvivenza senza ricorso all’OLT dei
neonati affetti da EN, mentre il loro impiego nelle madri con storia
di EN in una precedente gravidanza sembra poter attenuare
l’espressione fenotipica della malattia nei casi di recidiva,
impedendo lo sviluppo di insufficienza epatica severa e favorendo la
guarigione spontanea.
Bibliografia
1.
Knisely AS, Mieli-Vergani G, Whitington PF. Neonatal hemochromatosis.
Gastroenterol Clin North Am 2003;32:877-89.
2.
Knisely AS. Neonatal hemochromatosis. Adv Pediatr 1992;39:383-403.
3.
Goldfischer S, Grotsky HW, Chang CH, et al. Idiopathic neonatal iron
storage involving the liver, pancreas, heart, and endocrine and
exocrine glands. Hepatology 1981;1:58-64.
4. Murray
KF, Kowdley KV. Neonatal hemochromatosis. Pediatrics 2001;108:960-4.
5.
Whitington PF. Fetal and Infantile hemochromatosis. Hepatology
2006;43:654-60.
6.
Whitington PF, Hibbard JU. High-dose
immunoglobulin during pregnancy for recurrent neonatal
haemochromatosis. Lancet 2004;364:1690-8.
7. Durand
P, Debray D, Mandel R, et al. Acute liver failure in infancy: a
14-year experience of a pediatric liver transplantation center. J
Pediatr 2001;139:871-6.
8.
Whitington PF,
Kelly S, Ekong
UD. Neonatal
hemochromatosis: fetal liver disease leading to liver failure in the
fetus and newborn. Pediatr Transplant
2005;9:640-5.
9.
Rodrigues F, Kallas M, Nash R, et al. Neonatal hemochromatosis:
medical treatment vs transplantation: the king’s
experience. Liver Transpl 2005;11:1417-24.
10.Whitington
PF. Neonatal hemochromatosis: a congenital
alloimmune hepatitis. Semin Liver Dis 2007;27:243-50.
11.
Sigurdsson L,
Reyes J, Kocoshis
SA, et al.
Neonatal hemochromatosis: outcomes of pharmacologic and surgical
therapies. J Pediatr Gastroenterol Nutr.
1998;26:85-9.
12.
Flynn DM, Mohan N, McKiernan P, et al. Progress in treatment and
outcome for children with neonatal haemochromatosis. Arch Dis Child
Fetal Neonatal Ed 2003;88:F124-7.
13.
Rand EB, Karpen
SJ, Kelly S,
et al. Treatment of neonatal
hemochromatosis with exchange transfusion and intravenous
immunoglobulin. J Pediatr 2009;155:566-71.
14
Whitington PF,
Kelly S. Outcome
of pregnancies at risk for neonatal hemochromatosis is improved by
treatment with high-dose intravenous immunoglobulin. Pediatrics2008;121:e1615-21.
15. Ku
SW, Luk IS, Yuen MK, Wong CP. Subacute hepatic failure after the
perinatal period with haemochromatotic siderosis at the age of 11
months: an unusual perspective on neonatal haemochromatosis. Acta
Paediatr 2002;91:856-8.
16. Lee
WS, McKiernan PJ, Kelly DA. Serum ferritin level in neonatal
fulminant liver failure. Arch Dis Child Fetal Neonatal Ed
2001;85:F226.
17.
Knisely AS, O’Shea PA, Stocks JF, Dimmick JE. Oropharyngeal and
upper respiratory tract mucosal-gland siderosis in neonatal
hemochromatosis: an approach to biopsy diagnosis. J
Pediatr 1988;113:871-74.
18. Smith
SR, Shneider BL, Magid M. Minor salivary gland biopsy in neonatal
hemochromatosis. Arch Otolaryngol Head Neck Surg 2004;130:760-63.
19. Hayes
AM, Jaramillo D, Levy HL, et al. Neonatal hemochromatosis: diagnosis
with MR imaging. Am J Radiol 1992;159:623-25.
20.
Saenz MS, Van
Hove J, Scharer
G. Neonatal liver failure: a genetic and
metabolic perspective. Curr Opin Pediatr.
2010;22:241-5.
21.Ekong
UD, Melin-Aldana
H, Whitington PF.
Regression of severe fibrotic liver disease in 2 children with
neonatal hemochromatosis.J Pediatr
Gastroenterol Nutr. 2008;46:329-33.
22.
Pan X, Kelly S, Melin-Aldana H, Malladi P, Whitington PF. Novel
mechanism of fetal hepatocyte injury in congenital alloimmune
hepatitis involves the terminal complement cascade.Hepatology.
2010;51:2061-8.
23.
Shneider BL. Genetic counseling in neonatal hemochromatosis. J
Pediatr Gastroenterol Nutr 2002;34:328.
24.
Nemeth E, Tuttle MS, Powelson J, et al. Hepcidin regulates cellular
iron efflux by binding to ferroportin and inducing its
internalization. Science 2004;306:2090-93.
25.
Donovan A, Lima CA, Pinkus JL, et al. The iron
exporter ferroportin/Slc40a1 is essential for iron homeostasis. Cell
Metab 2005;1:191-200.
26.
Inui A, Fujisawa T, Kubo T, et al. A case
of neonatal hemochromatosis-like liver failure with spontaneous
remission. J Pediatr Gastroenterol Nutr 2005;40:374-377.
27.
Bellini C, Mazzella M, Scopesi F, Serra G. Spontaneous recovery in
neonatal hemochromatosis. J Hepatol 2004;41:882-883.
28.
Grabhorn E, Richter A, Burdelski M, Rogiers X, Ganschow R. Neonatal
hemochromatosis: long-term experience with favorable outcome.
Pediatrics 2006;118:2060-5.
29.
Heffron T, Pillen T, Welch D, et al. Medical and surgical treatment
of neonatal hemochromatosis: single center experience. Pediatr
Transplant 2007;11:374-8.
30.
Sundaram SS, Alonso EM, Whitington PF. Liver transplantation in
neonates. Liver Transpl 2003;9:783-8.
31.
Escolano-Margarit MV, Miras-Baldó
MJ, Parrilla-Roure M, Rivera-Cuello M, Narbona-López E.
Exchange Transfusion as a Possible Therapy
for Neonatal Hemochromatosis. J Pediatr
Gastroenterol Nutr 2010;50:566-8.
32.
Pietrangelo A. Hereditary hemochromatosis: a new look at an old
disease. N Engl J Med 2004;350:2383-97.
Vuoi citare questo contributo?
