Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Marzo 2007 - Volume X - numero 3
M&B Pagine Elettroniche
Pediatria per l'ospedale
Il
parto (Parte prima)
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza: bartolozzi@unifi.it
Il
parto e la sua fisio-patologia sono di stretta competenza ostetrica:
ne consegue che i pediatri non ne conoscono che in parte i meccanismi
che lo regolano, mentre i neonatologi, che vivono spalla a spalla con
gli ostetrici, ne conoscono gli aspetti pratici più evidenti.
Eppure anche i pediatri sono direttamente interessati a farsi carico,
sia pure in ritardo di qualche giorno, del frutto umano del parto,
per cui penso sia opportuno che anche essi ne conoscano i meccanismi
più fini, aggiornati al massimo.
Una
recente revisione dell'argomento ne offre l'opportunità:
Roger Smith. Parturition. N Engl J Med 2007;356:271-83.
Il
termine Parturition è il nome, tipicamente americano, con il
quale si indica il parto; il termine inglese, presente in tutta la
letteratura ufficiale, è invece quello di Delivery.
I
meccanismi che determinano il parto negli umani sono stati a lungo
misconosciuti, ma oggi alcune parti del puzzle hanno cominciato a
combaciare. Il primo importante riconoscimento è stato che il
parto della specie umana è un evento precipuamente tipico
degli umani: i modelli animali possono avere una qualche importanza
solo per chiarire alcune circostanze. Ne consegue che i ricercatori
in questo campo debbono concentrare il loro interesse nella donna che
sta per partorire, nonostante le difficoltà etiche nel
condurre studi che interessino le donne al parto.
E'
ormai acquisizione comune che minore è la durata della
gestazione (prematuranza) e maggiore è l'associazione con la
mortalità perinatale e con la morbilità infantile: da
un recente studio svedese (Himmelmann K et al. Acta Paediatr
2005;94:287-94) risulta che il 50% dei bambini con paralisi cerebrale
sono nati prematuramente.
Le
caratteristiche uniche del parto nella specie umana
Mentre
fra i mammiferi sono presenti numerosissimi punti di contatto nei
confronti di numerosi aspetti anatomico-funzionali, essi si
differenziano notevolmente per quanto riguarda la riproduzione. Lo
sviluppo della placenta è un aspetto comune nella maggioranza
dei mammiferi, mentre le differenze sulle modalità del parto
sono molto forti. L'analisi genomica comparativa ha messo in
evidenza che circa il 95% delle sequenze del DNA sono a comune fra
gli umani e gli chimpanzé: una della maggiori differenze fra
le due specie sta proprio nei geni deputati alla riproduzione.
Inoltre esistono forti differenze nell'anatomia della pelvi del
sesso femminile, con la comparsa della postura eretta
dell'austrolopiteco (un antenato degli umani) e del volume della
testa del feto, in coincidenza dell'evoluzione moderna degli umani:
ambedue questi aspetti hanno dirette conseguenze al momento del parto
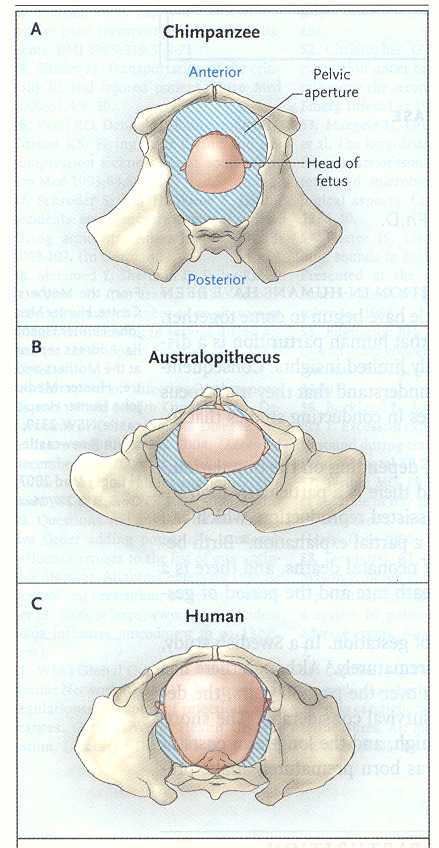
(vedi Figura 1).
La
larga apertura della pelvi dello chimpanze (quadro A) permette il
facile passaggio della relativamente piccola testa del feto in
posizione occipite posteriore. Nell'australopiteco (quadro B)
l'ampiezza dell'osso iliaco, associato alla statura eretta e al
restringimento antero-posteriore dell'apertura della pelvi,
richiede per la fuoriuscita della pesta una posizione laterale. La
pelvi umana (quadro C) ha un'apertura appena sufficiente a
permettere il passaggio della testa del feto in posizione occipite
anteriore.
L'ormone
che libera la corticotrofina e il momento del tempo della nascita
La
gravidanza negli umani dura circa 38 settimane dal concepimento (40
dalla data dell'ultima mestruazione), con minime variazioni fra i
diversi gruppi etnici.
Mentre
nel gatto il momento del parto è strettamente legato alla
maturazione del polmone fetale, negli umani la definizione del tempo
della nascita è associata allo sviluppo della placenta e in
particolare all'espressione del gene dell'ormone che libera la
corticotrofina (CRH) da parte della placenta: si parla a questo
proposito di orologio placentare.
L'ormone
materno liberante la corticotrofina (CRH)
Nella
donna in stato di gravidanza l'ormone liberante la corticotrofina è
secreto dalla placenta. Con l'avanzare della gravidanza i livelli
di CRH aumentano in modo esponenziale. Nelle donne che presentano un
parto pretermine, l'aumento esponenziale è rapido, mentre
nelle donne che partoriscono in ritardo, l'aumento è più
lento (McLean M et al. Nat Med 1995;1:460-3; Torricelli M et al. Eur
J Endocr 2006;154:281-5). Questi rilievi confermano che esiste un
orologio placentare, che determina il momento temporale del parto
La
produzione di CRH da parte della placenta è presente solo nei
primati. Nelle scimmie si hanno livelli medi di CRH, ma solo nelle
grandi scimmie avviene un aumento esponenziale, quale quello che si
vede negli umani. Gli umani e le grandi scimmie producono anche una
proteina circolante che lega il CRH (CRHBP). Alla fine della
gravidanza i livelli di CRHBP cadono, per cui aumenta la
biodisponibilità del CRH. I glicocorticoidi stimolano
l'espressione del gene CRH e quindi la produzione di CRH da parte
della placenta. Il CRH stimola l'ipofisi a produrre corticotrofina
(ACTH) che spinge la corteccia surrenale a produrre cortisolo
(idrocortisone).
La
produzione di CRH da parte della placenta modifica anche i livelli di
estrogeni, progesterone e acido nitrico che esplicano un'azione
inibitoria, e di alcuni neuropeptidi ad azione stimolante.
Ma è
bene ricordare che non tutti i parti pretermine sono dovuti a
cambiamenti nella produzione placentare di CRH: vanno ricordate in
primo luogo le infezioni intrauterine, che inducono il parto
pretermine senza accompagnarsi a un aumento del CRH.
D'altra
parte una singola determinazione del livello di CRH non è
sufficiente per predire un parto pretermine: è molto più
importante la constatazione di un aumento progressivo del CRH, come
predittore del parto. D'altra parte per la valutazione del CRH è
necessario tener conto della razza e del gruppo etnico. Le nere
americane hanno livelli più bassi delle donne bianche.
I
recettori del CRH
Il CRH
viene secreto prevalentemente nel sangue della madre, ma entra anche
nella circolazione fetale.
Il CRH
agisce principalmente legandosi al recettore tipo 1 del CRH, un
membro delle 7 superfamiglie recettoriali delle
proteine-transmembrana. Nella madre i recettori del CRH sono presenti
nell'ipofisi, nel miometrio e probabilmente nelle ghiandole
surrenaliche. Il CRH stimola inoltre le cellule della zona fetale
surrenalica (che moltiplica per cinque volte il volume del surrene),
che mancando di 3β-idrossisteroido deidrogenasi, non porta alla
formazione del DHEA, il precursore placentare degli estrogeni. Come
sappiamo, dopo la nascita, la zona fetale della ghiandola surrenale
va incontro a un'involuzione rapida in seguito all'allontanamento
della placenta; tutto questo indica che fattori placentari, come il
CRH, aumentano il volume della zona fetale del surrene e ne
determinino la riduzione quando la placenta venga espulsa(vedi Figura
2). Il CRH può stimola la steroidogenesi surrenale,
fornendo il substrato alla produzione placentare di estrogeni, che
favorisce il parto, inducendo la contrazione.
Insomma è
evidente che esiste un feedback positivo nella madre e nel feto,
legato a un aumento nella produzione di CRH con l'avanzare della
gestazione. L'aumentata produzione placentare di CRH determina come
conseguenza un cambiamento nella concentrazione di cortisolo fetale,
nella maturazione del polmone fetale, nelle proteine del liquido
amniotico, nei fosfolipidi e nell'espressione dei recettori del
miometrio, che inducono il travaglio e il parto.
Attivazione
del miometrio al termine della gravidanza
Un
importante evento nel travaglio è l'espressione di un gruppo
di proteine, chiamate “proteine associate alla contrazione”.
Queste proteine agiscono entro l'utero, che si trova in stato di
rilasciamento durante la maggior parte della gravidanza, inducendo
forti contrazioni ritmiche che spingono il feto attraverso la cervice
rilasciata. Ci sono tre tipi di proteine associate alla contrazione:
- Quelle che aumentano l'interazione fra le proteine actina e miosina, che causano la contrazione muscolare;
- Quelle che aumentano l'eccitabilità delle singole cellule del miometrio;
- Quelle che promuovono la connessione intercellulare, che permette lo sviluppo delle contrazioni sincrone (vedi Figura 3)
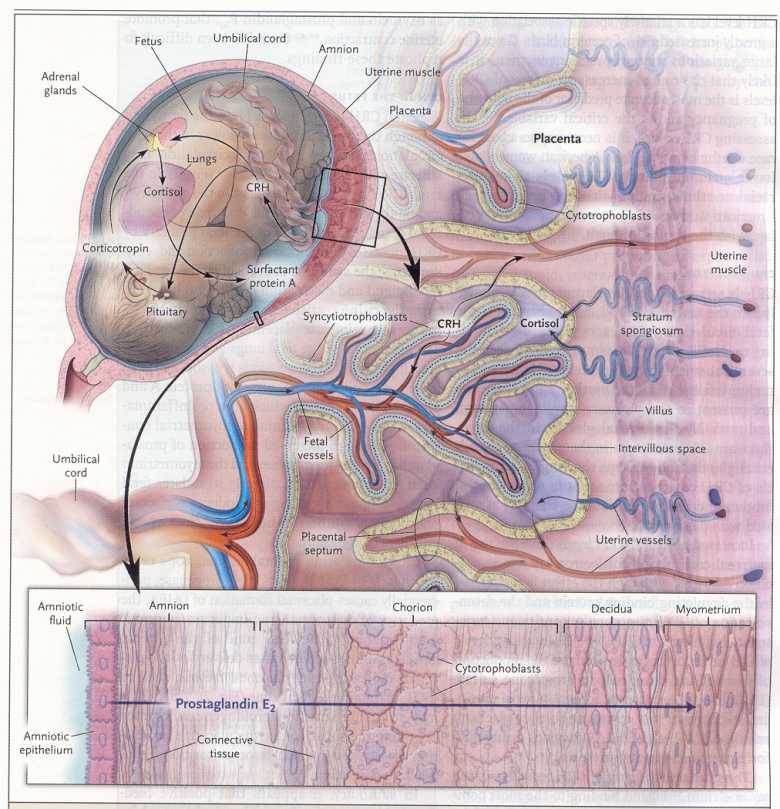
Nello
spazio intervilloso, i sinciziotrofoblasti liberano CRH, progesterone
ed estrogeni nel sangue materno e nel sangue fetale. Il cortisolo
passa attraverso un'arteria materna ed entra nello spazio
intervilloso, dove stimola la produzione di CRH da parte dei
sinciziotrofoblasti. Una vena ombelicale del feto porta il CRH nella
circolazione fetale, stimolando l'ipofisi fetale a sintetizzare
corticotropina (ACTH) e a stimolare la sintesi di cortisolo
surrenalico fetale e di DHEAS. Il cortisolo e il CRH stimolano i
polmoni fetali a produrre la proteina A surfattante, che passa dal
liquido amniotico all'amnion, dove stimola la produzione di
ciclo-ossigenasi 2 (COX-2) e la sintesi di prostaglandine E2. Essi
passano attraverso il corion e la decidua per stimolare le
sottostanti cellule del miometrio a sintetizzate ancora COX-2 e
prostaglandina F2α.
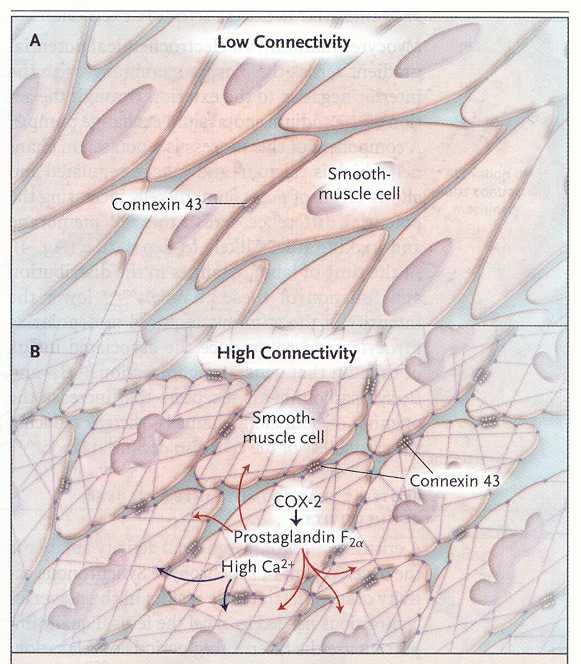
Durante
il parto il miometrio uterino è trasformato da un tessuto con
relativamente bassa connessione fra i singoli miociti (quadro A) a un
tessuto con estese connessioni fra le diverse componenti cellulari
(quadro 2). Le connessioni fisiche avvengono attraverso pori formati
da multimeri di connessina 43. Le connessioni fra i miociti durante
il travaglio sono formate anche dalla liberazione paracrina di
prostaglandina F2. e la locale liberazione di calcio. Queste estese
connessioni fisiche e biochimiche portano alla depolarizzazione dei
singoli miociti, che passa alle cellule vicine in modo da formare una
grande onda di depolarizzazione e contrazione in ampie aree
dell'utero. Queste cause aumentano la pressione intrauterina e la
distensione progressiva della cervice, che porta alla fine
all'espulsione del feto.
Proteine
che promuovono la contrattilità dei miociti
La
contrattilità dei miociti è determinata dall'actina e
dalla miosina.
Perché
avvengano le interazioni è necessario che l'actina sia
convertita in una forma globulare e filamentosa. L'actina inoltre
deve anche attaccarsi al citoscheletro in un punto focale della
membrana cellulare, perché possa svilupparsi la contrazione;
questi punti focali collegano la cellula alla matrice sottostante. Il
partner dell'actina, la miosina, viene attivata quando viene
fosforilata dalla miosin-chinasi a catena leggera. Questo enzima è
attivato dalla calmodulina e dall'aumento del calcio
intracellulare. Dopo la depolarizzazione dei miociti l'arrivo del
calcio extracellulare, lungo i canali del calcio, e la liberazione di
calcio dalle scorte portano a un aumento del calcio intracellulare,
che promuove l'interazione actina-miosina e di conseguenza
determina la contrazione.
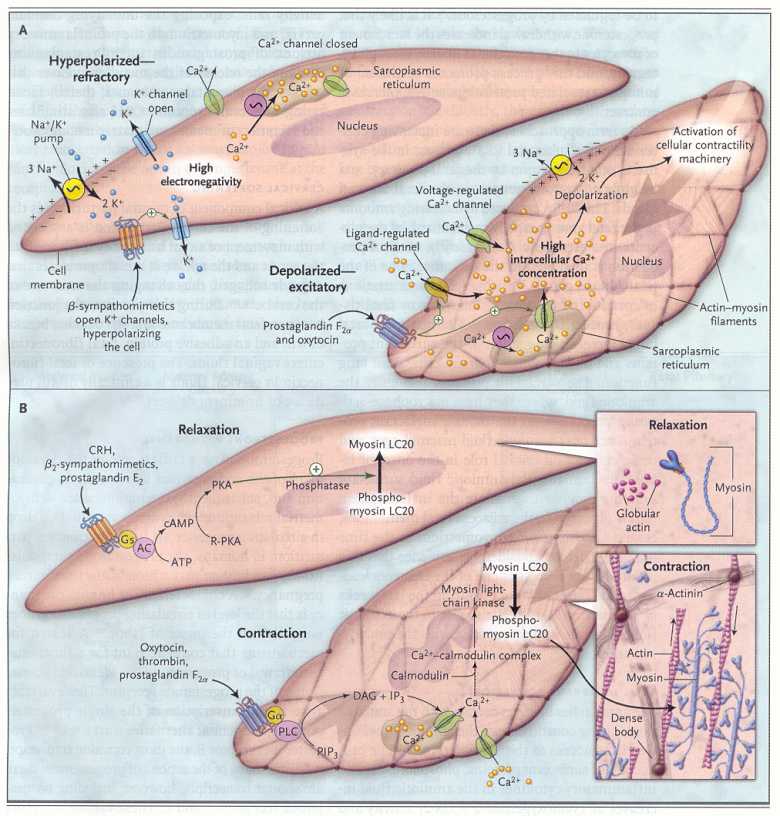
La
nifedipina, un agente che inibisce il travaglio, blocca i canali del
calcio. I canali si aprono quando la prostaglandina riduce il
gradiente elettrochimico attraverso la membrana del miocita (vedi
figura 4). Questi canali, che rilasciano il calcio dalle scorte
intracellulari, sono attivati infatti dalle prostaglandine,
attraverso i recettori E ed F e attraverso la ossitocina, che attiva
le proteine Gα2 legate alla fosfolipasi C. A sua volta la
fosforilasi C attivata, stimola la proteinchinasi C e libera inositol
trifosfato.
Lo
stiramento del miometrio, in seguito alla crescita del feto, può
contribuire alla contrattilità dei miociti, attraverso
l'azione della protein-chinasi mitogeno-attivata. I sistemi che
promuovono il rilasciamento, attraverso la via Gα2 si oppongono
all'aumento intracelluare dell'AMP ciclico e attivano la
proteinchinasi A. Questi enzimi inattivano la miosin chinasi a catena
leggera. Al momento del travaglio, uno spostameno nel bilanciamento
di questi opposti sistemi determina la contrazione dei miociti.
Proteine
che attivano l'eccitabilità dei miociti
I miociti
mantengono un gradiente eletrochimico potenziale attraverso la
membrana cellulare, con interno negativo verso l'esterno,
attraverso l'attività della pompa di scambio
sodio.-potassio. Un componente di questa pompa è un canale del
potassio, che è calcio- e voltaggio-regolato e porta
all'efflusso di potassio, aumentando le differenze di potenziale
attraverso la membrana cellulare e rendendo meno facile la
depolarizzazione (vedi Figura 4). Al momento
del travaglio i cambiamenti nella distribuzione e nella funzione di
questi canali abbassa l'intensità dello stimolo richiesto
per la depolarizzazione dei miociti e determina l'ingresso di
calcio, che porta alla contrazione. I recettori β2 e β3
simpaticomimetici aumentano l'apertura dei canali del potassio,
riducendo l'eccitabilità della cellula.
Proteine
che promuovono la connessione fra le cellule
Un
aspetto fondamentale dell'attività del miometrio al momento
del travaglio è lo sviluppo della sincronia. Infatti
l'attività contemporanea delle cellule del miometrio si
accompagna alle forti contrazioni che sono necessarie per
l'espulsione del feto. Altrettanto importanti sono i periodi di
rilasciamento, che permettono al sangue di raggiungere il feto
(durante la contrazione il sangue che giunge al feto diminuisce e
durante il rilasciamento aumenta). Man mano che ci si avvicina al
parto, aumenta la sincronizzazione dell'attività elettrica
dell'utero.
A livello
cellulare questa sincronia è realizzata dalla conduzione
elettrica attraverso la connessione delle miofibrille, che
trasmettono l'attività elettrica alle fibre muscolari
vicine.
I miociti
attivati producono prostaglandine, che agiscono in modo paracrino a
depolarizzare i miociti circostanti. Questo processo porta a un'onda
di attività, quanti più miociti sono reclutati nella
contrazione. Dopo la contrazione i miociti si rilasciano e divengono
refrattari a una successiva stimolazione.
Le
tipiche contrazioni uterine consistono di un lento aumento e di una
caduta di tensione della durata di un minuto.
Nel
quadro A, prima che inizi il travaglio, il miocita mantiene una
relativamente alta elettronegatività interna, che riduce la
facilità della depolarizzazione e della contrazione. Il
potenziale di membrana a riposo è determinato dalla pompa
sodio-potassio ATPase dipendente, che allontana dalla cellula 3 ioni
sodio ogni due ioni di potassio che entrano nella cellula. I canali
aperti del potassio, permettono al potassio di lasciare la cellula.
Al
momento del travaglio avviene la depolarizzazione, quando la
prostaglandina F2α e l'ossitocina si legano ai recettori della
superficie cellulare, promuovendo l'apertura dei canali del calcio.
L'attivazione di questi recettori promuove la liberazione degli
ioni calcio dai depositi presenti nel reticolo sarcoplasmico. Appena
il calcio entra nella cellula, la caduta della elettronegatività
promuove l'apertura di un gran numero dei canali del calcio,
producendo un rapido movimento di ioni calcio all'interno della
cellula e favorendo quindi la depolarizzazione.
Nel
quadro B, prima del parto, i miociti dell'utero sono mantenuti in
stato di rilasciamento da un insieme di fattori che aumentano l'AMP
ciclico (cAMP) intracellulare. L'aumento del cAMP attiva la
proteinchinasi A, che promuove l'attività della
fosfodiesterasi e la defosforilazione della miosina chinasi a catena
leggera. La defosforilazione della catena della miosina a catena
leggera è determinante per la contrazione dei miociti
dell'utero. Il rilasciamento è quindi promosso da processi
che tendono a mantenere l'actina in una forma globulare per
prevenire la formazione di fibrille di actina, necessarie per la
contrazione.
Al
momento del parto questi processi sono invertiti. All'interno dei
miociti l'actina acquista una forma fibrillare. Il calcio entra
nelle cellule depolarizzante e si combina con la calmodulina a
formare complessi che attivano la miosin chinasi a catena leggera,
che a sua volta fosforilizza la miosina a catena leggere. La
fosforilazione della miosina a catena leggera determina la comparsa
dell'attività dell'ATPasi, che promuove le scivolamento
della miosina sui filamenti di actina e i movimenti che costituiscono
la contrazione.
PKA
= protein chinasi A attiva catalitica
R-PKA
inattiva PKA
IP3
= inositoltrifosfato
PIP3
= fosfatidil-inositoltrifosfato
PLC
= fosfolipase C
DAG
= diacilglicerolo
Vuoi citare questo contributo?
