Rivista di formazione e aggiornamento di pediatri e medici operanti sul territorio e in ospedale. Fondata nel 1982, in collaborazione con l'Associazione Culturale Pediatri.
Settembre 2006 - Volume IX - numero 7
M&B Pagine Elettroniche
Pediatria per l'ospedale
Sclerosi
multipla (Parte prima)
Membro
della Commissione Nazionale Vaccini
Indirizzo
per corrispondenza: bartolozzi@unifi.it
Negli
ultimi anni sono fortemente aumentate le nostre conoscenze sulla
sclerosi multipla (la vecchia sclerosi a placche), sia per quanto
riguarda i meccanismi che portano all'infiammazione, che quelli
della demielinizzazione e della neurodegenerazione. Inoltre, si sono
ampliate le strategie cliniche a disposizione per il trattamento
della malattia.
La
comparsa di una recente revisione di tutti questi aspetti della
sclerosi multipla ci permette di tornare sull'argomento: Frohman
EM, Racke MK, Raine CS. Multiple sclerosis. The plaque and its
pathogenesis. N Engl J Med 2006;354:942-55.
Un
obiettivo centrale nelle ricerche sulla Sclerosi Multipla (SM)
è quello di determinare la sequenza di eventi che porta
allo sviluppo della placca infiammatoria. Generalmente si
pensa che questa lesione isto-patologica origini dalla rottura
dell'integrità della barriera emato-cerebrale in una
persona, geneticamente predisposta alla malattia. Un'ipotesi
suggerisce che alcune forme d'infezione generalizzata possano
causare una stimolazione delle molecole di adesione sull'endotelio
del cervello e del midollo spinale, in modo da permettere ai
leucociti di attraversare la parete dei vasi e di entrare nel sistema
nervoso centrale, di norma immunologicamente isolato. Se
nell'infiltrato cellulare esistono linfociti programmati a
riconoscere l'antigene mielina, essi possono indurre una cascata di
eventi che porta alla formazione di una lesione infiammatoria acuta,
demielinizzante. Queste lesioni tipicamente si sviluppano nella
sostanza bianca, dove il bersaglio principale è rappresentato
dalle guaine mieliniche e dalle cellule che formano la mielina, glioligodendrociti (Figura 1).
D'altra
parte si sa che vi sono anche lesioni della sostanza grigia,
nelle quali di nuovo il bersaglio principale è rappresentato
dalla mielina.
Cellule
interessate nella patogenesi della placca nella sclerosi multipla
Cellule
T
Studi
sugli animali hanno confermato la teoria che la sclerosi multipla sia
una malattia immuno-mediata verso uno o più antigeni
della mielina del sistema nervoso centrale. Sia i pazienti con
sclerosi multipla che le persone sane hanno nel sangue periferico un
numero simile di cellule T che reagiscono alla mielina, anche se
questi due gruppi di soggetti hanno differenze qualitative nelle
risposte mediate dalla popolazione di cellule mononucleate circolanti
(cellule B, cellule T e macrofagi):
1. Le
cellule T dei pazienti con sclerosi multipla sono dotate di memoria
(hanno cioè un fenotipo attivato)
2.
Le cellule T delle persone sane, pur essendo specifiche per
l'antigene, hanno un fenotipo “naive”, cioè non
attivato.
Forti
differenze nella secrezione delle citochine e nei recettori delle
chemochine suggeriscono che le cellule T dei pazienti con sclerosi
multipla, reagenti verso la mielina, hanno una maggiore potenzialità
infiammatoria. Inoltre le cellule T CD8+, mielina-specifiche, nei
pazienti con sclerosi multipla in ricaduta, sembrano essere più
abbondanti che nelle persone sane o in quelle con malattia
secondariamente progressiva.
Figura
1. Sezione trasversale delle lesioni della sostanza bianca, che
interessano le guaine mieliniche e gli oligodendrociti.
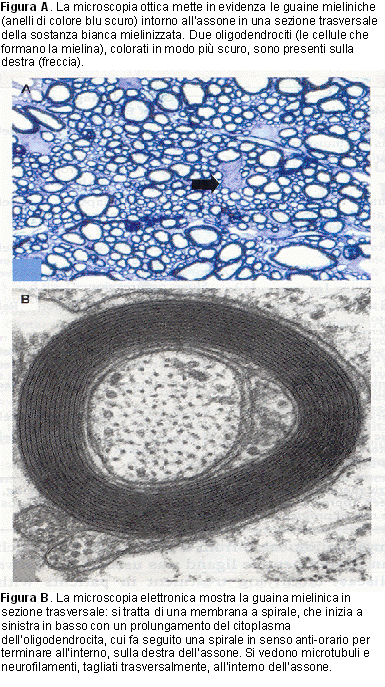
Vi sono
prove che le cellule T, che reagiscono alla mielina, sono
responsabili della demielinizzazione infiammatoria. Le malattie
autoimmuni organo-specifiche, come la sclerosi multipla, si pensa
siano mediate dalle cellule T helper 1 (Th1) che producono
interferon-γ. Altri dati suggeriscono anche che le risposte immuni
infiammatorie e le risposte d'ipersensibilità ritardata
siano principalmente mediate dalle cellule infiammatorie Th1, che
producono linfotossine, interferon γ e poca interleuchina 4.
Alternativamente le cellule CD4+ tipo 2 helper (Th2) rappresentano
una popolazione anti-infiammatoria di linfociti che producono larghe
quantità di interleuchine 4 e 5 di tipo immunoregolatore.
Le
cellule T, reattive verso la mielina, dei pazienti con sclerosi
multipla producono più citochine del tipo Th1, mentre le
cellule T, che reagiscono verso la mielina, delle persone sane
producono soprattutto citochine che sono caratteristiche delle
risposte Th2-mediate.
Numerosi
studi sperimentali sono stati eseguiti anche sull'interferon β e
sulle interleuchine 12, 23 e 17.
Cellule
B
E' stato
visto che è aumentata la sintesi intratecale di
immunoglobuline in pazienti con sclerosi multipla. Molti studi
hanno dimostrato che questi anticorpi riconoscono la mielina e sono
rivolti anche verso altri antigeni, in via di definizione.
L'eccessiva espressione dei geni di queste immunoglobuline e dei
loro recettori Fc nelle lesioni della sclerosi multipla suggerisce
che colpire il componente della risposta immune della cellula B (per
esempio con il rituximab) può rappresentare una strategia
terapeutica vincente (Tabella 2).
Altre
cellule immuni
E'
possibile che altre cellule immuni giochino un ruolo nella patogenesi
della sclerosi multipla. Per esempio cellule regolatrici, come
CD4+/CD25+ e CD8+, sembrano essere scarse nei pazienti con questa
malattia. Il glatiramer acetato, che può aumentare il numero
di queste cellule regolatrici, può rappresentare un mezzo per
ricostruire la tolleranza per questo auto-antigene (Tabella
1).
Trattamento | Meccanismo
d'azione | Usi
ed effetti | Forme
di SM | |
Approvati
dalla Food and Drug Administration | Interferon
β | Inibisce
l'adesione
Inibisce
la sintesi e il trasporto delle metalloproteinasi
Blocca
la presentazione degli antigeni | Trattamento
delle ricadute
Rallenta
la progressione
Riduce
le lesioni viste alla RM
Potenzia
i benefici cognitivi | Nelle
ricadute |
Glatiramer
acetato
| Aumenta
le cellule T regolatrici
Sopprime
le citochine infiammatorie
Blocca
la presentazione dell'antigene | Trattamento
delle ricadute
Riduce
le lesioni viste alla RM
Rallenta
la progressione | Nelle
ricadute, remissioni | |
Mitoxantrone | Riduce
le citochine Th1
Elimina
i linfociti | Trattamento
delle ricadute
Riduce
le lesioni viste alla RM
Rallenta
la progression | Nelle
ricadute, remissioni
Nella
progressione secondaria
Nelle
ricadute progressive | |
Possibili
terapie aggiuntive | Corticosteroidi
per EV o per os | Inibiscono
le sintesi e il trasporto delle metalloproteine
Alterano
il profilo delle citochine
Riducono
l'edema del SNC | Trattamento
e prevenzione
delle
ricadute
| Nelle
ricadute |
Azatioprina | Inibisce
la sintesi delle purine
Riduce
le cellule B, le cellule T e i macrofagi | Trattamento
delle ricadute
Rallenta
la progressione | Nelle
ricadute/remissioni
Nella
progressione secondaria | |
Metotrexato | Agisce
come antagonista dei folati
Riduce
la sintesi del DNA nelle cellule immuni | Rallenta
la progressione | Nella
progressione secondaria | |
Plasmaferesi | Allontana
gli anticorpi pericolosi | Trattamento
delle ricadute | Nelle
ricadute | |
Immunoglobuline
per endovene | Hanno
effetti anti-idiotopici
Bloccano
i recettori Fc
Alterano
il profilo delle citochine | Trattamento
e prevenzione delle ricadute | Nelle
ricadute |
Tabella
1. Scelte per il trattamento della Sclerosi Multipla |
Razionale
o meccanismo | Osservazioni
preliminari | |
Combinazione
di agenti | Obiettivi
multipli | Prove
di attività ridotta alla RM
Riduce
le ricadute |
Rutiximab | Riduce
le cellule B | Prove
cliniche in corso |
Antagonisti
dei recettori delle chemochine | Riducono
l'entrata dei linfociti nel sistema nervoso centrale | Prove
cliniche in corso |
Riluzole | Blocca
l'N-metil-D-aspartato e i canali del sodio | Riduce
l'atrofia del midollo spinale
Riduce
il numero delle lesioni
ipodense
alla RM T1 |
Fenitoina
e fleicanide | Bloccano
i canali del sodio | Neuroprotezione
negli animali
Prove
cliniche in corso |
Bloccano
gli inibitori della crescita nervosa | Promuovono
la crescita assonale | Studi
sugli animali in corso |
Bloccano
NG2, LINGO-1, Notch e Jagged | Promuovono
la differenziazione degli oligodendriciti | Studi
sugli animali in corso |
Attivano
la trascrizione del fattore 1 degli oligodendrociti | Promuovono
la differenziazione degli oligodendrociti | In
sviluppo |
Cellule
staminali | Iniziano
a riparare la mielina | Efficacia
nei modelli animali
Primi
studi negli umani in corso |
Fattori
di crescita | Promuovono
la sopravvivenza dei neuroni | In
sviluppo |
Fattori
antiapoptosi | Promuovono
la sopravvivenza dei neuroni e degli oligodendrociti | Studi
in animali in corso |
Tabella
2. Strategie neuroprotettive e restauratrici nella sclerosi
multipla |
Inizio
della malattia e patogenesi
Sono a
disposizione prove sicure che confermano l'ipotesi che la genetica
gioca un ruolo importante nella suscettibilità delle persone
alla sclerosi multipla, probabilmente insieme a fattori ambientali.
Alcuni ricercatori ritengono che un diretto legame causale sussista
fra vari agenti infettivi e questa malattia: questi agenti
fornirebbero un terreno adatto allo sviluppo di una risposta immune
autoimmunitaria, diretta verso la mielina del sistema nervoso
centrale. Recenti pubblicazioni sull'encefalomielite autoimmune
hanno dimostrato che gli agenti infettivi possono stimolare i toll
recettori -like che riconoscono gli assetti molecolari dell'agente
patogeno. Questi assetti molecolari sono importanti per l'inizio
della malattia e la produzione di interleuchine, specialmente di
interleuchina 12 e 23, che portano alla differenziazione di cellule T
autoreattive. Gli agenti infettivi possono avere anche un ruolo nel
meccanismo centrale che culmina nell'interazione fra cellule T ed
endotelio cerebro-vascolare, attraverso la regolazione di importanti
molecole di adesione per il reclutamento di cellule immuni nel
sistema nervoso centrale.
Queste
molecole di adesione apparterrebbero alla famiglia di recettori di
superficie, le integrine, che promuovono l'adesione e i meccanismi
di trasporto. Sulla base di questi studi si è giunti allo
sviluppo dell'antagonista terapeutico dell'integrina, il
natalizumab, un anticorpo specifico monoclonale verso l'α4-integrina.
Questo agente riduce in modo significativo sia le ricadute cliniche
che la formazione di lesioni gadolinio-aumentanti in pazienti con
sclerosi multipla. La comparsa di leucoencefalopatia multifocale in
pochi pazienti, riceventi il natalizumab in combinazione con
l'interferon, o azatioprina e infliximab, ha determinato il suo
ritiro dal mercato e la sospensione di tutte le prove cliniche nel
febbraio 2005.
Queste
osservazioni sottolineano il principio che strategie, che
interferiscono con il reclutamento di leucociti nella patogenesi
della sclerosi multipla, possono interferire anche con la routinaria
funzione d'immuno-sorveglianza del sistema nervoso centrale.
Molti
altri bersagli e altri interventi terapeutici sono stati
identificati: per esempio è molto interessante la scoperta che
la osteopontina è iperespressa nelle lesioni della sclerosi
multipla e che essa ha un importane ruolo nella progressione della
encefalomielite autoimmune sperimentale.
Nuovi
aspetti della patogenesi della sclerosi multipla
Alla luce
dell'unanime consenso che la patogenesi delle lesioni della
sclerosi multipla è eterogenea, non sorprende che non sia
emerso dagli studi nessun singolo meccanismo predominante per questa
malattia. Quindi per una malattia che comprende forme fulminanti e
forme croniche con un ampio spettro del fenotipo, sono stati proposti
molti meccanismi patogenetici. Infatti il quadro delle lesioni appare
essere totalmente non predicabile: sia i casi acuti che cronici hanno
nuove e vecchie lesioni, dimostrando il carattere dinamico della
malattia. Senza tener conto di questa variabilità innata, le
lesioni finali croniche silenti (senza immunità attiva) sono
un aspetto costante e patognomonico della sclerosi multipla.
Neuropatologia
Gliaspetti istologici della sclerosi multipla acuta includono:
- Margini indistinti
- Ipercellularità
- Intensa infiltrazione perivascolare di piccoli linfociti
- Edema del parenchima
- Perdita della mielina e degli oligodendrociti
- Diffuso danno degli assoni
- Presenza di plasmacellule
- Macrofagi pieni di mielina
- Astrociti ipertrofici
- Scarsa o assente cicatrice astrogliale
La
demielinizzazione nelle lesioni acute può essere dovuta al
fenomeno antimielina anticorpo-mediato, nel quale la normale mielina
lamellare si trasforma in una rete di vescicole, ricoperte da
glicoproteina antimielina oligodendrocitica o da immunoglobulina
basica. Le lesioni sono fagocitate, in presenza di complemento, dai
macrofagi locali. Talvolta si notano processi di rimielinizzazione.
Le
lesioni della sclerosi multipla cronica mostrano bordi
frastagliati; lungo il margine si notano gruppi di cellule
infiltranti perivascolari, macrofagi pieni di lipidi e di mielina,
astrociti ipertrofici e alcuni assoni degenerati con
demielinizzazione. In contrasto con le forme acute, la
demielinizzazione nelle forme croniche attive si associa con la
deposizione di immunoglobuline e dissoluzione della mielina in gocce,
che sono poi fagocitate dai macrofagi. Non sono rari nelle lesioni
croniche, i reperti di oligodendrociti e aree di rimielinizzazione.
Il centro di queste lesioni è povero di cellule e contiene
assoni di nuova formazione all'interno di una matrice di astrociti
cicatriziali (fibrosi), di macrofagi pieni di lipidi, di qualche
linfocita infiltrante, mentre non si nota nessun oligodendrocita. Le
lesioni della malattia cronica silente mostrano margini frastagliati,
tessuto cicatriziale astrogliale, un ridotto numero di assoni senza
mielina, macrofagi e vasi con pareti ispessite ialinizzate, intorno
alle quali si osservano talvolta dei leucociti; queste lesioni
contengono pochi o nessun oligodendrocita.
Figura
2. Lesioni croniche della sclerosi multipla
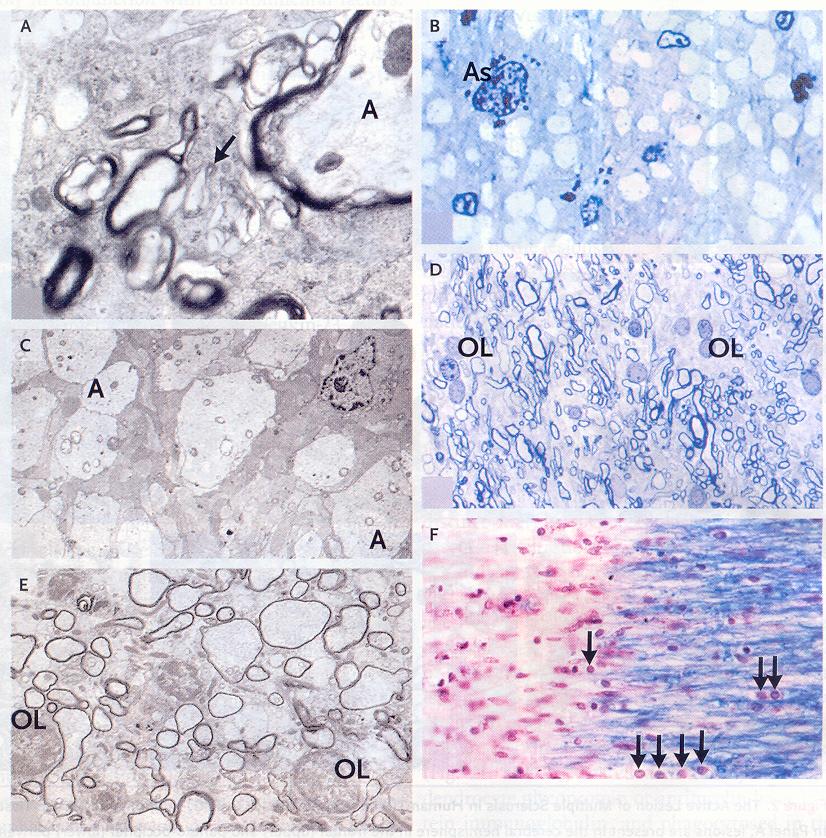
Legenda:
Figura
A. Aspetto al microscopio elettronico di una lesione cronica
attiva, nella quale si osserva una fibra con mielina in via di
demielinizzazione. La freccia mostra gocce di mielina sulla
superficie del macrofago, mentre stanno per essere internalizzate
nella cellula. La fibra è circondata da cellule di microglia,
che sono impegnate nella fagocitosi delle gocce di mielina; le fibre
sono “spogliate” della guaina mielinica.
Figura
B. E' visibile un'area di una lesione cronica silente,
formata da tessuto cicatriziale astrogliale, nel quale sono immersi
assoni intatti demielinizzati; all'interno degli assoni si vedono i
mitocondri; sono presenti piccoli nuclei di cellule della microglia,
ma non si vedono oligodendrociti.
Figura
C. Si tratta di una fotografia al microscopio elettronico, nelle
quale si osservano ampi assoni demielinizzati (A) con cicatrici
gliali. Una cellula astrogliale è presente nell'angolo
superiore destro.
Figura
D. Si tratta di una biopsia da un paziente con sclerosi multipla
progressiva secondaria, nella quale si osserva un'area di
rimielinizzazione con guaine mieliniche sproporzionatamente sottili
in molti assoni, insieme a molti oligodendrociti (OL).
Figura
E. E' evidente la rimielinizzazione. Le guaine mieliniche sono
sottili, in confronto al diametro degli assoni; si vedono due
oligodendrociti (OL).
Figura
F. Si osserva un brusco passaggio da un tessuto apparentemente
normale a una lesione cronica della sclerosi multipla. Le guaine
mieliniche si interrompono bruscamente al limite della placca.
Oligodendrociti sono visibili (frecce) ai margini della lesione, ma
non al suo interno. Cellule della microglia sono visibili al limiti
della lesione.
Vuoi citare questo contributo?
